基于大鼠模型的赤霉素毒理学评价∗
2023-12-02图尔逊娜依艾力雒怡倩吴军强王潇岳海涛
图尔逊娜依·艾力,雒怡倩,吴军强,王潇,岳海涛
(新疆大学生命科学与技术学院,新疆乌鲁木齐 830017)
0 引言
红枣、葡萄等因口感独特、营养价值高深受人们喜爱.有研究显示2012―2021年新疆葡萄种植面积及产量位居我国首位[1].新疆葡萄干产量占全国总产量的95%以上[2].此外,新疆也是我国红枣的主要种植地,红枣产量占据了我国红枣总产量的半壁江山.GA是新疆红枣、葡萄种植中常用的生长调节剂,别名920,分子式为C19H22O[3]6.其生物学活性丰富,且在植物生长发育过程中具有诱导无子果实形成、提高坐果率、改善果实品质、防止落花落果、促进果实早熟等关键作用[4].GA在红枣、葡萄中使用剂量为50∼100 mg/L,在开花期连续喷洒,GA处理后幼果期果实内源GA含量显著上升,果实缓慢生长期枣果内源GA含量快速下降.GA完熟期处理组与对照组相比果实中内源GA含量提高了0.011∼0.031 mg/kg.内源GA含量与骏枣表皮厚度在脆熟期和完熟期呈显著负相关,但相较亚洲国家规定的外源GA在水果及坚果中的使用标准(最大值0.2 mg/kg)存在残留风险[5].
现有研究大部分针对GA膨大功能评价,目前国内对GA急性毒性进行了大量的研究,但多部分仅对个别脏器的损伤进行了宏观评价,对其亚急性毒性研究较少,对重复暴露可能损伤的靶器官不明确且对其毒性效应存在争议.商桑等[6]研究证明GA没有毒性,GA在100 mg/kg剂量范围内重复28天染毒,不会对SD大鼠青春期发育产生显著影响.根据化学物质毒性数据库(https://www.drugfuture.com/)的查询结果,GA对大鼠的LD50>6 300 mg/kg,对小鼠的LD50>8 500 mg/kg,对兔子的LD50>2 g/kg.参照中华人民共和国农业农村部公告第2569号附件14《农药产品毒性分级标准》[7],LD50>5 000 mg/kg剂量样品属微毒级.也有研究表明GA亚急性毒性,对大鼠连续50天经口给GA后,发现大鼠的肝脏、大脑、脾脏、肺部、肾脏和心脏中丙二醛的浓度明显上升,脾脏和肾脏中超氧化物歧化酶的活力明显降低,而大鼠心脏中药物代谢酶谷胱甘肽-S-转化酶活力明显降低[8].Yasin等[9]评估了GA对大鼠的抗氧化防御系统等存在毒性作用.GA可能会对雌性大鼠和它们的幼仔产生肝毒性,大鼠连续摄入200 mg/kg剂量的GA对其肝脏产生损伤[10].
由于GA具有提高产量的作用,且在我国法律和国家行业标准中对GA应用的剂量、期限等并没有具体的指标要求,故GA在农产品和林业产品市场上一直存在着滥用问题.过量或不合理喷洒导致GA在作物中残留,长期食用可能蓄积人体,从而危害健康.因此,对GA进行毒理学评价是非常有必要的.本文通过观察SD大鼠经单次和连续28天按喷洒量的倍数暴露于GA后的毒性反应,初步确定其主要毒性靶器官及毒性反应性质、程度,旨在为GA毒性的准确评价及其安全合理用药、保护环境、生物多样性和人类健康提供科学依据.
1 材料与方法
1.1 主要仪器与试剂(表1)

表1 主要仪器与试剂
1.2 实验动物
根据《农药登记毒理学试验方法第3部分:急性经口毒性试验序贯法》(GB/T 15670.3―2017)指定的实验动物,使用SD大鼠进行动物实验.SPF级SD大鼠购自新疆医科大学动物研究所,体质量180∼220 g,动物生产许可证号:SYXK(新)2021-0004.实验前动物在实验环境中适应3∼5 d.
1.3 实验方法
1.3.1 急性毒性实验
将84只SPF级SD大鼠按体重随机分成6组,每组14只,雌雄各占一半.采用单次灌胃方式染毒,对照组和实验组GA(500、1 000、2 000、4 000、6 500 mg/kg),连续观察14 d,记录大鼠中毒表现,对体重、炎症因子、组织病理学等指标进行监测、评价毒性效应.
1.3.2 亚急性毒性实验
将48只SPF级SD大鼠按体重随机分成4组,每组12只,雌雄各占一半.采用混合饲料染毒方式,对照组和实验组GA(100、200、400 mg/kg)连续染毒28 d,观察14 d,记录大鼠中毒表现,对体重、炎症因子、组织病理学等指标进行监测、评价毒性效应.
1.3.3 炎症因子浓度测定
1)标准品的稀释:在各小试管中加入标准品稀释液110 μL,然后取原浓度标准品110 μL加入试管中,充分混匀;依次加入至第5个试管,从该试管中抽取110 μL,弃掉.第6只试管作为0号标准品.
2)加入待测样品:在酶标包被板上加入不同浓度的标准品50 μL;样本孔中先加样品40 μL,再加生物素标记的抗体10 μL.
3)加酶及温育:除空白孔外,每孔加入酶标试剂50 μL,用封板膜封板后置于37 ℃培养箱中温育30 min.
4)洗涤:将浓缩洗涤液用蒸馏水稀释30倍,小心揭掉封板膜,弃去孔内液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此重复5次,拍干.
5)显色:每孔先加入显色剂A 50 μL,再加入显色剂B 50 μL,轻轻震荡混匀,37 ℃避光显色10 min.
6)终止及测定:每孔加终止液50 μL,终止反应;以空白孔调零,450 nm波长依序测量各孔的吸光度OD值.测定应在加终止液后15 min以内进行.
1.3.4 组织病理学观察脏器组织→10%甲醛固定→乙醇逐级脱水(50%、60%、70%、80%、90%、95%)→二甲苯透明→石蜡浸透和包埋→切片(4 μm)→HE染色→观察记录.
1.3.5 GA风险评估
参照中华人民共和国农业农村部公告第1825号《农药每日允许摄入量制定指南》,采用确定性评估模型对GA风险进行评估,农药短期摄入量计算公式为:
式中:ESTI为农药的估计短期摄入量,HR为残留实验中农药的最高残留量,P为水果日均摄入量,BW为体重.
式中:ARfD为急性参考剂量,UF为急性毒性不确定系数(取100),NOAEL为动物实验中最大未观察到有害作用的剂量(NOAEL是在分析评价相关毒理资料的基础上,找到最敏感动物的最敏感终点).
式中:%ARfD为急性膳食摄入风险值;%ARfD≤100%代表风险考验接受,%ARfD>100%意味着存在不可接受急性风险.
ADI参考《农药每日允许摄入量定制指南(2012年)》[11]进行计算:
式中:NOAEL(mg/kg)为动物实验中最大未观察到有害作用的剂量;UF为不确定系数,根据《指南》要求,不确定系数一般为100,同时结合毒理学实验数据,从4周毒性实验外推至慢性毒性实验需放大10倍,推导得到的安全因子(基于动物实验外推人群时存在的不确定因素而估算的系数)为1 000.
式中:%ADI为慢性膳食摄入风险;%ADI≤100%代表风险考验可接受,%ADI>100%意味着存在不可接受急性风险.STMR为规范实验残留中值.
式中:HI为累积风险;HI≤100%代表风险考验接受,HI>100%意味着存在不可接受急性风险.
2 结果与分析
2.1 GA急性毒性评价
2.1.1 GA对SD大鼠一般情况影响
最大非致死剂量及毒性分级预测.表2列出了SD大鼠单次灌胃给予6 500、4 000、2 000、1 000、500 mg/kg GA后的存活率,剂量在4 000 mg/kg以上时,可见明显单次毒性反应,主要的临床症状为自主活动减少、呼吸困难、腹式呼吸、翻正反射消失、阵挛性抽搐.SD大鼠灌胃给予GA后实验中高剂量组只有1只大鼠出现死亡情况,即最小致死剂量(LD01)为6 500 mg/kg,本次实验并未观察到绝对致死剂量(LD100)和半数致死剂量(LD50),在4 000 mg/kg以下剂量未见明显中毒表现,观察期内无SD大鼠死亡,故本次实验最小观察到有害作用剂量(LOAEL)以及最大非致死剂量(LD0)为4 000 mg/kg,未观察到有害作用剂量(NOAEL)为2 000 mg/kg.本次实验虽然未观察到LD50,但是根据结果可知LD50>6 500 mg/kg,根据食品安全毒性分级,GA属于无毒级LD50>5 000 mg/kg.死亡率-剂量曲线和概率单位-剂量曲线见图1.
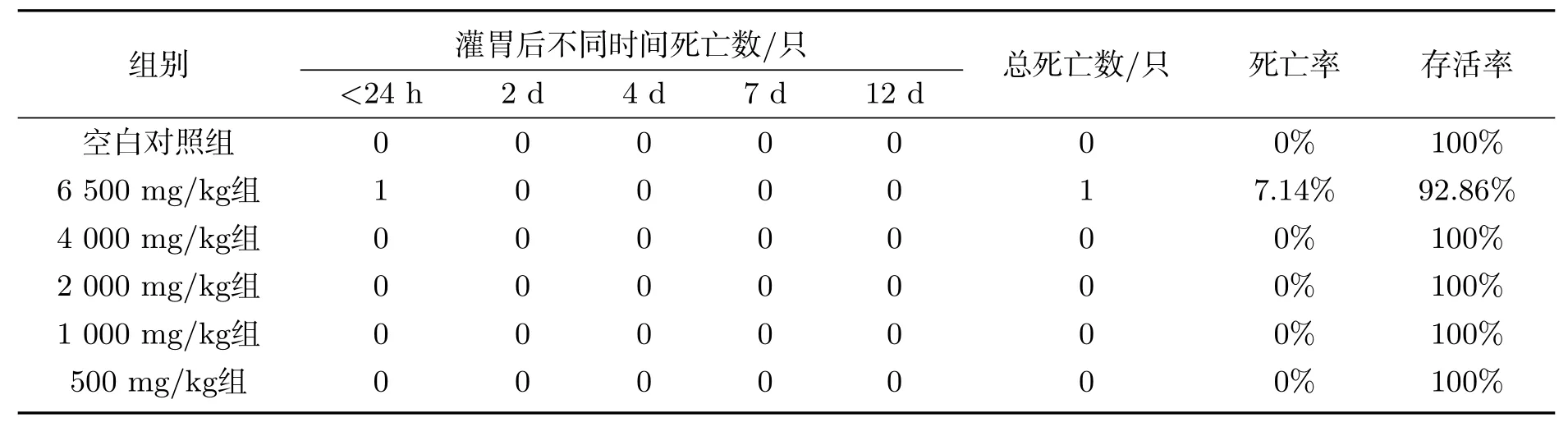
表2 大鼠单次灌胃给予GA后的存活率
2.1.2 GA对SD大鼠体重的影响
灌胃给予GA后,各组受试SD大鼠的体重与灌胃前相比无显著差异(P>0.05).体重统计见图2.
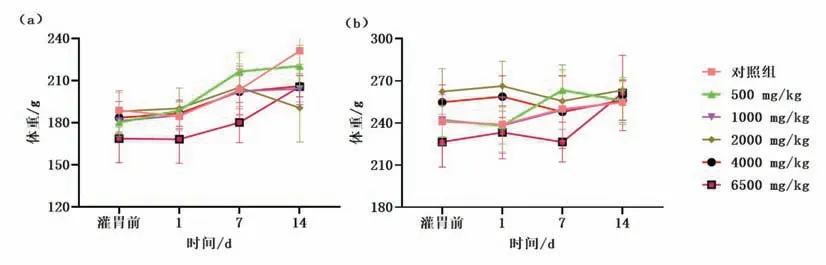
图2 大鼠灌胃给予GA后的体重情况
2.1.3 GA对SD大鼠血清中炎症因子的影响
为检测单次给药对大鼠免疫系统是否有影响,检测血清中IL-6和TNF-α的浓度(图3).IL-6各剂量组与对照组无显著差异(P>0.05),TNF-α各剂量组与对照组也无显著差异(P>0.05).
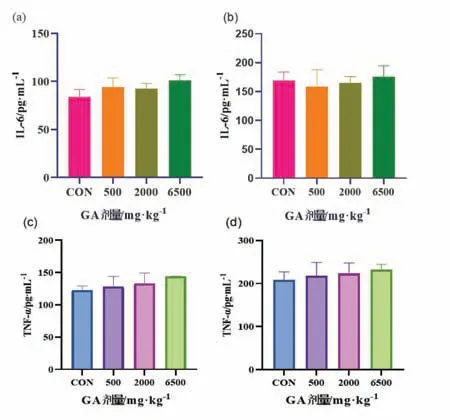
图3 GA单次给药对大鼠IL-6和TNF-α的影响
2.1.4 GA对SD大鼠脏器组织病理学影响
通过组织病理学进一步分析GA暴露后对大鼠主要脏器(包括肝脏、肾脏、睾丸和卵巢)的影响.图4(a)为GA大鼠单次灌胃给药后肝脏切片,与对照组相比各剂量组未见明显病变,组织结构正常;图4(b)为大鼠肾脏切片,与对照组相比未见明显病变,肾细胞排列整齐,未见大量空泡现象;图4(c)为大鼠睾丸切片,与对照组相比炎性细胞浸润情况较多;图4(d)为大鼠卵巢切片,与对照组相比无明显病变.
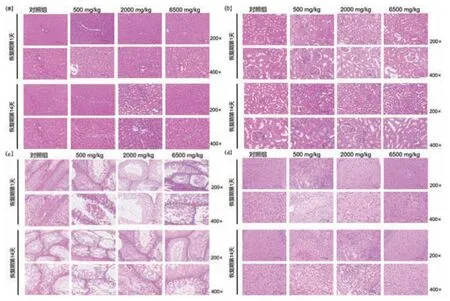
图4 GA单次暴露组织病理学影响
2.2 GA亚急性毒性评价
2.2.1 GA对SD大鼠体重的影响
给予GA后,GA组雌性大鼠的体重与灌胃前相比没有显著差异,雄性大鼠的体重有上升趋势,但无显著差异(P>0.05).体重统计见图5.
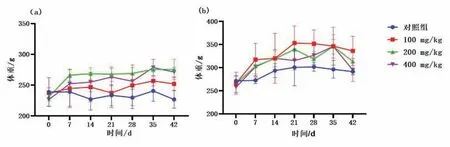
图5 大鼠给予GA后的体重情况
2.2.2 GA对大鼠炎症因子的影响
通过组织病理切片观察到部分脏器存在损伤,为在小分子水平验证其结果,对GA暴露的SD大鼠血清及部分组织进行了炎症因子(IL-6和TNF-α)含量检测.血清中炎症因子含量见图6,GA暴露雌雄性大鼠血清中炎症因子较对照组急剧增加,且呈剂量正相关性,随着剂量上升雌雄鼠血清中IL-6的含量增加(P<0.01).雌性大鼠TNF-α有上升趋势但无显著差异(P>0.5,图6(c)),雄性大鼠在中、高剂量与对照组相比有显著差异(P<0.5,图6(d)).
本次实验对主要脏器(肝脏、肾脏、卵巢、睾丸)组织中炎症因子含量进行了检测,结果见图7.在SD大鼠肝脏组织中,与对照组相比IL-6的含量没有显著差异(P>0.5),TNF-α的含量在400 mg/kg剂量组有显著上升,为对照组的2.9倍.在肾脏组织中,炎症因子含量在200、400 mg/kg剂量较对照组均显著上升(P<0.5),IL-6含量为对照组的1.7倍,TNF-α含量为对照组的2.4倍.在卵巢组织中,IL-6含量较对照组在100 mg/kg剂量组呈1倍差异(P<0.5),在200、400 mg/kg剂量组呈极显著上升(P<0.01),均为对照组的1.3倍.TNF-α含量在400 mg/kg剂量组呈显著差异(P<0.5),为对照组的1.5倍.在睾丸组织中,200、400 mg/kg剂量IL-6含量呈显著上升(P<0.5),TNF-α含量极显著上升(P<0.01),分别为对照组的1.4倍和1.6倍.
2.2.3 GA对SD大鼠脏器组织病理学影响
通过组织病理学进一步分析GA重复暴露后对大鼠主要脏器(包括肝脏、肾脏、睾丸和卵巢)的影响.图8(a)为大鼠重复暴露于GA后肝脏组织病理变化.100∼200 mg/kg剂量大鼠的肝脏组织与对照组相比无明显病理变化,肝脏组织结构正常;400 mg/kg剂量肝细胞间隙扩大,包内结构松散.图8(b)为大鼠重复暴露于GA后肾脏组织病理变化.对照组与处理组肾脏细胞排列整齐,未见大量空泡,但中、高剂量组与对照组相比肾脏细胞间隙出现轻微扩大.
图8(c)为大鼠重复暴露于GA后卵巢组织病理变化.与对照组相比低、中剂量组未见明显病变,高剂量组与对照组相比炎症细胞浸润较多.图8(d)为大鼠重复暴露于GA后睾丸组织病理变化.对照组与低剂量组睾丸曲细精管生精细胞丰富、排列整齐、层次清楚,可见成熟精子生成、结构正常;中剂量组曲细精管内生精上皮层次减少、稀疏,腔内仅见少量成熟精子生成;高剂量组大量生精细胞坏死溶解,生精上皮层稀疏,且曲细精管内未见精子生成.
2.3 GA风险评估
《中国居民膳食指南(2022)》[12]推荐的水果消耗量为200∼350 g/d.国外大多数具有推荐摄入量的国家建议每天摄入超过300 g新鲜水果,按照中华人民共和国国务院新闻办公室发布的《中国居民营养与慢性病状况报告(2020年)》[13],成人男性平均体重为69.9 kg、女性为59 kg,成人平均体重以63 kg计,按风险最大化原则将红枣和葡萄的每日水果消耗量以0.30 kg/d计.本课题组前期在田间实验中得到GA在红枣中的残留值为0.007 2∼0.130 1 mg/kg.本次风险评估中GA在红枣中残留量参考文献[14].急性毒性实验中观察到GA的NOAEL剂量为2 000 mg/kg;亚急性毒性实验中观察到的NOAEL为100 mg/kg.GA急性和慢性膳食风险评估结果见表3.
3 讨论
GA是一种高效的植物生长调节剂,在中国新疆红枣、葡萄中广泛应用,但其对人群可能带来的风险存在较大争议,为了探究GA对人体带来的危害,本文通过急性及亚急性毒性实验,建立了动物体内毒性模型,根据GA毒性效应,初步探究了GA可能损伤的靶器官,为GA毒性准确评价及其安全合理用药、制定GA残留相关标准提供依据.
急性毒性是食品安全性毒理学评价程序的第一阶段,通过经口一次性给予或24 h内多次给予受试物后,观测SD大鼠在短时间内产生的毒性反应[15].目前国内研究人员多针对GA急性毒性开展宏观研究,如通过最大耐受法研究GA急性毒性,发现其毒性比较低,毒性分级属于无毒级[6],但对可能损伤的靶器官不明确,缺乏对主要脏器的组织病理学观察.本文通过SD大鼠单次灌胃给予GA,对体内急性毒性进行评价,并观察到GA暴露后睾丸组织损伤.实验中未观察到致死剂量(LD100)和半数致死剂量(LD50),在SD大鼠急性毒性实验中,GA最高剂量为6 500 mg/kg,初步推测GA对SD大鼠的LD50>6 500 mg/kg,这与化学物质毒性数据库查询到的大鼠毒性分级以及商桑等[6]的研究结果一致,均属于无毒级.为了进一步研究GA对人群生长发育的影响[16],研究人员发现GA可使仔鼠的生长发育提前,雌性阴道开口时间及雄性小鼠的阴囊下降时间提前[17].本文急性毒性实验中,观察到6 500 mg/kg剂量组SD大鼠睾丸组织病理切片与对照组相比炎性细胞浸润情况较多,因此,GA高剂量急性暴露可能会对生殖系统产生一定影响.
如上所述,本文通过急性毒性实验初步观察了GA高剂量单次暴露后SD大鼠组织病理学切片,结果显示睾丸组织存在损伤,为进一步研究GA低剂量重复暴露后是否同样会对靶器官产生损伤,进行了亚急性毒性实验.目前,国内外亚急性毒性研究表明,0∼100 mg/kg剂量范围内GA对SD大鼠青春期没有影响[17];本文低剂量组在重复28天暴露GA后同样未观察到对SD大鼠青春期以及生长明显的影响,但在暴露剂量超过400 mg/kg时,SD大鼠卵巢炎症细胞浸润较多.200 mg/kg剂量组曲细精管内生精上皮层次减少、稀疏,腔内仅见少量成熟精子生成;400 mg/kg剂量组大量生精细胞坏死溶解,生精上皮层稀疏,且曲细精管内未见精子生成.
肝脏具有多种功能且代谢旺盛,对外源污染物反应灵敏,因此在毒理学评价中经常作为毒性效应观察靶器官和细胞毒性观测模型.有研究通过亚急性毒性实验证明农药对大鼠的肝毒性[18].GA重复暴露会引起肝脏毒性,GA肝脏切片检查显示充血、门静脉和中央静脉扩张以及血细胞积聚、炎症细胞浸润,除此之外损伤迹象还有肝细胞结构松动、肝细胞出现空泡化等[19].本文中100∼200 mg/kg剂量重复暴露后大鼠的肝脏组织与对照组相比无明显病理变化,肝脏组织结构正常,400 mg/kg剂量组肝细胞间隙扩大,包内结构松散,表现出明显的损伤.亚急性毒性实验中观察到GA的持续摄入导致肝脏、脾脏、肾脏的氧化损伤[20]、炎症和细胞坏死现象[21].除肝脏损伤外,本文还观察到了重复暴露于GA后肾脏组织病理变化,在暴露剂量超过200 mg/kg时肾脏细胞间隙出现轻微扩大,与上述研究结果具有一致性.
研究表明GA在果实生长发育过程中呈逐渐降低趋势[14],急性毒性最高剂量为GA暴露量的65∼130倍,亚急性毒性实验高剂量为暴露量的4∼8倍,本文参考张贤辉等[22]和顾梦影[23]研究计算急性和慢性膳食风险的评估方法,其中未观察到有害作用剂量(NOAEL)和最小观察到有害作用剂量(LOAEL)是物质暴露风险评估中重要的数据[24-25].本次风险暴露评估中GA累积风险商值小于100%,说明在急性暴露中130倍以内喷洒量的GA膳食中累积风险可被接受,GA在8倍以内重复28天暴露的膳食风险可被接受,但并不代表所有群体均可接受长期蓄积性风险.本次风险暴露评估中参考摄入群体为成年人,未考虑接受度较差的幼儿以及老弱群体,膳食风险商值考虑的是单向农药(添加剂)残留的影响,未估计混合叠加与其它药物使用的情况,所以引起的安全风险有待进一步研究.
综上所述,如何避免红枣、葡萄中农药残留带来的风险是一个复杂的问题,需要多方面的努力和配合.首先,最根本是从源头把好红枣、葡萄质量关,种植者要提高对农药危害的认识并在采摘前科学、合理、规范地使用农药.其次,有关部门作好红枣、葡萄质量的监管和监测,加强知识宣传及禁限用农药销售渠道的管理,完善相关法规和标准,研发高效且无毒的GA替代品;加工过程中严格把关红枣、葡萄的清洗、晾晒方式.最后,消费者在食用前对其进行彻底清洗、浸泡等可以有效减少残留的摄入.
4 结论
依据本实验结果,GA急性毒性属于低毒,单次高剂量暴露时损伤的靶器官是睾丸;GA重复暴露后主要毒性反应集中在肝脏、肾脏、卵巢、睾丸中,最大未观察到有害作用剂量为100 mg/kg.红枣、葡萄中GA急性和慢性风险商值均低于100%,说明红枣、葡萄中GA残留膳食摄入风险很低,造成的累积风险可以接受.
