长链非编码RNA-PVT1促进肾癌细胞的迁移和转移
2023-12-02严雪冰王成海
王 嫚, 周 洁, 严雪冰, 王成海, 4
(扬州大学附属医院, 1. 病理科, 3. 肿瘤科, 江苏 扬州, 225009;2. 江苏省沭阳县中医院 肾内科, 江苏 沭阳, 223600;4. 扬州大学医学院 病理教研室, 江苏 扬州, 225009)
肾细胞癌(RCC)是世界上最致命的泌尿系统恶性肿瘤之一, 发病率和致死率逐年上升[1-2]。RCC的主要病理类型是透明细胞肾细胞癌(ccRCC), 约占所有RCC病例的75%[3]; 由于复发率或转移率高、早期诊断困难和耐药性[4-5], ccRCC患者的预后很差。因此迫切需要了解ccRCC的生物学机制,这有助于发现ccRCC新的生物标志物和治疗靶点。近年来,长链非编码RNA(LncRNA)成为癌症和其他疾病的潜在生物标记物。LncRNA可作为致癌基因和肿瘤抑制剂,参与各种细胞信号通路[6]。在RCC中也检测到lncRNA表达异常,其可作为诊断标志物,还可在确定预后或监测治疗反应方面发挥重要作用[7-8]。研究[9]发现, Lnc-PVT1、Lnc-SLC16A1-AS1、Lnc-LINC00887和Lnc-LUCAT1在RCC中表达水平升高,但并没有阐述Lnc-PVT1的作用机制。本文探讨Lnc-PVT1(NCBI登录号NC_000008.11)在ccRCC组织中的表达情况、临床意义和发生机制,以期为ccRCC的临床治疗提供理论依据。
1 资料与方法
1.1 一般资料
选取2020年1月—2022年12月在扬州大学附属医院和沭阳县中医院接受肾癌手术切除的69例患者作为研究对象,年龄为42~65岁,中位年龄为54岁。纳入标准: ① 临床及病理资料无缺失者; ② 经病理确诊为透明细胞肾癌者; ③ 术前未接受放疗、化疗、免疫治疗等抗肿瘤治疗者; ④ 对本研究知情同意者。排除标准: ① 合并其他恶性肿瘤者; ② 合并有脑转移者; ③ 心、肝、肾功能不全者。收集69例配对的ccRCC组织和邻近正常肾组织以及相关临床病理资料。本实验经医院伦理与道德委员会批准。
1.2 质粒和细胞
Lnc-PVT1全长过表达质粒和si-Lnc-PVT1(序列1: CAGCGACAAGTTGAGACTTGTTCAA, 2: CACATCAAATCAATTCCCTGTTCTT)合成于南京金斯瑞生物科技有限公司。肾癌细胞株786-O、A498和正常肾小管上皮细胞HK2购于中国科学院上海生科院细胞库。肾癌细胞株在RPMI-1640培养基(Life Technologies, US)中培养, HK2在DMEM培养基(Life Technologies)中培养,并添加青霉素G(100 U/mL)、链霉素(100 mg/mL)和10%胎牛血清(FBS, Life Technologies)。所有细胞系均在37 ℃、含5% CO2的增湿空气中培养。通过Lipofectamine 2000细胞转染试剂盒按试剂说明书将Lnc-PVT1mimic(模拟物)和si-lnc-PVT1(抑制物)的质粒转染至肾癌细胞株(浓度为100 nmol/L)。基质金属蛋白酶-9(MMP9)抗体购自美国Abcam。
1.3 实时荧光定量聚合酶链反应(qRT-PCR)实验
首先通过Trizol法提取ccRCC组织总RNA, 检测RNA浓度,然后进行cDNA的反转录合成。反应体系: 总RNA 1 μg+mRQ Buffer(2×)5 μL+mRQ Enzyme 1.25 μL+无酶水补至10 μL, PCR仪扩增获得cDNA产物。qRT-PCR实验通过Premix Ex TaqTMⅡ试剂盒进行操作,反应体系: SYBR预混料Ex Taq Ⅱ 10 μL+ROX Reference Dye Ⅱ(50×) 0.4 μL+上游引物(10 μmol/L) 0.4 μL+下游引物(10 μmol/L) 0.4 μL+ CDNA模板1.6 μL+DEPC水7.2 μL, 合计20 μL。在Applied Biosystems 7500 R-T PCR system进行qRT-PCR实验: ① 预变性 94 ℃ 5 min。② PCR反应: 94 ℃ 30 s至55 ℃ 30 s至70 ℃ 30 s, 共40个循环, 94 ℃ 1 min至 55 ℃ 30 s至95 ℃ 30 s。各引物序列如下: Lnc-PVT1上游引物5′-TTCCAGTGGATTTCCTTGCGGA-3′, 下游引物TGGTCAGGCAAGGCTTCCAGAA;GAPDH上游引物5′-ACCTGGACCTGGACCTGGACT-3′, 下游引物5′-ACCTGGACCTGGACCTGGGAT-3′。 微小RNA-145 (miR-145)使用PrimeScript RT-PCR试剂盒进行实验,步骤按试剂说明书进行, miR-145上游为5′-ATTACACCTTGTCCTCACGGT-3′, 下游为5′-CGGATTGGTACTGGAGTTC-3′。
1.4 RNA原位分子杂交实验(RISH)
Lnc-PVT1探针和原位杂交试剂盒购自BOSTER生物公司,探针序列5′-GCCAAAGUGAG>UGGAUCACUUGAGGUCAGGAGUUCGAGACCAACCUGGCCAACAUGGUGA-3′。实验按试剂盒说明书进行: 将厚度4 μm切片用胃蛋白酶消化RNA核酸片段。先是预杂交,然后使用Lnc-PVT1 RNA探针进行杂交,然后H2O2封闭液后滴加抗地高辛, 1 h后滴加链霉亲和素-生物素复合物,最后滴加生物素化过氧化物酶。使用DAB将阳性物质染成棕黄色颗粒,用苏木素将胞核染成蓝色进行对比,封片后光镜观察。结果判定: 细胞中出现棕黄色物质为Lnc-PVT1阳性细胞; 光镜下随机选择5个高倍视野,计算阳性细胞与总细胞数的百分率。根据试剂说明书推荐,以不加探针的染色组织为空白对照。
1.5 蛋白免疫印迹实验(Western blot)
在Lnc-PVT1过表达或降低组(过表达或降低Lnc-PVT1)和Lnc-PVT1正常表达对照组(正常表达Lnc-PVT1)细胞中加入含1%苯甲基磺酰氟(PMSF)的RIPA液,冰上裂解30 min, 然后4 ℃、12 000 g离心15 min, 吸取上清、分装,以二喹啉甲酸(BCA)方法测定蛋白浓度。十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)采用10%分离胶、6%浓缩胶。将2×Loading Buffer添加到蛋白溶液中,在100 ℃下孵化5 min。每个上样孔中均分别加入30 μg蛋白样品,电泳使用70 V电压,观察染料到达分离胶时,调整电压为100 V继续电泳,观察溴酚蓝到达凝胶的下端时,终止电泳。把凝胶取出,裁剪合适大小的NC膜,放在转移缓冲液中浸泡备用。设置200 mA恒流,冰上转膜50 min。把NC膜置于5 %牛血清白蛋白内,于室温环境孵育2 h。将1∶1 000一抗溶液稀释后放入NC膜,放在4 ℃孵化12 h。最后将二抗工作液浸泡NC膜, 37 ℃结合2 h。按照显色后分析条带的灰度值计算蛋白表达水平。将GAPDH设置为内参。一抗为鼠源性单克隆(货号MMP9SAB1402274-100UG, Sigma-Aldrich公司); 二抗为通用性羊抗鼠HRP(货号C31430100, Invitrogen公司)。
1.6 Transwell迁移实验
在Transwell小室的上室(覆有直径8 mm膜)置入RPMI 1640培养液200 μL, 加入1×105个转染的肾癌细胞,设3个复孔。下室内加入10%胎牛血清RPMI 1640的培养液,以便吸引上室内的肿瘤细胞穿过覆膜。将小室置入下室, 37 ℃共孵育24 h后,用棉签去除小室上室腔里的细胞,甲醛固定40 min,再用0.1%结晶紫对小室上腔底部反面的细胞进行染色,计数迁移的肾癌细胞数目并拍照。
1.7 双荧光素酶报告实验
利用脂质体介导转染肾癌细胞,同时用miR-145基因转染相关癌细胞,观察荧光素酶的发光情况。双荧光素酶实验分组情况: 主要分为MMP9-WT(野生型)组和MMP9-MUT(突变型)组。根据试剂盒说明书,再转染后24 h检测双荧光活性。实验重复3次。实验主要步骤如下: 首先将样本和试剂盒放置于室温环境中。10 min后每孔加入100 μL萤火虫荧光素酶检测试剂,再加入20 μL样本,轻柔吹打混匀后读数,以细胞裂解液作为对照组; 然后每孔加入100 μL海肾荧光素酶检测试剂,使用酶标仪震荡混匀后读数; 数值计算: 以萤火虫荧光素酶作为内参,将海肾荧光素酶测定得到的数值除以萤火虫荧光素酶测定得到的数值。根据比值来检测不同样品间的目的报告基因激活程度。
1.8 统计学分析

2 结 果
2.1 Lnc-PVT1在ccRCC组织和细胞中的表达
运用qRT-PCR检测Lnc-PVT1在ccRCC组织和细胞中的表达。如图1A所示,在69例ccRCC组织中, Lnc-PVT1的表达水平高于癌旁正常肾组织,差异有统计学意义(P<0.05)。与正常肾小管上皮细胞HK2细胞相比(图1B), Lnc-PVT1在肾癌细胞株786-O、A498中表达水平升高,差异有统计学意义(P<0.05)。以上结果表明Lnc-PVT1在肾癌中发挥致癌基因的作用。

A: ccRCC组织和癌旁组织中Lnc-PVT1的表达水平(与癌旁正常组织比较, ∗P<0.05); B: Lnc-PVT1在不同细胞株中的表达水平(与HK2细胞株比较, ∗P<0.05)。
2.2 RISH显示Lnc-PVT1在ccRCC中的阳性表达
在RNA水平上,运用RNA原位杂交实验再次检测Lnc-PVT1的表达水平。实验结果表明,在ccRCC组织中Lnc-PVT1 RNA主要定位于细胞浆中,为棕黄色阳性染色(图2); 在癌旁正常肾组织中很少有棕黄色染色,为阴性表达。ccRCC组织中Lnc-PVT1阳性率为73.91%(51/69), 高于癌旁正常肾组织的14.49% (10/69), 差异有统计学意义(χ2=4.128,P<0.05)。

A、C: ccRCC组织中Lnc-PVT1呈阳性表达,细胞中出现棕黄色颗粒; B、D: 癌旁正常肾组织中主要呈阴性表达。A、B: 高倍放大,倍数为400倍; C、D: 中倍放大,倍数为200倍。
2.3 Lnc-PVT1的阳性表达及其临床病理意义
在69例ccRCC组织中,根据阳性例数,将病例分为Lnc-PVT1阳性表达组(n=51)和Lnc-PVT1阴性表达组(n=18)。Lnc-PVT1的阳性表达与病理分级和淋巴结转移均密切相关(P<0.05), 但与患者年龄、性别、肿瘤大小和TNM分期均无相关性(P>0.05)。见表1。
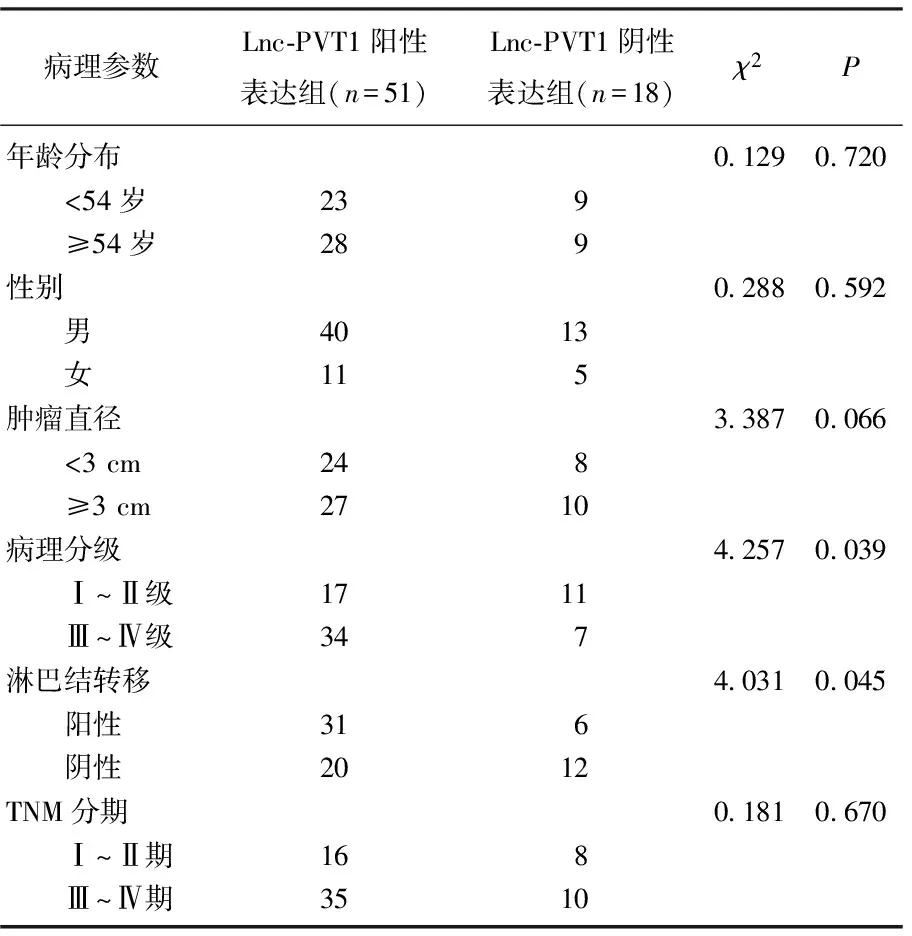
表1 69例ccRCC组织中Lnc-PVT1的阳性表达及其临床病理意义
2.4 Lnc-PVT1促进ccRCC细胞迁移
在上述临床病理意义中, Lnc-PVT1与ccRCC患者的淋巴结转移密切相关,因此进一步通过Transwell迁移实验加以验证。实验结果如图3所示,在786-O细胞中,敲低Lnc-PVT1表达细胞的迁移数目为(23.64±3.82)个,少于对照组的(52.25±4.42)个; 而过表达Lnc-PVT1细胞的迁移数目为(86.71±7.12)个,多于对照组的(50.13±7.04)个,差异有统计学意义(P<0.05)。在A498细胞中,与对照组相比[(51.4±5.28)个],敲低Lnc-PVT1表达后的ccRCC细胞的迁移数目减少[(27.86±3.42)个]; 而过表达Lnc-PVT1细胞的迁移数目[(82.6±7.98)个]多于对照组[(53.65±6.12)个],差异有统计学意义(P<0.05)。

A: 迁移实验图; B: 迁移实验柱形图。两者比较, ∗P<0.05。
2.5 Lnc-PVT1调控miR-145表达及其相互关系
通过生物信息学(http://www.mircode.org/download.php/miRcode Highly conserved microRNA families)预测Lnc-PVT1的下游miRNA, 结合位点基因包括miR-145(miR-145-5p)、miR-194、miR-214、miR-23、miR-29、miR-383 和miR-455。然后根据qRT-PCR实验结果发现,过表达Lnc-PVT1后, miR-145表达水平下降(图4A); 降低Lnc-PVT1表达后, miR-145表达水平升高(图4B), 差异有统计学意义(P<0.05)。其余miRNAs均没有出现显著变化(P>0.05)。说明Lnc-PVT1仅能调控miR-145的表达。
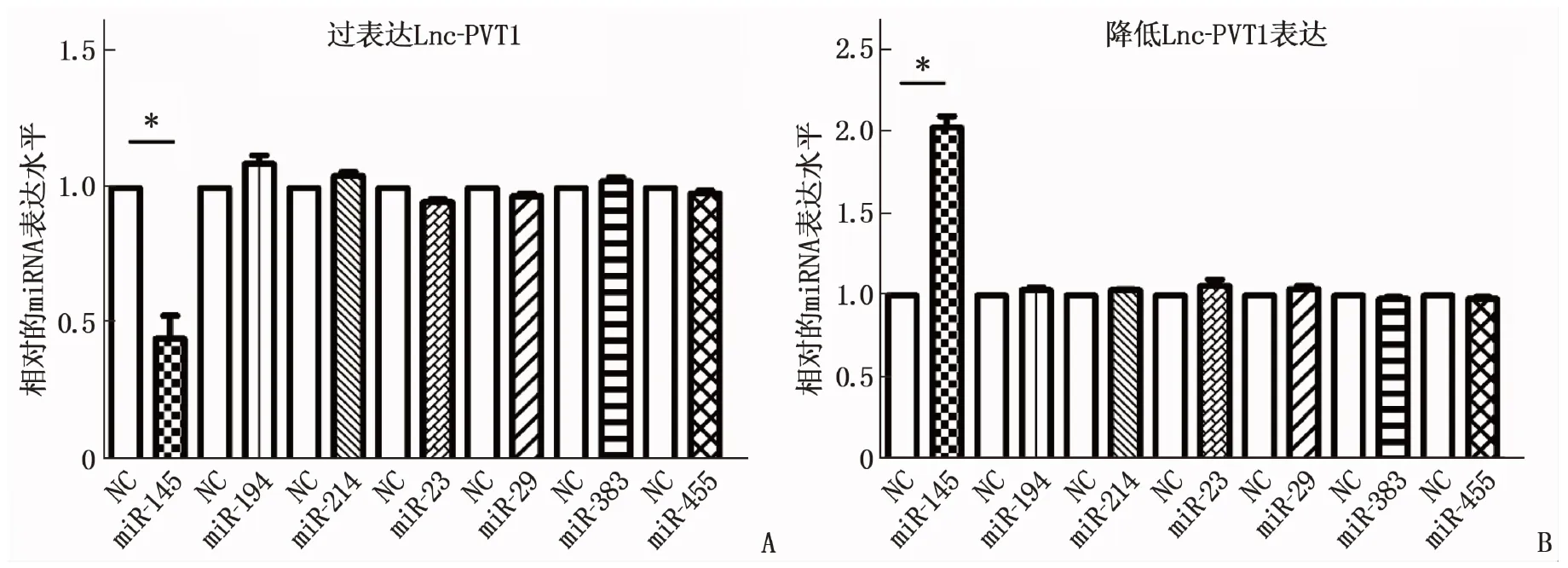
A: 过表达Lnc-PVT1后miR-145的表达水平下降; B: 降低Lnc-PVT1表达后miR-145的表达水平升高,与NC(对照组)相比, ∗P<0.05。
根据qRT-PCR实验结果, ccRCC组织(n=69)中miR-145表达水平低于癌旁正常组织,差异有统计学意义(P<0.05); Pearson分析显示, Lnc-PVT1与miR-145的表达呈负相关(r=-0.031 5,P<0.05)。见图5。
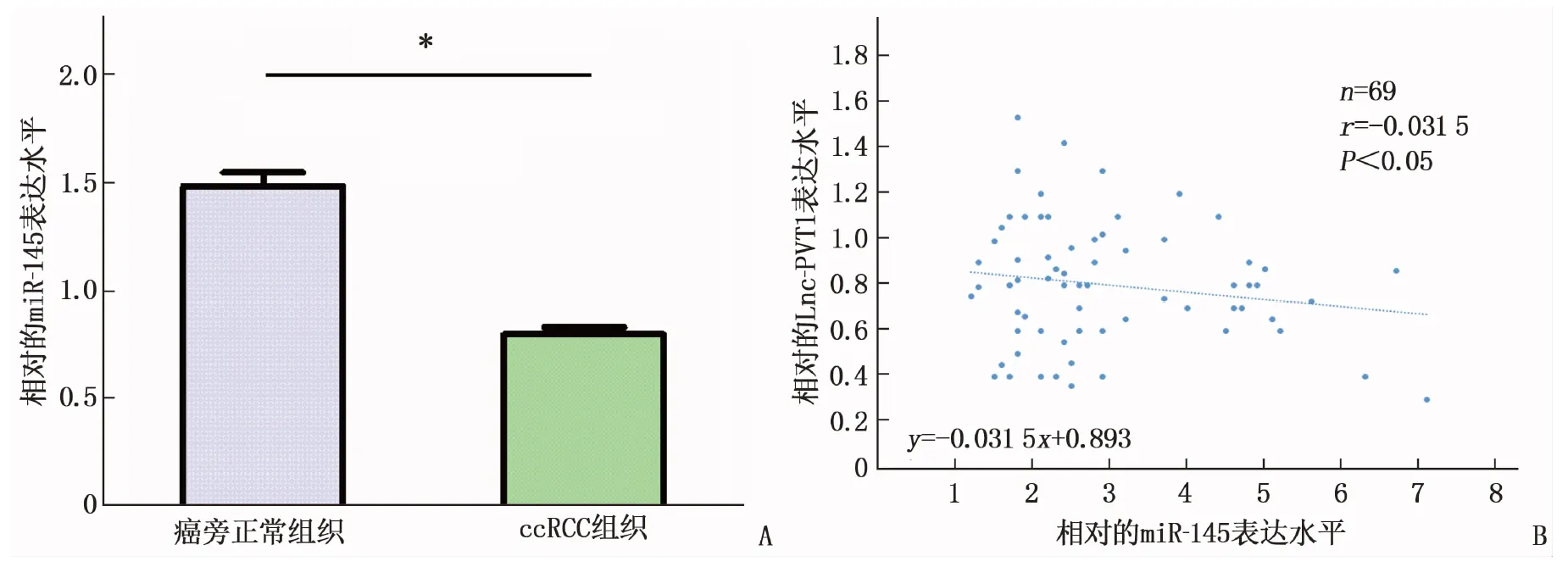
A: qRT-PCR显示在69例ccRCC组织中miR-145表达水平下降(与癌旁正常组织比较, ∗P<0.05); B: Pearson相关性分析得出Lnc-PVT1与miR-145呈负相关。
2.6 MMP9是miR-145的直接靶目标
通过TargetScan和miRNAbase信息分析miR-1145靶向的下游编码RNA, 得出MMP9 3′UTR中有miR-145互补的基因结合位点(图6A、6B)。通过双荧光素酶报告基因实验(图6C)得出在MMP9 3′UTR野生型转染组中,与对照组相比,高表达的miR-145可抑制荧光素酶的荧光活性,差异有统计学意义(P<0.05); 在突变组miR-145中,因未能结合MMP9 3′UTR, 就不能抑制荧光素酶的活性,差异无统计学意义(P>0.05)。因此miR-145与MMP9为特异性结合。MMP9 3′UTR是miR-145的直接结合位点, miR-145通过与MMP9的3′UTR结合对MMP9蛋白质的翻译起抑制作用。

A: 生物信息学预测MMP9 3′UTR(86-80位)与miR-145种子序列(3-9位)有互补的结合位点; B: PGL4质粒与野生型(WT)或突变型(MUT) MMP9 3′UTR的示意图; C: 在MMP9 3′UTR 野生型转染组,高表达miR-145可抑制荧光素酶活性,而在MMP9 3′UTR突变组中, miR-145因没有结合位点,故不能抑制荧光素酶活性,与NC(对照组)比较, ∗P<0.05。
2.7 Lnc-PVT1对肾癌细胞中miR-145/MMP9信号通路和迁移的影响
改变Lnc-PVT1和miR-145表达后,观察MMP9蛋白的变化及对迁移能力的影响。实验分为7个组,即对照组(NC)、过表达Lnc-PVT1组、敲低Lnc-PVT1表达组、过表达Lnc-PVT1组+过表达miR-145组、敲低Lnc-PVT1表达组+敲低miR-145表达组、过表达 Lnc-PVT1组+敲低miR-145表达组和敲低Lnc-PVT1表达组+过表达miR-145组。Lnc-PVT1能抑制miR-145表达,促进MMP9蛋白表达,在功能上也能促进肾癌细胞的迁移能力。见图7、表2。

表2 回复实验中迁移数目、miR-145表达和MMP-9蛋白水平变化

A: 过表达miR-145可抑制Lnc-PVT1对肾癌细胞迁移的促进作用,降低miR-145表达后可进一步激活癌细胞的迁移能力; B: 各组中miR-145相对表达量; C: Western blot检测各组中MMP-9蛋白水平。1: 过表达Lnc-PVT1组; 2: 敲低Lnc-PVT1表达组; 3: 过表达Lnc-PVT1组+过表达miR-145组; 4: 敲低Lnc-PVT1表达组+敲低miR-145表达组; 5: 过表达 Lnc-PVT1组+敲低miR-145表达组; 6: 敲低Lnc-PVT1表达组+过表达miR-145组。与NC(对照组)比较, ∗P<0.05。
3 讨 论
ccRCC是最为常见的泌尿系统恶性肿瘤,肾切除术后的转移和复发率很高,转移性ccRCC患者的5年生存率为12%[1]。尽管靶向治疗和免疫疗法获得了较大进步,但转移性ccRCC患者的生存率并没有提高[10]。LncRNA被认为是调节肿瘤转移相关机制的新因素[11]。通过研究LncRNA在肾癌发生发展中的作用,寻找新的生物标志物,对于预测进展、转移风险和治疗肾癌都有积极意义[12]。
LncRNA在ccRCC的发生发展中起着至关重要的作用,一些致癌性LncRNA在ccRCC中表达水平上调,而一些抑癌性LncRNA则表达水平下调。例如,在促进肿瘤进展方面, LncRNA DARS-AS1可通过螯合miR-194上调DARS的水平,从而导致ccRCC的恶性进展[13]。LINC00511通过调节miR-625/Cyclin D1信号传导,加速ccRCC细胞增殖并抑制细胞周期停滞在G0~G1期[14]。LncRNA FTX在ccRCC中异常上调,通过吸收miR-4429来诱导UBE2C的表达,从而促进ccRCC的生存、迁移和侵袭[15]。在抑制肿瘤进展方面, LncRNA LET在ccRCC组织和细胞中下调,通过直接与miR-373-3p结合以降低dickkopf-1和TIMP2的水平,介导肿瘤抑制[16]。在ccRCC组织中, LncRNA TCL6水平降低,通过与miR-155相互作用影响Src/Akt途径抑制ccRCC转移[17]。LncRNA NBAT1表达水平显著降低,并通过NBAT1/miR-346/GSK-3β轴抑制ccRCC细胞增殖和转移[18]。
本研究利用人类LncRNA表达谱测序分析得到ccRCC中差异表达的LncRNA[9], 并通过qRT-PCR实验和RISH实验验证了Lnc-PVT1在ccRCC组织和细胞中表达升高(阳性)。故选择Lnc-PVT1作为研究对象。本研究分析Lnc-PVT1表达与临床病理资料的关系,发现Lnc-PVT1表达与肿瘤分化(分级)、淋巴结转移密切相关,说明Lnc-PVT1表达越高, ccRCC级别越低,恶性程度越高,肿瘤细胞越容易通过淋巴结转移,这也反映了患者的预后越差。
本研究进一步通过生物信息学和双荧光素酶报告实验证实, miR-145是Lnc-PVT1的下游靶基因。qRT-PCR实验表明,在ccRCC中miR-145表达水平下调,在RNA水平上Lnc-PVT1高表达和miR-145低表达为负相关; 改变Lnc-PVT1的表达水平, miR-145随之发生改变,说明Lnc-PVT1以直接或间接的方式调控miR-145的表达,至于Lnc-PVT1如何调控miR-145的机理本研究没有深入探讨,是否和其他的LncRNA发挥对microRNA海绵作用有待于将来进一步证实。miR-145一般在恶性肿瘤组织中表达水平下调,发挥肿瘤抑制基因的作用[19-20], 本研究结果也同意上述观点,即在肾癌中发挥抑癌作用。
恶性肿瘤细胞在迁移和转移的过程中能合成大量的细胞外基质降解蛋白酶,其主要是基质金属蛋白酶(MMP), 使得邻近的基质成分裂解,然后肿瘤细胞逐步迁移和转移[21-22]。MMP9是MMP常见的亚型之一,在肿瘤组织中表达水平升高[23], 能降解细胞外基质,促进肿瘤细胞的侵袭迁移和转移[22-24]。本研究发现, Lnc-PVT1抑制miR-145表达后,解除了miR-145对MMP9的抑制作用,从而增加了MMP9蛋白的含量,使得肿瘤细胞外基质得到降解,从而导致肾癌细胞通过增大的基质间隙,邻近入侵并向远处转移,这一结果也说明MMP9会被不同的上游信号分子激活,从而促进癌细胞迁移和转移, MMP9参与了迁移和转移过程,与文献[22-24]报道相一致。
综上所述, Lnc-PVT1在ccRCC组织和细胞株中表达水平升高, Lnc-PVT1通过下调miR-145表达后增加了MMP9的表达水平,从而促进肾癌细胞的迁移和转移,这为研究ccRCC迁移和转移机制提供了一条新的信号通路,即Lnc-PVT1/miR-145/MMP9通路。本研究为治疗转移性肾细胞癌提供了可能的分子靶点和依据。但本研究仍存在不足之处,比如没有探讨Lnc-PVT1是否影响肾癌细胞周期和细胞凋亡,对于Lnc-PVT1如何调控miR-145未进行探究。
