婴儿猝死综合征与婴儿感染性猝死共同相关基因的筛选及其调控网络的生物信息学分析
2023-12-01孙语新龚晓娟郝秀丽田雨馨陈艺铭张宝阎春霞
孙语新,龚晓娟,郝秀丽,田雨馨,陈艺铭,张宝,阎春霞
1.西安交通大学医学部法医学院,陕西 西安 710061;2.国家卫生健康委员会法医学重点实验室 西安交通大学,陕西 西安 710061;3.中国西部科技创新港 西安交通大学生物证据研究院,陕西 西安 712000
婴儿猝死综合征(sudden infant death syndrome,SIDS)是指小于1 岁的婴儿突发的、意外的在睡眠中发生的死亡,通过尸体检验、毒物分析、现场勘验以及对死亡环境、临床病史的详细调查,仍无法解释其原因[1]。约90%的SIDS 发生在6 月龄及以下的婴儿[2],在2~4 月龄时发生率最高。在发达国家,SIDS 的发生率约为0.5‰~2.5‰[3],在我国SIDS 约占婴儿总死亡率的11.9%[4]。有研究[5-8]显示,心律失常、脑干的神经化学异常、感染等可能参与SIDS 的发生。但迄今为止,SIDS 的致病机制仍不明确,是目前法医鉴定实践面临的难点问题之一。
三重风险模型是SIDS的主要病因模型,该模型提出,SIDS由3个因素共同导致,即脆弱的婴儿进入关键发育期并受外源性应激因素影响容易发生猝死[9]。研究[5,10-12]表明,遗传因素是导致婴儿脆弱性的内在因素,包括导致长QT 间期综合征(long QT syndrome,LQTS)的基因突变、白细胞介素-10(interleukin-10,IL-10)的基因多态性。而在环境危险因素方面,婴儿感染与SIDS的关系也被广泛关注。SIDS的年龄分布与母源抗体水平在新生儿出生后逐渐下降有关联[13]。有调查[13-14]发现,很多SIDS病例死亡前有感染现象,尸体检验时微生物检测呈阳性,提示感染和炎症反应可能对SIDS产生影响,但仍未发现与SIDS相关的特异性微生物。细菌毒素假说认为,在母源抗体降低、自身免疫系统未发育成熟之前,婴儿上呼吸道内的微生物及其所产生的毒素可能会导致炎症因子风暴,从而引起中毒性休克或败血性休克导致死亡[15]。
婴儿感染性猝死(infectious sudden death in infancy,ISDI)与SIDS 均属于婴儿人群中突然的、意外的猝死,但是ISDI 直接死因明确,为病原体感染所致,而SIDS 直接死因不明确。为了探究SIDS 与ISDI是否存在共同的基因表达调控机制,寻找SIDS 发生的免疫炎症机制和精准诊断的分子标记,以便在医疗纠纷、家庭暴力、杀婴、虐待婴幼儿等案件中精准鉴别SIDS 与ISDI,本研究通过生物信息学分析,对美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)公共数据平台GSE70422 和GSE136992 数据集中的mRNA 表达数据进行联合分析,筛选SIDS 和ISDI 死者不同组织样本中共同的差异表达mRNA,利用基因本体论(gene ontology,GO)和京都基因和基因组数据库(Kyoto Encyclopedia of Genes and Genomes,KEGG)对共同的差异表达mRNA进行富集分析,并确定蛋白质-蛋白质相互作用(proteinprotein interaction,PPI)网络中的hub 基因。
1 材料与方法
1.1 数据来源
从NCBI 的GEO 数据库(https://www.ncbi.nlm.nih.gov/geo/)中下载mRNA数据集GSE70422和GSE136992。GSE70422 数据集包括15 例SIDS 和15 例对照(意外事故、分娩并发症等)死者的脑、心脏和肝组织,其中SIDS 和对照死者均经过系统尸体解剖明确死因,年龄相匹配。使用全基因组基因表达芯片DASL HT(美国Illumina 公司)测定mRNA 表达。GSE136992 数据集包括14 例ISDI 和14 例对照(非急性感染性死亡)死者的脑、心脏和肝组织,其中ISDI 病例在死亡前没有严重的器质性疾病史;该数据集中ISDI 和对照死者均经过系统尸体解剖明确死因,年龄相匹配。使用全基因组基因表达芯片DASL HT 测定mRNA 表达。两个数据集均已使用R 4.1.0 软件Bioconductor 包进行背景校正和分位数标准化处理,且两个数据集的数据分析均表明种族和年龄对基因的差异表达没有影响[16-17],样本详细信息见表1。

表1 GSE70422 和GSE136992 数据集的样本统计Tab.1 Statistics of the samples in GSE70422 and GSE136992 database (例)
1.2 差异基因的分析
对GSE70422 和GSE136992 数据集进行数据处理。使用R 4.1.0 软件将GPL14951 平台探针ID 转化为基因符号,对同一个基因的多个探针取表达量均值最高的探针。对数据进行log2转换,检查并删除缺失值过多的基因和样本。将数据按照脑、心脏、肝组织分成3 组,分别对不同组织的基因表达量用R 软件limma 包进行差异表达分析[18],筛选出3 个组织的差异基因,筛选条件:差异倍数(fold change,FC)取以2为底的对数(log2FC)的绝对值大于1、P值小于0.05。最后使用R 软件ggplot2 包绘制火山图。
1.3 SIDS 和ISDI 数据集共同差异基因的筛选
对于同一个组织,将SIDS 差异基因(GSE70422数据集)与ISDI 差异基因(GSE136992 数据集)取交集,将P的阈值设置为0.01,获得每个组织的共同差异基因,按差异基因来源组织、在SIDS 组的P值大小进行排序。
1.4 GO 和KEGG 富集分析
GO 数据库将基因功能分成生物过程(biological process)、分子功能(molecular function)和细胞组分(cellular component)3 个部分。为了解析共同差异基因的功能和信号通路,利用R 软件clusterProfiler、org.Hs.eg.db 和ggplot2 包以及enrichgo 和enrichKEGG 函数对共同差异基因进行GO 和KEGG 富集分析[19],并绘制条形图与表格。
1.5 PPI 网络构建
STRING(https://www.string-db.org/)是分析已知和预测蛋白质相互作用的数据库。对于同一组织,将SIDS 和ISDI 组共同差异基因导入STRING 数据库[20],以互作评分大于0.75 构建PPI 网络。使用Cytoscape 3.8.2 软件(https://cytoscape.org/)中cytoHubba 插件的Betweenness、Closeness、Degree、EPC、MNC 5 种拓扑分析算法计算共同差异基因的得分,并取交集。
2 结果
2.1 差异基因的分析结果
数据集中没有检查到缺失值过多的基因和样本。与对照病例相比,SIDS 病例的脑组织中有200 个差异基因,心脏组织中有1 058 个差异基因,肝组织中有597个差异基因;ISDI病例的脑组织中有339个差异基因,心脏组织中有798 个差异基因,肝组织中有469 个差异基因。SIDS 病例和ISDI 病例不同组织中差异基因的火山图见图1,上调和下调情况见表2。

图1 SIDS 和ISDI病例脑、心脏和肝组织中差异基因的火山图Fig.1 Volcano map of differentially expressed genes in SIDS and ISDI samples of brain,heart and liver tissue
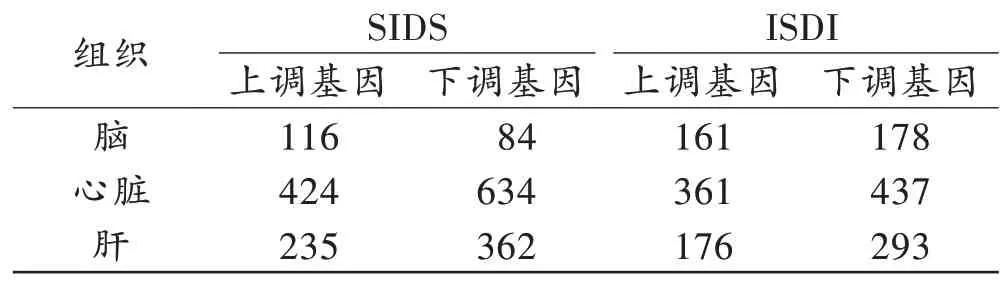
表2 SIDS 和ISDI病例不同组织中差异基因的数量统计Tab.2 Statistics of the differentially expressed genes in SIDS and ISDI in different tissues(个)
2.2 SIDS 和ISDI 病例的共同差异基因
通过重叠分析,SIDS 和ISDI 病例3 个组织中共有207 个共同差异基因,其中脑组织中22 个、心脏组织中126 个、肝组织中59 个。在207 个共同差异基因中进一步选取P值均小于0.01 的共同差异基因,得到19 个显著差异表达的基因(表3)。其中星形肌动蛋白1(astrotactin 1,ASTN1)在SIDS 和ISDI 病例中差异表达的P值均低于0.001。

表3 SIDS 和ISDI病例中的共同差异基因Tab.3 The common differentially expressed genes in SIDS and ISDI
2.3 PPI网络构建
为了探究SIDS 与ISDI 发生过程是否存在相同的机制,对得到的207 个共同差异基因进行PPI 网络构建。结果显示,脑组织的共同差异基因中没有显著的交互关系;心脏组织的共同差异基因中共有109 个节点和14 条连线(图2 中仅显示有交互关系的节点);肝组织的共同差异基因中共有54 个节点和2 条连线,交互关系并不显著。
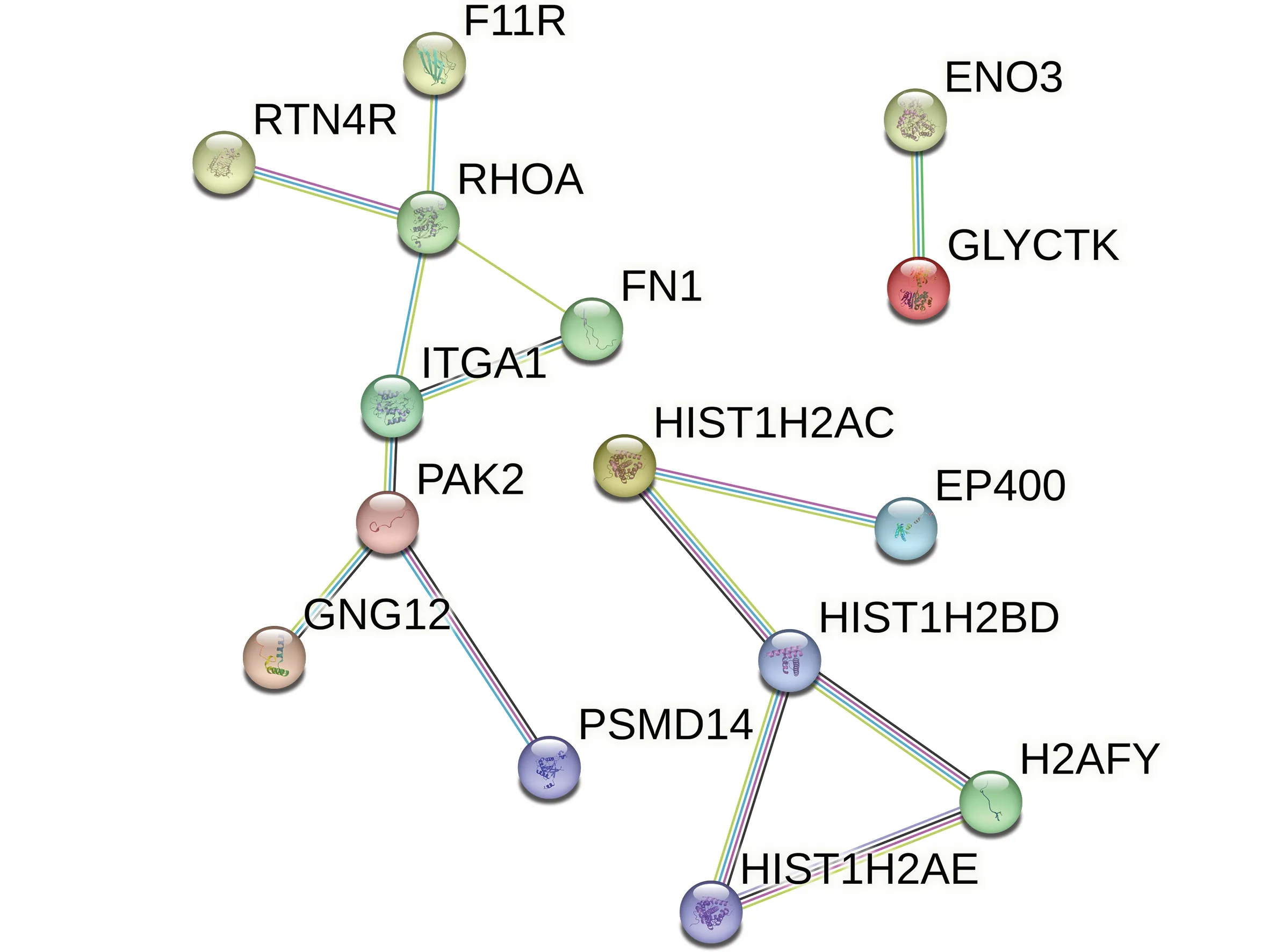
图2 心脏组织中共同差异基因的PPI网络图Fig.2 PPI network of common differentially expressed genes in the heart tissue
此外,由于心脏组织中的共同差异基因在PPI 网络中相互作用显著,本研究采取5 种拓扑算法分析这些共同差异基因的PPI 网络,计算出得分排名前5 位的hub 基因(表4)。将5 种算法的结果取交集后获得同时参与SIDS 和ISDI 的3 个关键基因,即RHOA、整合素亚单 位α1(integrin subunit alpha 1,ITGA1)和H2B 簇状组蛋白5(H2B clustered histone 5,H2BC5)。
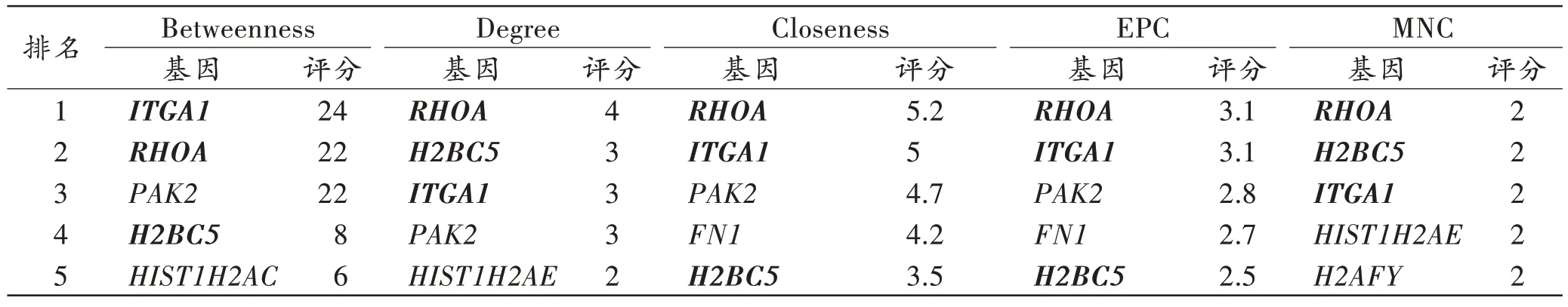
表4 5 种拓扑分析算法计算得到的排名前5 位的hub 基因Tab.4 Top 5 hub genes by five topology analysis algorithms
2.4 GO 和KEGG 富集分析
对上述SIDS 和ISDI 病例的207 个共同差异基因进行GO 和KEGG 富集分析。
GO 分析结果(图3)显示:在心脏组织中,生物过程主要富集在对霉酚酸的反应和后肾发育,共同差异基因p21 活化激酶2(p21 activated kinase 2,PAK2)、纤维连接蛋白1(fibronectin 1,FN1)和Ras同源基因家族成员A(ras homolog family member A,RHOA)主要参与轴突发生的调节;细胞组分主要富集在顶端连接复合体和核周质;分子功能主要富集在蛋白酪氨酸激酶激活剂活性中。在肝组织中,细胞组分主要富集在次级颗粒与三级颗粒;分子功能主要富集在激酶调节活性。在脑组织中无显著富集结果。

图3 SIDS 和ISDI病例心脏组织和肝组织中共同差异基因的GO 富集分析Fig.3 GO enrichment analysis of differentially expressed genes of heart and liver tissue both in SIDS and ISDI groups
KEGG 结果显示:在心脏组织中,通路主要涉及肌动蛋白细胞骨架的调节(P=9.5×10-5)和黏着斑(P=4.7×10-4)。在肝组织和脑组织中无显著富集结果。
3 讨论
在SIDS 发生机制不明晰、感染与SIDS 关系密切的背景下,探究免疫功能相关蛋白在SIDS 致病过程中的作用至关重要。越来越多的证据[21-23]表明,炎症和免疫影响心肌细胞的电生理特性,可能参与调节先天性LQTS的临床表型,也是获得性LQTS的潜在病因。此外,有研究[24]发现,免疫调节基因多态性导致细胞因子循环水平上调或下调,可能会破坏正常和过渡细胞功能与免疫反应之间的平衡,从而导致婴儿容易受到细胞因子风暴的影响。据报道,IL-10基因启动子多态性与SIDS 的发生显著相关[25],SIDS 脑脊液中IL-6水平与死于脑膜炎和败血症的婴儿脑脊液中高水平的IL-6(大于100 pg/mL)相当[26],在SIDS 中发现炎症相关基因的显著差异表达[16]。以上研究提示,免疫相关基因的表达变化合并感染,可能会诱发SIDS。
本研究结果表明,心脏组织中ASTN1、H2A簇状组蛋白6(H2A clustered histone 6,H2AC6)和神经软骨素(neurochondrin,NCDN)基因表达在SIDS 和ISDI 病例均显著下调。肝组织中,Krüppel样因子4(Krüppellike factor 4,KLF4)基因表达在SIDS 和ISDI 病例均显著下调。ASTN1 是一种神经细胞黏附分子,在神经母细胞的迁移中发挥作用[27]。神经发育的关键期与SIDS 发生高峰期时间重合,提示神经发育异常可能参与SIDS 的发生。同时,在非中枢神经系统疾病的患者中也发现有ASTN1基因突变,研究显示,ASTN1降低了肝癌细胞的迁移和侵袭能力,其表达与B 细胞、巨噬细胞和中性粒细胞在原发性肝癌中的浸润水平呈负相关[28],且影响小细胞肺癌的进程[29]。这些研究提示ASTN1 不仅在中枢神经发育过程中发挥重要作用,还与细胞增殖、免疫防御相关。本研究发现,ASTN1基因表达量在SIDS 和ISDI 病例的心脏组织中显著下调(P<0.001),而在肝和脑组织中表达差异均无统计学意义,提示ASTN1 在心脏中的功能值得进一步研究。H2AC6 是真核细胞中负责核小体结构的4 个核心组蛋白之一,研究[30]发现,H2AC6表达与冠心病相关,也与空腹血糖、收缩压、舒张压等6 个心血管代谢特征相关[31]。NCDN 是一种胞质蛋白,在神经生长、谷氨酸受体信号转导和突触可塑性中发挥重要作用[32]。NCDN会在缺血性脑卒中患者的血液样本中差异表达[33],其变异可引发癫痫[26]。此外,NCDN 还与自身免疫相关联,NCDN 通过限制中性粒细胞对细菌感染的清除作用抑制小鼠对肺炎球菌感染的先天免疫[34];NCDN 被鉴定为自身免疫性小脑变性中的神经元靶抗原[35],其抗体的产生与自身免疫性小脑性共济失调相关[36]。KLF4 是一种含锌指的转录因子,调节多种细胞过程,如细胞生长、增殖和分化。多项研究表明,KLF4 在调节炎症的过程中发挥作用[37],被认为是细胞抗病毒反应的负调节因子[38],并调控细胞因子IL-6[39]、IL-1β 和IL-10[40-41]的表达。此外,KLF4 还通过结合蛋白在多种血管疾病中产生影响[42]。
其余共有的差异表达基因与SIDS 或ISDI 的关联还不明晰。共同差异基因集中在心脏组织,提示心脏功能基因表达失调是引起猝死的重要机制。在法医学实践中,发病1 h 内死亡者多为心脏性猝死,一项对490 例1~35 岁心脏性猝死者的研究[43]发现,心脏性猝死最常见的原因是冠状动脉疾病(占24%)和遗传性心肌病(占16%)。而免疫功能发育不完全可能是SIDS的深层原因,最终关联到心脏,表现出心功能的失常。
KEGG 富集分析结果表明,在SIDS 和ISDI 病例心脏组织中,共同差异基因参与的通路主要涉及肌动蛋白细胞骨架的调节和黏着斑。肌动蛋白细胞骨架影响细胞的迁移、收缩和吞噬作用[44]。黏着斑是细胞的定位点,细胞黏附对免疫细胞外渗、迁移及炎症等防御反应至关重要。GO 结果显示,在心脏组织中,生物过程主要富集在对霉酚酸的反应和后肾发育通路中。霉酚酸是一种应用广泛的免疫抑制剂,在临床上具有抗免疫排斥反应、抗肿瘤与抗病毒的应用价值,可选择性地阻断淋巴细胞的增殖,抑制抗原呈递细胞的活性,从而抑制B 淋巴细胞向记忆细胞与浆细胞转化,并且降低细胞因子分泌[45]。肝组织中,细胞组分富集在次级颗粒和三级颗粒中,两者主要存在于中性粒细胞的分泌颗粒[46]。综上,共同差异基因富集在免疫与炎症反应相关的通路中,表明SIDS 与ISDI 病例在免疫相关基因表达缺陷方面存在共同之处。
本研究结果表明,心脏组织中共有3 个hub 基因(RHOA、ITGA1、H2BC5)参与SIDS 与ISDI。RHOA属于小GTP 酶,是Ras 同源家族成员;RHOA 蛋白能促进肌动蛋白细胞骨架的重组并调节细胞的形状、附着和运动,通过调控微丝重组参与细胞增殖、迁移和凋亡等过程,在信号转导级联中起分子开关的作用[47]。RHOA 所在的信号通路与充血性心力衰竭、动脉粥样硬化和急性缺血性脑卒中等心血管疾病相关[48]。RHOA 还是调节免疫细胞分化和功能的关键因子[49]。ITGA1 作为整合素的组成部分,通过控制细胞与细胞外基质的黏附影响发育、免疫、炎症等调节[50]。多项研究[51-52]表明,ITGA1 与自身免疫性疾病、动脉粥样硬化和肿瘤的发展有关。H2BC5 是组成染色质的核小体结构的基本蛋白分子。这3 个hub 基因和免疫与炎症反应相关,进一步验证了免疫功能在SIDS 中的作用。
综上,本研究通过生物信息学方法筛选出了SIDS与ISDI猝死者脑、心脏和肝组织中差异表达的mRNA,发现了ASTN1、H2AC6和NCDN等共同差异基因;经功能和通路分析发现,共同差异基因富集在肌动蛋白细胞骨架的调节、黏着斑和免疫反应等相关的信号通路;构建PPI 网络,确定了RHOA、ITGA1和H2BC5共3 个在互作网络中有高连接度的基因。上述结果表明,SIDS 与ISDI 可能存在某些共同的调控机制,这些发现有望为婴儿猝死的法医学鉴定提供分子标志物参考。
