UPLC-Q-TOF-MS 结合网络药理学及实验验证探讨益气平喘豆乳粉药物成分及其干预COPD 的作用机制
2023-12-01陈光宇瞿昊宇谢梦洲
田 慧,陈光宇,瞿昊宇,何 群,谢梦洲*
1.湖南中医药大学,湖南 长沙410208;2.湖南省药食同源功能性食品工程技术研究中心,湖南 长沙410208;3.湖南中医药大学中医心肺病证辨证与药膳食疗重点研究室,湖南 长沙410208
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是由炎症和气道重塑引起的持续气流阻塞,病程长,预后差。 除呼吸系统症状外,COPD还会继发性造成全身性损害,包括营养不良、骨骼肌病变、骨质疏松、心血管疾病、全身炎症反应等[1]。 世界卫生组织公布COPD 是第四大死亡原因,并估计到2030 年将上升到第三位[2]。COPD 属于中医学“肺胀”“喘证”等范畴,中医治疗常用中药汤剂、中成药、针灸等方法。 近年来药食同源产品在相关政策的支持下,在市场上得到了大力推广。相较于传统汤剂口感差、难以坚持长期服用、患者依从性低、难以兼顾患者的营养补充等方面的不足,药食同源功能性食品主要采用药食两用的中药,在中医学、营养学、药剂学等多学科理论的指导下,与谷物、果蔬等食材一同经过工艺优化制作而成,既具有防病保健的作用,又符合食品色香味俱全的属性。
针对COPD 长期病程中出现的营养不良所提出的营养支持疗法是近些年研究的热点[3]。 益气平喘豆乳粉是由湖南省药食同源功能性食品工程中心研发的一款针对COPD 的药食同源功能性食品,中药部分基于补益脾肺、化痰平喘的治法组方,辅料为豆乳粉和鸭肉蛋白肽粉。 本研究采用UPLC-Q-TOFMS 结合网络药理学探讨益气平喘豆乳粉的中药部分干预COPD 的潜在药效机制,并建立COPD 小鼠模型,采用ELISA、RT-PCR 等技术验证益气平喘豆乳粉干预COPD 的靶点及作用机制,旨在阐明益气平喘豆乳粉可有效辅助改善COPD 的临床病情,为功能性食品的工业化生产和应用提供理论依据。
1 材料
1.1 主要仪器
超高效液相色谱仪-四级杆-飞行时间质谱仪(美国ABSCIEXDISTRIBUTION 公司);自制烟熏箱(80 cm×70 cm×60 cm);Galileo 38355 切片机(意大利DIAPATH 公司);BIOBASE BT-1/B 摊片机(山东博科医疗器械有限公司);iMaik 酶标仪(伯乐生命医学产品上海有限公司);Light Cycler 480 实时荧光定量PCR 系统(上海罗氏诊断产品有限公司);N-3010 10L 旋转蒸发器(日本东京理化);SCIENTZ-10N 冷冻干燥机(宁波新芝生物科技股份公司);ZWL-PAI-10 超纯水机(湖南中沃水务环保科技);HTP-312型300g-0.01g-电子天平(上海花潮电器);TGL18W高速冷冻离心机(长沙英泰仪器有限公司)。
1.2 主要试剂与药物
益气平喘豆乳粉由湖南省药食同源工程中心提供(含药量为1.25 g/mL);红塔山香烟(焦油量:11 mg/支;烟气烟碱量:1.1 mg/支;烟气CO 量:11 mg/支)由红塔烟草有限责任公司提供;脂多糖、DEPC 水由广州硕谱生物科技有限公司提供;醋酸地塞米松(批号:LB2185) 由浙江仙据制药股份有限公司提供;反转录试剂盒(批号:05238502)由苏州近岸蛋白质科技股份有限公司提供;超纯总RNA 提取试剂盒(批号:20220613)由杭州新景生物试剂开发有限公司提供;小鼠IL-6、肿瘤坏死因子-α(tumor necrosis factor, TNF-α)ELISA 试剂盒(批号202211、202210)北京普利莱基因技术有限公司提供;PCR 引物设计由上海生工生物公司提供。
1.3 动物
36 只8 周龄SPF 级C57BL/6 雄性小鼠,体质量18~22 g,由湖南中医药大学实验动物中心订购。 动物实验许可证号:SCXK(湘)2019-0004,质量合格证号:430727221101566954,于湖南中医药大学实验动物中心SPF 级动物鼠房、室温(22±2) ℃、相对湿度65%~75%环境下适应性饲养3 d 后开始进行实验。实验期间自由饮水、摄食,饲料为普通饲料。 本实验经湖南中医药大学实验动物伦理委员会审查通过(伦理审批编号:LLBH-202207070001)。
2 方法
2.1 UPLC-Q-TOF-MS 分析检测药物化学成分
2.1.1 UPLC-Q-TOF-MS 分析条件 色谱条件:以十八烷基硅烷键合硅胶为填充剂(ACQUITY UPLC@BEH C18型色谱柱,1.7 μm,2.1 mm×100 mm);以甲醇为流动相A,以0.1%甲酸水溶液为流动相B;柱温35 ℃;流速0.3 mL/min;梯度洗脱:0~10 min,10%A;10~40 min,10%→100% A;40~45 min,100% A;45~47.5 min,100%→10% A;47.5~60 min,10% A。
质谱条件:采用电喷雾离子源(electrospray ionization, ESI),正、负离子模式:质量扫描范围100~1000 m/z;喷雾电压5500 V、-4500 V;雾化气温度550 ℃;气帘气35 psi;辅助气、雾化气50 psi;碰撞能量|CE|=35±15 eV。 TOF/MS 一级预扫描、TOF/MS/MS 二级扫描离子累积时间分别为100 ms、1150 ms,触发二级扫描的方法为信息依赖扫描,条件为多重质量亏损、动态背景扣除,满足者优先进行。
2.1.2 供试品溶液制备 空白对照液取质谱级甲醇溶液,离心(12 000 r/min,10 min)即得;将各药材经本课题组前期优化完成的提取工艺进行有效成分提取,提取液经减压浓缩、过滤离心后冷冻干燥为干浸膏粉。 精密称取中药复方干浸膏粉0.1 g 置于10 mL 离心管中,加水至10 mL 刻度,超声(250 Hz,200 W)60 min,取上清液置于2 mL 离心管中,离心(12 000 r/min)10 min,取上清液置于1.5 mL 进样小瓶中,即得。
2.1.3 质谱分析 精密吸取上述空白对照液、中药复方供试液各10 μL,注入液质联用仪,分析各供试液成分。 供试品溶液总离子流色谱图见图1。
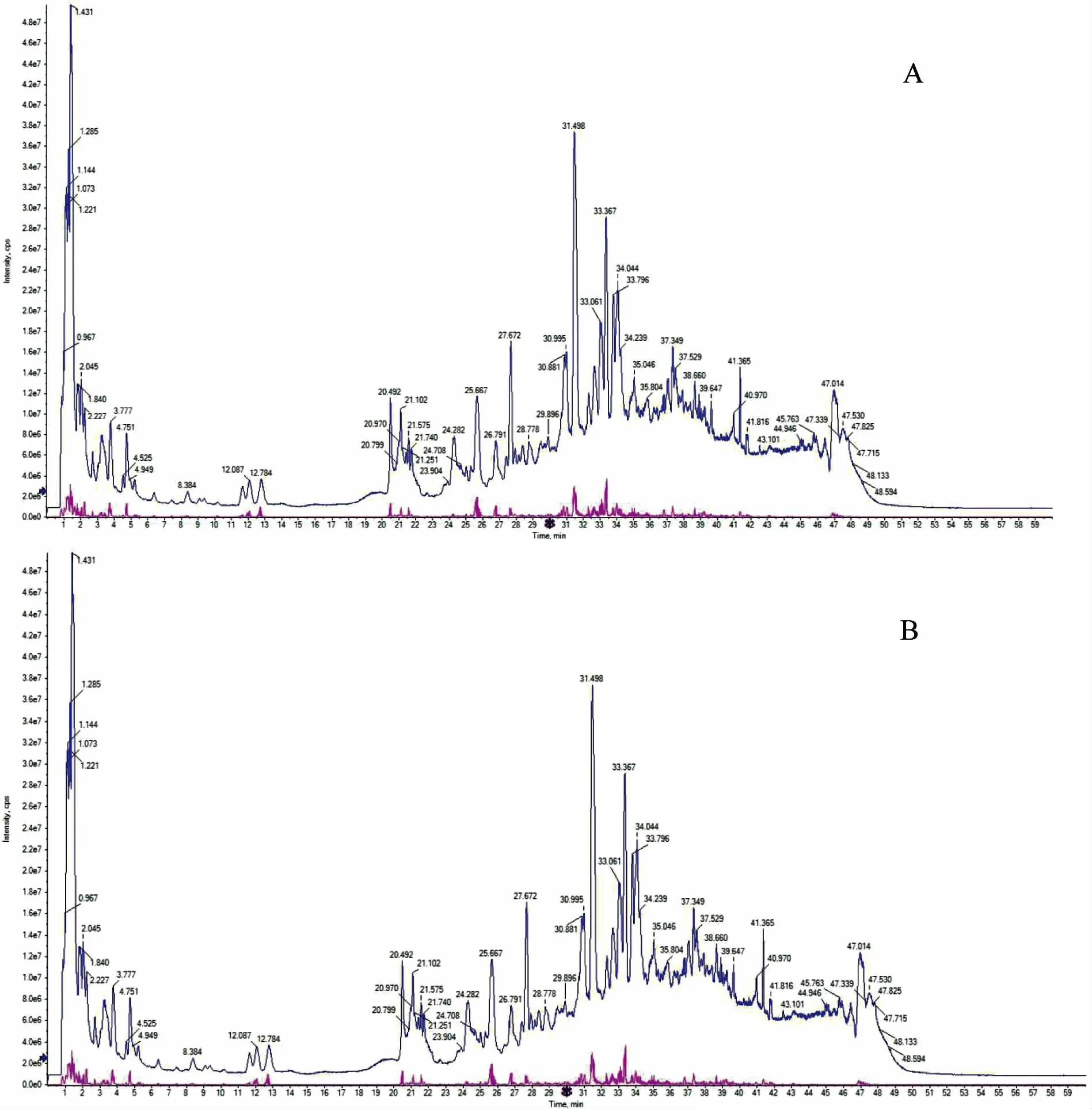
图1 总离子流色谱图
2.2 网络药理学分析
2.2.1 药物化学成分靶点与COPD 疾病相关靶点的筛选[4]采用UPLC-Q-TOF-MS 分析益气平喘豆乳粉中药复方成分,将化学成分名输入PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/)进行规范,并下载各成分sdf 文件,通过SwissTargetPrediction 数据库(http://www.swisstargetprediction.ch/)搜 索 各 成 分作用靶点。以“COPD”为关键词在GeneCards 数据库(www.genecards.org/)中检索COPD 相关靶点,把成分作用靶点和COPD 相关靶点输入Venny 2.1 软件取交集作用靶点作为益气平喘豆乳粉中药复方干预COPD 的潜在靶点。
2.2.2 PPI 网络构建与GO、KEGG 分析 为研究靶点之间的相互作用,将筛选出的潜在靶点导入STRING 平台(https://string-db.org/),设置蛋白种类为“Homo sapiens”,结果保存为“.tsv”格式并导入Cytoscape 3.7.2 软件,运用其中的插件“Network Analyzer”分析拓扑参数[5],以节点度值(Degree)为标准筛选出关键靶点。 按度值从大到小排序,确定益气平喘豆乳粉干预COPD 的核心靶点。 将关键靶点导入DAVID 6.8 数据库进行GO 和KEGG 通路富集分析,探索益气平喘豆乳粉干预COPD 的潜在作用机制。
2.3 动物实验验证
2.3.1 造模、分组及给药 将36 只小鼠随机分为正常组、模型组、地塞米松组、高剂量组、中剂量组、低剂量组,每组6 只。除正常组外,其余5 组进行造模。本实验参照文献[6]采用鼻滴脂多糖联合香烟烟雾建立COPD 模型:制作尺寸为80 cm×70 cm×60 cm的自制熏烟箱,烟箱设有进气孔和抽气孔,分别位于烟箱两上方侧壁,直径均为10 cm。 造模时,将点燃的8 根香烟放入烟箱中,将模型小鼠放入烟箱,持续暴露于烟雾中,15 min 中重新点燃8 支香烟放入烟箱,约15 min 后待烟雾散尽,休息30 min,重复上述操作。造模第1 天和第15 天将模型小鼠经鼻滴入脂多糖(50 μL/只,1 mg/mL),正常组小鼠滴入无菌生理盐水,当日不再进行熏烟操作,造模操作持续60 d。 造模第31 天开始每天上午给药,下午造模,共给药30 d,具体给药量见表1。
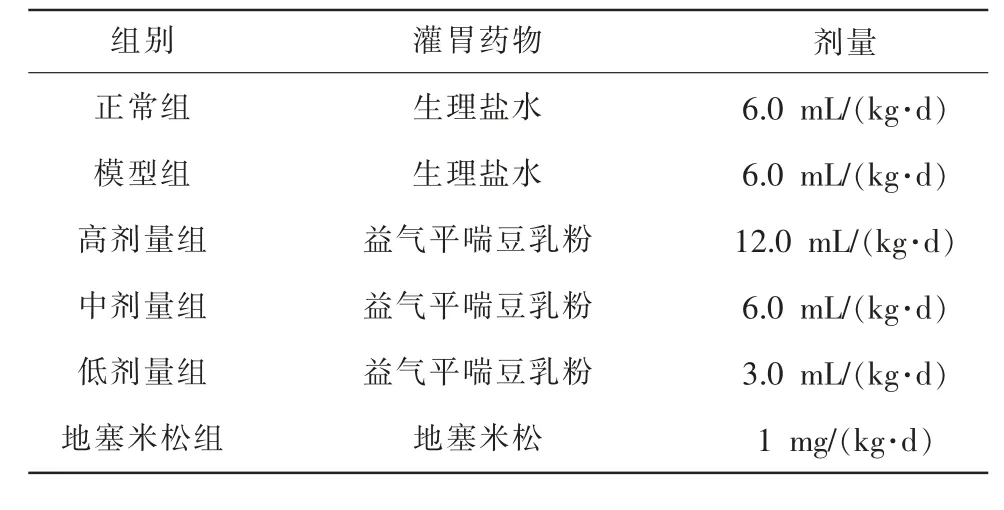
表1 动物实验分组及灌胃量(n=6)
2.3.2 动物取材及样本处理[7]末次给药后禁食12 h不禁水。 各组小鼠眼眶取血,室温静置2 h 待血液分层后,4 ℃、2 000 r/min 离心10 min,离心半径8 cm,吸取上层血清于离心管中,-80 ℃冰箱保存。对颈部皮肤消毒脱毛后行纵切口,暴露小鼠气管,将无菌留置针插入气管,无菌缝合线打结固定,由注射器向内注入1 mL 生理盐水,缓慢回抽BALF,重复3 次(1 mL生理盐水约回收0.6 mL 灌洗液)后注入无菌EP 管于冰上保存,取材完成后1 500 r/min 离心15 min,取上清于-80 ℃冰箱保存待测。收集完BALF 后,打开胸腔剪下肺组织,于生理盐水中浸洗后,左肺组织放入无菌EP 管中于-80 ℃冰箱中保存;右肺组织放入多聚甲醛固定液中室温保存待用。 肺组织剥离完成后取小鼠腹股沟白色脂肪及背脊部棕色脂肪于组织固定液待测。
2.3.3 肺组织、脂肪组织病理学观察 将固定好的右肺组织和脂肪组织脱水后进行浸蜡包埋,将包埋好的蜡块固定于切片机上切成薄片后烘干。 用二甲苯脱去切片中的石蜡,对切片脱蜡后进行染色、脱水、透明、封片。 将切片做好标记后镜下观察。
2.3.4 ELISA 检测小鼠血清及BALF 中TNF-α、IL-6 水平 严格按试剂盒操作检测血清及BALF 上清液中TNF-α、IL-6 水平。
2.3.5 RT-PCR 检测小鼠肺组织中TNF-α、ICAM-1、SELE mRNA 相对表达水平 按试剂盒说明书从小鼠肺组织中提取总RNA,参照反转录试剂盒说明书将RNA 反转录为cDNA,进行PCR 反应,以GAPDH为内参,引物序列见表2。 RT-PCR 结果分析采用QuantStudioTMDesign&Analysis Software 3.0 软件自动生成扩增曲线,采用2-△△Ct计算mRNA 的相对表达水平。

表2 引物序列表
2.4 统计学分析
3 结果
3.1 益气平喘豆乳粉中药复方成分识别
益气平喘豆乳粉中药复方供试液在拟定的分析条件下共鉴定出143 个化学成分,成分鉴定结果见表3。
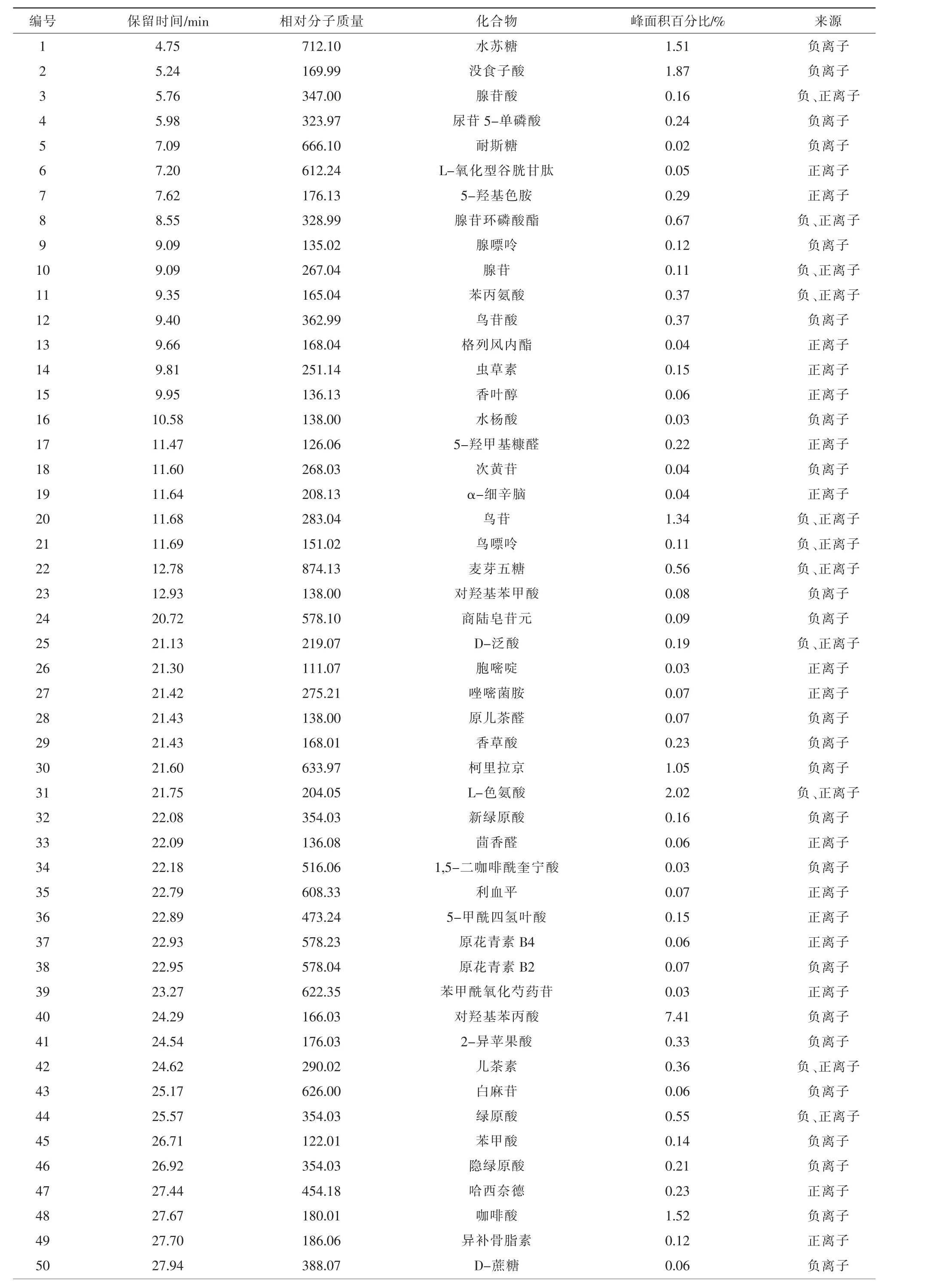
表3 益气平喘豆乳粉中药复方中的活性成分
3.2 益气平喘豆乳粉成分靶点与疾病靶点分析
根据SwissTargetPrediction 数据库获得活性成分作用靶点720 个,通过GeneCards 数据库获取COPD作用靶点共2 062 个,将成分作用靶点与COPD 相关靶点导入Venny2.1.0 软件,获得交集作用靶点297 个,见图2。
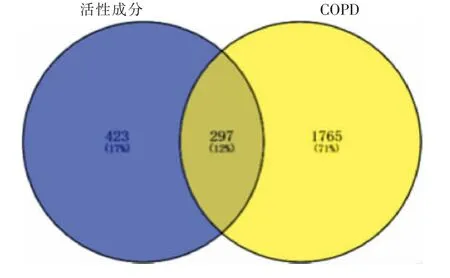
图2 活性成分靶点与COPD 疾病靶点维恩图
3.3 PPI 网络构建与分析
将筛选出的297 个共有靶点导入STRING 数据库,利用Cytoscape 3.7.2 软件设置节点的大小、颜色随度值大小变化,构建PPI 网络图,根据靶点的度值从大到小进行排序,前3 个靶点分别是:TNF、AKT1、IL-6。 详见图3。
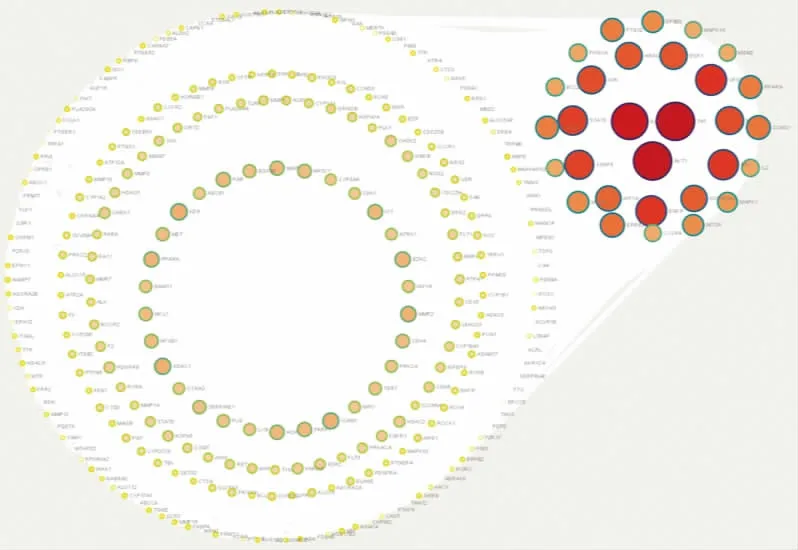
图3 交集靶点PPI 网络
3.4 GO 与KEGG 分析
利用DAVID 平台进行GO 富集分析和KEGG富集分析。 依据P<0.001 筛选出GO 条目1288 条,其中生物学过程(biological process, BP)共涉及933个,主要为凋亡负调控、蛋白质磷酸化、炎症反应、基因表达的正向调控等;得到细胞组成(cell composition, CC)108 个,主要为质膜、细胞外的外来体、等离子体膜等;得到分子功能(molecular function,MF)247 个,主要为酶结合、蛋白激酶活性、蛋白丝氨酸/苏氨酸激酶活性等,部分条目(靶点数≥10),详见图4A。KEGG 富集通路显示共有172 条信号通路,利用微生信平台(http://www.bioinformatics.com.cn/login/)对结果进行可视化,排名前20 的KEGG 通路气泡图见图4B。 结果显示,益气平喘豆乳粉干预COPD 主要涉及癌症通路、化学致癌作用-受体激活通路、脂质与动脉粥样化、PI3K-Akt 等信号通路。以COPD 通路为例,可以观察到PPI 网络中排名靠前的作用靶点均在此通路中被富集, 例如TNFα、IL-6、CASP 等,见图5。

图4 GO 功能富集分析(A)与KEGG 通路富集分析(B)
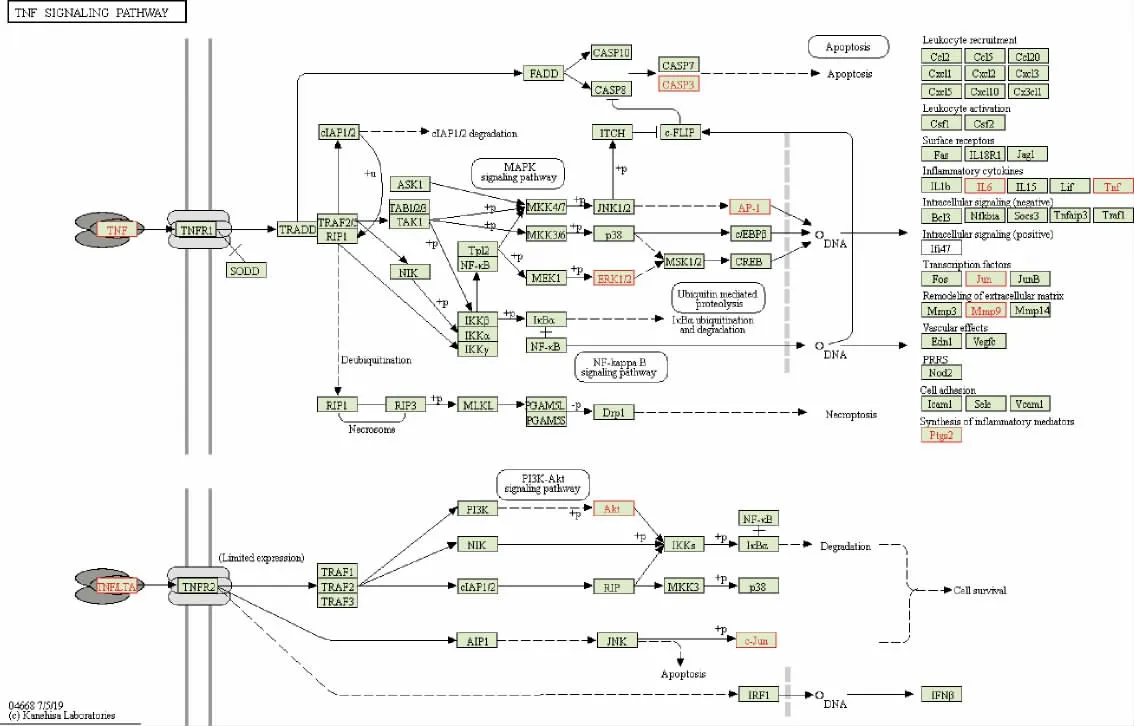
图5 COPD 通路示意图
3.5 动物实验验证
3.5.1 益气平喘豆乳粉对COPD 模型小鼠行为学及体重影响 实验期间,正常组小鼠毛发光亮柔顺,饮食正常,与正常组小鼠相比,其他造模小鼠可见毛发干枯发黄,易于脱落,弓背蜷缩,活动减弱,各给药组小鼠用药后相比模型组小鼠毛发干枯掉落现象、神情倦怠情况有所好转。
各组小鼠第1 天、造模第30 天、造模第45 天(灌胃第15 天)及造模第60 天(灌胃第30 天)的体质量如表4 所示。 本研究通过比较各组在实验过程中的体质量变化量考察益气平喘豆乳粉对小鼠营养状态的影响,每个时期相比上个阶段的体质量变化量结果如表5 所示,造模30 d 后正常组体质量有明显增长,其余造模组体质量增长缓慢,与正常组差异具有统计学意义(P<0.01);开始灌胃15 d 后,各组体质量变化幅度有所减小,中剂量组与低剂量组的体质量增长幅度较大[(1.89±0.46) g,(2.07±0.36) g](P<0.05);灌胃30 d 时,与正常组比较,模型组呈明显负增长[(-2.61±0.53) g](P<0.01);与模型组比较,灌胃30 d 后中剂量组和地塞米松组的体质量下降量较少(-1.50±0.20 g,-1.57±0.25 g)(P<0.05)。
表4 益气平喘豆乳粉对COPD 小鼠体质量的影响(g,±s,n=6)
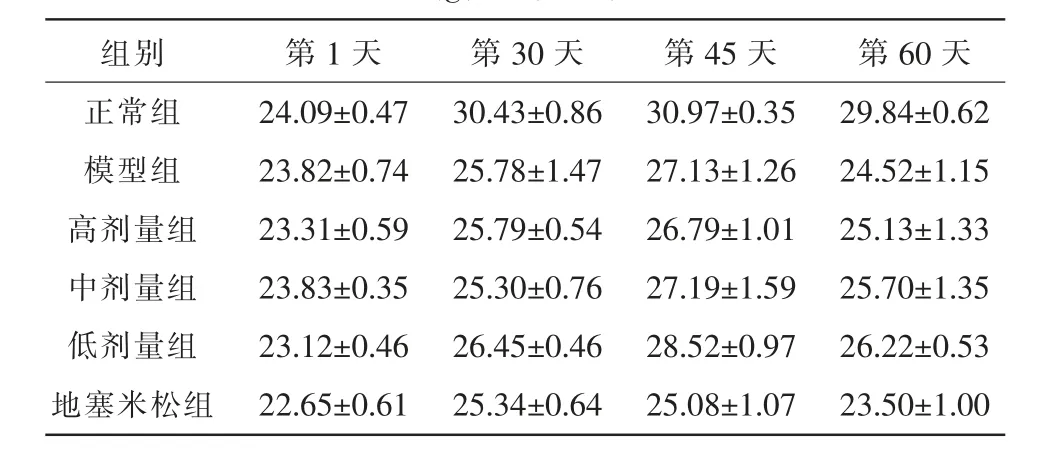
表4 益气平喘豆乳粉对COPD 小鼠体质量的影响(g,±s,n=6)
组别正常组模型组高剂量组中剂量组低剂量组地塞米松组第1 天24.09±0.47 23.82±0.74 23.31±0.59 23.83±0.35 23.12±0.46 22.65±0.61第30 天30.43±0.86 25.78±1.47 25.79±0.54 25.30±0.76 26.45±0.46 25.34±0.64第45 天30.97±0.35 27.13±1.26 26.79±1.01 27.19±1.59 28.52±0.97 25.08±1.07第60 天29.84±0.62 24.52±1.15 25.13±1.33 25.70±1.35 26.22±0.53 23.50±1.00
表5 各组小鼠体质量改变量(g,±s,n=6)
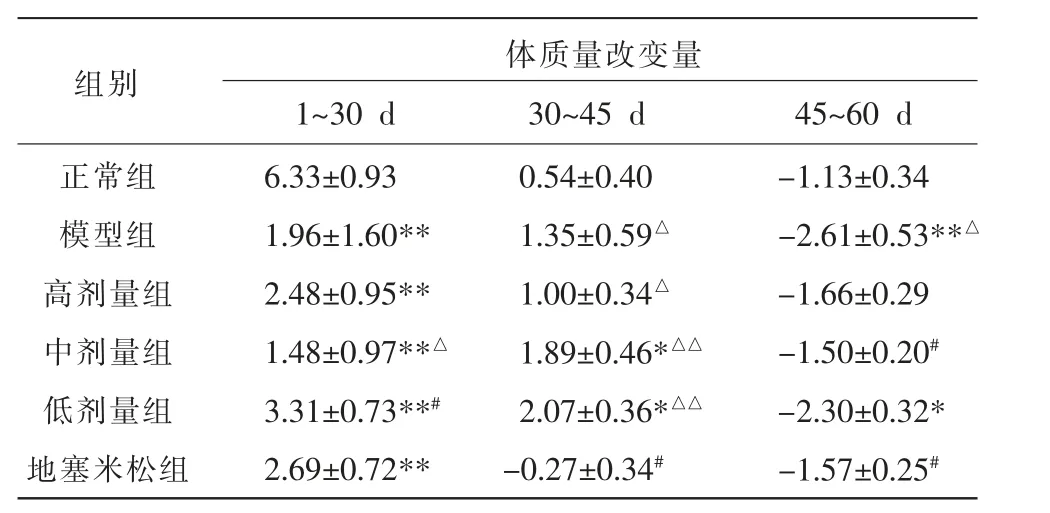
表5 各组小鼠体质量改变量(g,±s,n=6)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与地塞米松组比较,△P<0.05,△△P<0.01。
组别 体质量改变量1~30 d 30~45 d 45~60 d正常组模型组高剂量组中剂量组低剂量组地塞米松组6.33±0.93 1.96±1.60**2.48±0.95**1.48±0.97**△3.31±0.73**#2.69±0.72**0.54±0.40 1.35±0.59△1.00±0.34△1.89±0.46*△△2.07±0.36*△△-0.27±0.34#-1.13±0.34-2.61±0.53**△-1.66±0.29-1.50±0.20#-2.30±0.32*-1.57±0.25#
3.5.2 肺组织病理学 正常组小鼠肺泡组织结构完整,未见明显炎性细胞浸润及出血情况;模型组小鼠可见大量炎性细胞浸润,肺泡壁破坏融合出现大量肺大疱,符合COPD 小鼠肺组织病理学改变;经益气平喘豆乳粉干预后,肺组织病理学损伤减轻,炎性细胞浸润程度减轻、肺大泡数量减少,大小较为均匀。 详见图6。
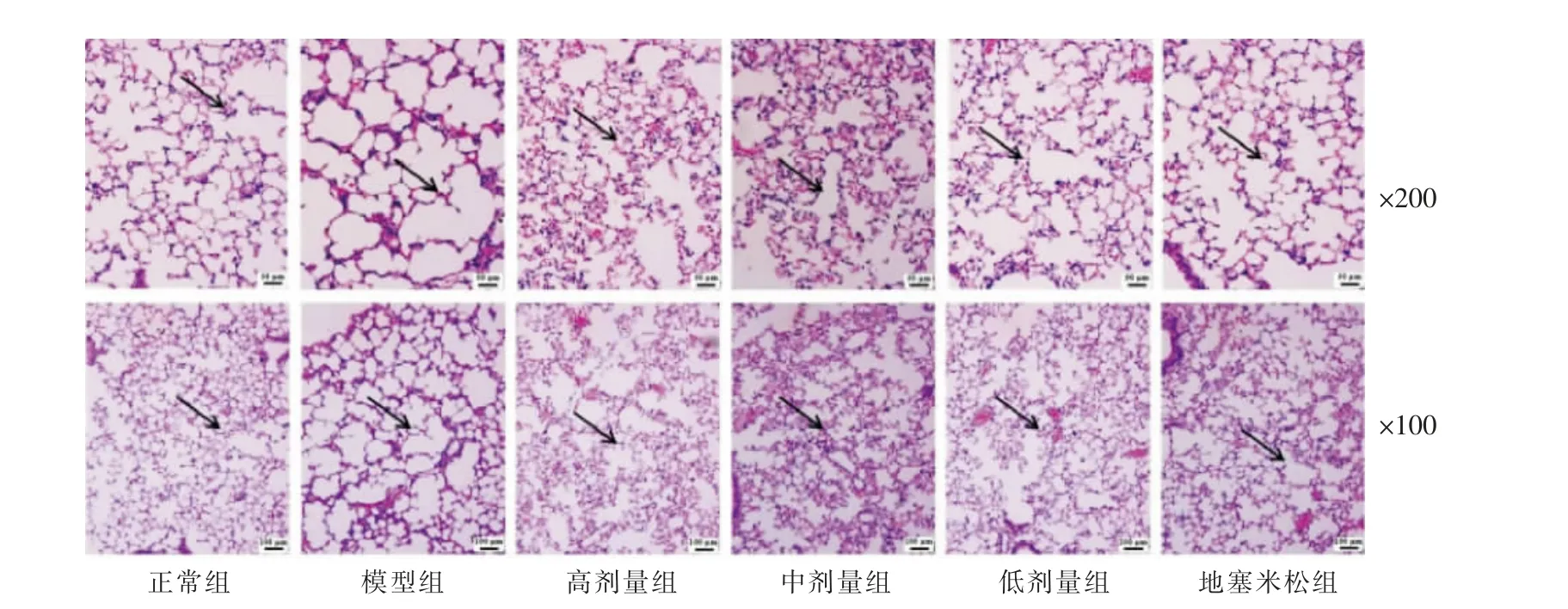
图6 肺组织HE 染色
3.5.3 脂肪组织病理学 HE 染色结果显示,相对于正常组,模型组小鼠皮下iWAT 较为松散,脂肪细胞直径较大,高、中、低剂量组及地塞米松组白色脂肪组织细胞变小紧致,具有棕色化趋势。 模型组小鼠相对于正常组脂肪组织中空泡脂滴增多,高、中、低剂量组及地塞米松组则细胞分布增多排列紧密,具有较为明显的棕色细胞形态特征。 详见图7。
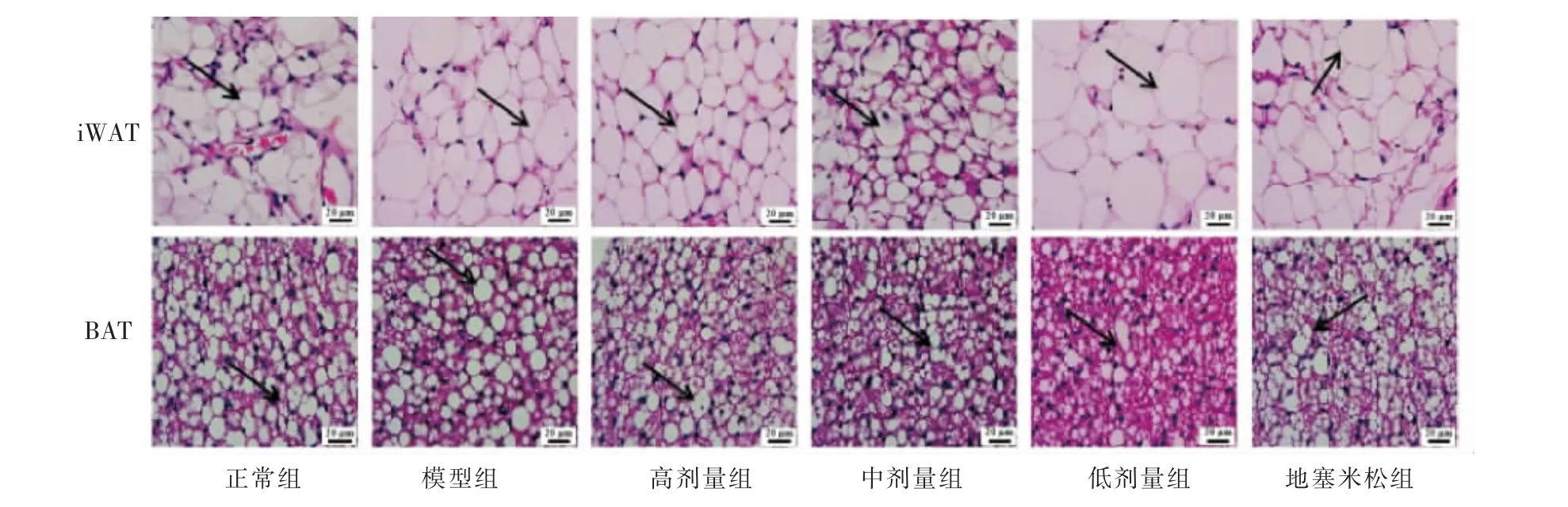
图7 脂肪组织HE 染色(×400)
3.5.4 益气平喘豆乳粉对COPD 小鼠炎症因子表达的影响 ELISA 结果显示,与正常组比较,模型组血清中TNF-α 和IL-6 的浓度均升高(P<0.05),BALF中TNF-α 和IL-6 浓度无显著差异。与模型组相比,高剂量组血清中TNF-α 浓度降低(P<0.05),中剂量组、低剂量组小鼠血清及BALF 中TNF-α 和IL-6浓度较低(P>0.05)。 详见图8。
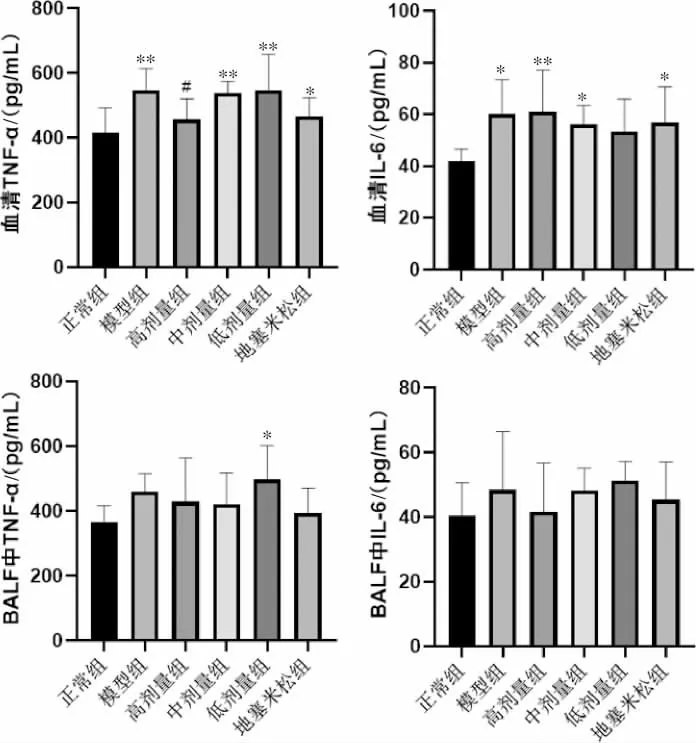
图8 血清和BALF 中TNF-α、IL-6 水平(pg/mL,±s,n=6)
3.5.5 益气平喘豆乳粉对COPD 小鼠肺组织TNF-α、ICAM-1、SELE mRNA 表达的影响 与正常组相比,模型组小鼠肺组织SELE mRNA 表达水平升高(P<0.05)。 与模型组相比,各用药组小鼠肺组织SELE mR NA 表达水平降低(P<0.05),其中益气平喘豆乳粉中剂量组小鼠肺组织SELE mRNA 表达水平最低。 详见图9。
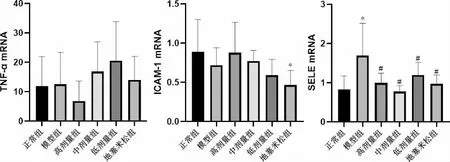
图9 TNF-α、ICAM-1 及SELE mRNA 表达(±s,n=6)
4 讨论
本研究基于UPLC-Q-TOF-MS 对益气平喘豆乳粉中药复方进行成分分析,得到143 个中药复方中活性成分,PPI 网络图表明益气平喘豆乳粉中药复方主要通过调节炎症通路上的TNF、AKT1、IL-6等靶蛋白表达,从而抑制炎症因子表达和炎症反应、改善氧化应激、调控细胞凋亡等以延缓COPD 进展[8]。富集分析显示GO 条目1 288 条,KEGG 通路172条,涉及凋亡负调控、蛋白质磷酸化(protein phosphorylation)、炎症反应、蛋白激酶活性、PI3K-Akt等多个过程和通路,PI3K-Akt 通路的营养感觉失调随着年龄增长而发生,该通路涉及营养可用性信号以调节细胞生长[9]。
有研究表明,TNF-α 可促进肺胶原纤维增生,增加细胞外基质分泌,导致肺纤维化病理改变,同时可刺激炎症因子,增强炎症反应[10],是机体炎症反应和免疫应答的重要介质,在COPD 的疾病发展进程中血清TNF-α 呈升高趋势[11]。IL-6 被认为是一种与年龄相关的促炎细胞因子,与负面健康结果和死亡率相关,与慢性炎症的持续有关[12]。 COPD 急性加重患者IL-6 升高,并与COPD 患者肺气肿的发展相关[13-14]。COPD 肺细胞表现出“衰老相关分泌表型”,特征是衰老的肺细胞分泌IL-6、IL-8、单核细胞趋化蛋白-1等促炎分子进一步促进COPD 的发展。 相关研究[15]表明,IL-6 等细胞因子介导的炎症反应可对COPD大鼠营养状态造成一定影响,大鼠体质量明显降低时,IL-6 水平升高。 与模型组相比,高剂量组小鼠血清中TNF-α 及IL-6 浓度降低差异显著,中、低剂量组无显著差异,但浓度均有降低;支气管灌洗液中TNF-α、IL-6 浓度无显著差异,说明该药食同源食品在部分COPD 相关指标上有改善作用,但相对药物疗效较弱。
SELE 可介导白细胞或单核细胞于内皮细胞粘附并向炎症部位积聚[16],与TNF-α mRNA 共同作为益气平喘豆乳粉改善COPD 炎症效果的评估指标。此外,营养不良小鼠脂肪组织会呈现空泡脂滴增多现象[17],高、中、低剂量组在给药后各组脂肪组织可见空泡脂滴数量减少,体重降低趋势减缓。
综上所述,本研究通过UPLC-Q-TOF-MS 及网络药理学的技术,分析益气平喘豆乳粉中药复方的活性成分、靶点、通路与COPD 的作用关系,通过动物实验验证上述结果并证明其对COPD 小鼠模型营养状态的改善作用,发现益气平喘豆乳粉可能通过影响TNF 通路,抑制TNF-α、IL-6 从而改善COPD气道炎症及肺部损伤状态。 本研究可为益气平喘豆乳粉的进一步研发和生产提供理论依据,同时为药食同源功能性食品的开发提供参考借鉴。 本研究存在的不足主要是由于设备原因缺乏肺功能指标的检测,以及未明确益气平喘豆乳粉改善营养不良的机制,组别之间存在显著差异结果较少;未明确益气平喘豆乳粉与纯食材辅料相比是否具有同等营养价值或发挥更优作用。
