汉防己甲素干预HIF-1α/PD-1/PD-L1 轴抑制口腔鳞癌侵袭潜能的机制研究
2023-12-01彭坷平田桂湘彭书旺宾东华左巧娟谢海清
彭坷平,田桂湘*,彭书旺,宾东华,左巧娟,谭 焱,谢海清
1.湖南中医药大学第一附属医院, 湖南 长沙410007;2.中南大学湘雅二医院,湖南 长沙410011
口腔鳞癌(oral squamous cell carcinoma, OSCC)是一种口腔恶性肿瘤,因其在口腔恶性肿瘤中的发病率高达90%,且具较高的侵袭性和转移能力,对人类健康造成严重威胁[1]。 目前,针对OSCC 的治疗手段主要包括手术切除、放射治疗和化学药物治疗等,可以有效除去病灶,杀灭体内的癌细胞,改善术后生存质量和延长生存期。 但由于OSCC 靠近上呼吸道和颅脑等关键部位,常规手术治疗无法彻底清除中晚期已转移的癌组织;同时,放射治疗和化学药物治疗对患者的不良反应较大,难以满足患者的需求。因此,针对OSCC 探索新的疗法对改善患者预后具有重要意义。在临床应用中,与不良反应明显的化学药物治疗相比,中药具有药性温和、毒性低的优势[2]。汉防己甲素(tetrandrine, TET)是从汉防己根中分离出来的一种生物碱, 具有良好的镇痛作用,常用于治疗硅沉着病(矽肺)、心脑血管以及免疫性疾病[3]。 近年来,TET 的抗肿瘤作用得到了广泛的研究。 如LUAN 等[4]研究报道,TET 可以在肺癌、结肠癌、膀胱癌等多种癌症中发挥抗癌活性。 然而,关于TET 对OSCC 的治疗作用及其机制尚无定论。 程序性细胞死亡蛋白1(programmed cell death protein 1, PD-1)是免疫球蛋白B7 超家族成员,程序性细胞死亡蛋白1 配体(programmed cell death ligand 1,PD-L1)与免疫系统抑制密切相关,能抑制T 细胞活化及特定细胞因子分泌,对肿瘤免疫逃逸起重要作用[5]。 既往研究指出,PD-L1 及PD-1 可介导肿瘤发生发展过程,与肿瘤分化程度、TNM 分期以及淋巴结转移存在密切关联[6-7]。 为了探讨TET 对OSCC侵袭潜能的影响及其机制,本研究通过体外细胞实验研究TET 经HIF-1α/PD-1/PD-L1 轴对OSCC 细胞的细胞活性、迁移及侵袭的影响,为后期分析该药物对OSCC 的治疗机制提供参考依据。
1 材料
1.1 主要药物与试剂
TET(湖北威德利化学科技有限公司,批号:518-34-3);人正常口腔上皮细胞系HOEC、OSCC 细胞系SCC25(武汉普诺赛生命科技有限公司,批号:CP-H203、CL-0569);RPMI-1640 培养基、胎牛血清、胰酶、GAPDH 抗体(美国赛默飞科技有限公司,批号:2643863、12483020、2425734、Y1379805);MTT、DMEM 培养基、缺氧诱导因子-1α(hypoxia-inducible factor-1α, HIF-1α)抗体、PD-1 抗体、PD-L1 抗体、山羊抗兔二抗(美国英杰生命技术有限公司,批号:2765711、2436820、WL3457364、YA3804591、2003463、2277758);DMSO(上海卡迈舒生物科技有限公司,批号:2714422);PBS(武汉普诺赛生命科技有限公司,批号:2524465)。
1.2 主要仪器
MCO-5AC 型CO2培养箱(山东欧莱博医疗器械有限公司);MH-2 型微型振荡仪(广州越特科学仪器有限公司);CKX53 型倒置显微镜(日本奥林巴斯有限公司);DYCP-31DN 型电泳仪(北京鑫诺宸仪器仪表有限公司);TE70XP 型半干电转膜仪(美国Hoefer 公司);ZF-258 型凝胶成像仪(上海嘉鹏仪器设备公司);Q1000 型PCR 仪(济南千司生物技术有限公司)。
2 方法
2.1 细胞培养及分组
将HOEC 和OSCC 细胞分别在DMEM 和RPMI-1640 培养基中培养,添加10%的胎牛血清、1%青霉素和链霉素混合抗生素,置于37 ℃、5% CO2培养箱中培养。 采用胰酶对80%及以上融合率的细胞消化传代。 以对数期的细胞作为实验对象。 以不添加TET 处理的细胞作为对照组;添加10 μmol/L TET的细胞作为低剂量组;添加20 μmol/L TET 的细胞作为中剂量组;添加30 μmol/L TET 的细胞作为高剂量组。 吸取5×105个对数生长期的SCC25 细胞,接种于6 孔板(6 份),当其生长至80%融合度时进行转染,按Lipofectamine 2000 试剂说明书,根据实验目的,分别转染HIF-1α 模拟物、HIF-1α 抑制剂;PD-1 模拟物、PD-1 抑制剂;HIF-1α 模拟物、PD-L1抑制剂。 每组均连续转染24 h。
2.2 MTT 法检测细胞活力
将OSCC 细 胞 置 于96 孔 板(1.5×104个/孔)中进行传代,保证细胞在37 ℃、5% CO2条件下培养24 h,将TET 溶液加入每孔,使其浓度分别为0、5、10、20、40、50 μmol/L,每个浓度级设3 个复孔,于培养箱内分别培养24、48、72 h 后,加入50 μL 的MTT溶液,培养2 h 后分别加入DMSO(150 μL/孔)溶解沉淀,然后通过振荡使沉淀充分溶解;采用酶联免疫检测仪测出每孔吸光度(opticaldensity, OD)值,波长为490 nm,读取每组OD 值并计算平均值。 计算公式如下:细胞存活率(%)=(药物组OD 值-空白组OD 值)/(对照组OD 值-空白组OD 值)×100%。
2.3 划痕实验检测细胞的迁移能力
将细胞接种在6 孔板(5×106个/孔)中培养。 待细胞融合度达到90%时,采用无菌塑料头迅速在细胞上划出宽度均一的痕迹,用PBS 洗涤除去悬浮的细胞。 然后对细胞进行药物干预,干预完成后继续在培养箱中培养各组细胞。 在0、48 h 时间点下,拍摄照片,从而判定各组细胞划痕愈合率。 计算公式如下:划痕愈合率(%)=(愈合面积/划痕面积)×100%。
2.4 Transwell 实验检测细胞的侵袭能力
Transwell 实验可评估细胞的侵袭能力,细胞如突破Matrigel 胶转移至多孔膜下表面,即为细胞具有侵袭能力。 细胞转染24 h 后用胰酶消化并计数,将细胞接种于Matrigel 胶包被的Transwell 小室,孔板下室加入含有15%胎牛血清的培养基, 常规培养48 h后,将Transwell 小室取出,取出其中的培养液,并用PBS 冲洗干净,孔板下室细胞通过甲醛固定30 min,通过0.1%结晶紫染色15 min,在显微镜下随即选取5 个视野记录穿膜细胞数。
2.5 RT-qPCR 检测HIF-1α、PD-1、PD-L1 表达水平
通过RNA 提取试剂盒对待测细胞进行RNA 提取,并依照说明书逆转录得到cDNA 链。 通过PCR仪以cDNA 链为模板进行扩增。反应条件如下:94 ℃4 min,94 ℃32 s,62 ℃32 s,75 ℃3 min, 共40个循环。 基因表达值以2-ΔΔCt法[8]计算,以GAPDH 作为内参基因。 HIF-1α 正向序列:5'-ACTTGGCAACCTTGGATTGG-3',反向序列:5'-ATCTCCGTCCCTCAACCTCT-3';PD-1 正向序列:5'-TAGAAATACCATTTGACCCA-3',反向序列:5'-CCATTACTGGGTATATACCC-3';PD-L1 正 向 序 列:5′-TCACTTGGTAATTCTGGGAGC-3′,反向序列:5′-CTTTGAGTTTGTATCTTGGATG;GAPDH 正向序列:5'-GAGAGTGCCCACTCCTGCCA-3',反向序列:5'-CTCAGTGAGCCTCCTCTGGT-3'。
2.6 Western blot 检测相关蛋白表达水平
取各组OSCC 细胞,在4 ℃下12 000 r/min 离心10 min(离心半径10 cm),加入裂解液裂解后,加入Loading Buffer 缓冲液,选择蛋白质定量法(波长为562 nm)检测各组蛋白含量,然后进行灌胶上样操作。 取适量样本与SDS 样品缓冲液混合,加热煮沸5 min,然后4 ℃ 12 000 r/min 离心10 min(离心半径10 cm)后取上清液,进行电泳分离。根据胶的大小剪取膜和滤纸,在转膜前,先用甲醇浸泡PVDF 膜3 s,然后选择半干法转至PVDF 膜。 将膜置于封闭缓冲液中1 h,在室温下进行摇动以封闭。加入一抗纤维连接蛋白(Fibronectin)(1∶500)、波形蛋白(Vimentin)(1∶1 000)、E-钙黏蛋白(E-cadherin)(1∶2 000)、HIF-1α(1∶1 000)、PD-1(1∶100)、PDL1(1∶500)和GAPDH(1∶1 000)在4 ℃下过夜,加入IgG 二抗(1∶2 000),37 ℃孵育1 h,取出胶片,浸入显色液中1 min,清洗后显影,并通过Image-Pro-Plus 软件进行分析,以GAPDH 为内参,计算各蛋白的相对表达水平。
2.7 统计学分析
3 结果
3.1 TET 抑制OSCC 细胞活力
细胞经过24、48、72 h 培养后,随着药物作用时间的增加以及TET 浓度的增加,OSCC 细胞存活率降低(P<0.05)。 详见图1。

图1 TET 对OSCC 细胞活力的影响
3.2 TET 抑制OSCC 细胞的迁移能力
与对照组比较,低、中、高剂量组细胞的愈合率显著降低(P<0.05),且随剂量增加,细胞愈合率逐渐降低(P<0.05)。 详见图2。

图2 TET 对OSCC 细胞迁移能力的影响
3.3 TET 抑制OSCC 细胞的侵袭能力
与对照组比较,低、中、高剂量组的穿膜细胞数显著降低(P<0.05),且随剂量增加逐渐降低(P<0.05);Fibronectin 和Vimentin 蛋白显著下调(P<0.05),且随剂量增加逐渐下调(P<0.05);E-cadherin 蛋白显著上调(P<0.05),且随剂量增加逐渐上调(P<0.05)。详见图3—4。

图3 TET 对OSCC 细胞侵袭能力的影响

图4 各组上皮间质转化相关蛋白相对表达水平比较
3.4 HIF-1α/PD-1/PD-L1 在OSCC 细胞系中的表达水平
与正常口腔上皮细胞比较,OSCC 细胞中HIF-1α、PD-1 和PD-L1 显著上调(P<0.05)。 详见图5。

图5 HIF-1α、PD-1、PD-L1 在正常口腔上皮细胞及OSCC 细胞系中的表达差异
3.5 TET 抑制HIF-1α、PD-1 和PD-L1 蛋白表达水平
与对照组比较,低、中、高剂量组HIF-1α、PD-1及PD-L1 蛋白的表达量明显下降(P<0.05),且随剂量增加,蛋白的表达量逐渐降低(P<0.05)。 详见图6。

图6 各组HIF-1α、PD-1 及PD-L1 蛋白的表达结果比较
3.6 HIF-1α、PD-1、PD-L1 表达对OSCC 细胞的侵袭能力的影响
转染HIF-1α 模拟物细胞的HIF-1α 相对表达量及穿膜细胞数高于转染HIF-1α 抑制剂细胞(P<0.05),转染PD-1 模拟物细胞的PD-1 相对表达量及穿膜细胞数高于转染PD-1 抑制剂细胞(P<0.05),转染PD-L1 模拟物细胞的PD-L1 相对表达量及穿膜细胞数高于转染PD-L1 抑制剂细胞(P<0.05)。 详见图7—8。
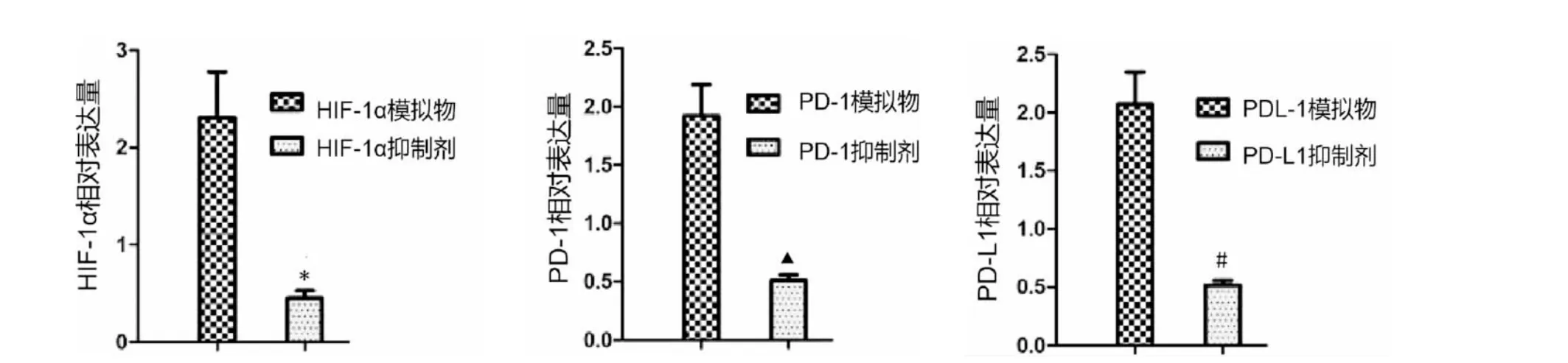
图7 HIF-1α、PD-1、PD-L1 在转染模拟物及抑制剂细胞中的表达差异
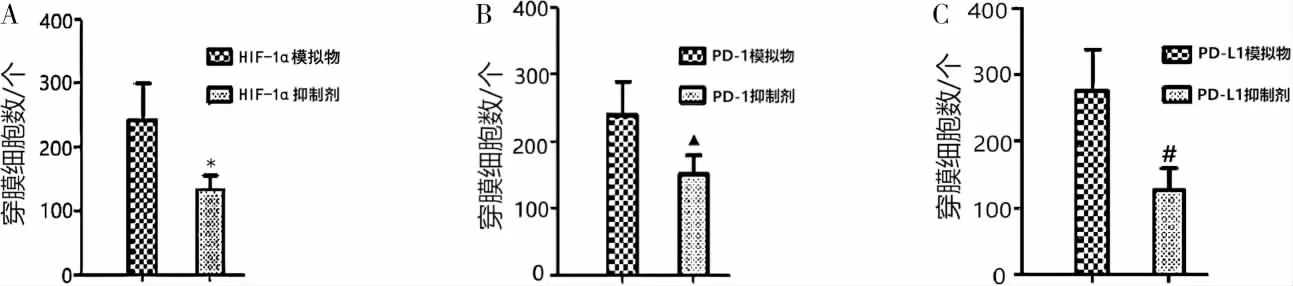
图8 转染HIF-1α、PD-1、PD-L1 模拟物及抑制剂对OSCC 细胞侵袭能力的影响
4 讨论
OSCC 是全球第六大常见的上皮恶性肿瘤,有较高的发病率和死亡率[9-11]。 由于此病早期症状隐匿,易被忽视,且具有较强的侵袭性,容易发生淋巴结转移及局部侵袭,导致手术难以彻底清除,从而影响治疗效果[12-14]。 近年来,对OSCC 的诊断和治疗取得了重大进步,但是OSCC 患者的预后仍然不理想,5 年生存率仅为50%,仍然严重威胁人类健康[15]。 因此,寻找新的药物对辅助OSCC 的治疗意义重大。
TET 是一种天然产物,具有多种生物活性,包括抗炎、抗氧化和抗肿瘤等作用[16]。近年研究显示,TET作为一种天然的抗肿瘤物质,可抑制舌鳞癌细胞的生长[17]。 癌细胞的活力可以反映恶性肿瘤细胞的增殖速度,癌细胞活力越大,则其增殖潜力越大。 在本研究中,通过MTT 实验发现,细胞经过24、48、72 h培养后,随着作用时间的加长以及TET 浓度的增加,OSCC 细胞活力越来越低,TET 显著降低了OSCC 细胞的活力。 这一结果与既往研究报道的TET 可以显著抑制子宫内膜癌细胞活力的结果相类似[18]。 肿瘤细胞发生迁移、侵袭等行为通常可以作为肿瘤恶化的标志。 本研究通过细胞迁移和侵袭实验,发现TET 可以抑制OSCC 细胞的迁移和侵袭能力,且随着TET 剂量的增加,细胞愈合率、穿膜细胞数显著降低,高剂量组低于中剂量组与低剂量组,中剂量组低于低剂量组,提示TET 或存在抑制OSCC 细胞迁移与侵袭的能力。 在本研究中,发现经低、中、高剂量TET 干预后,细胞中E-cadherin 蛋白水平显著上调,而Vimentin 和Fibronectin 蛋白水平显著下调。 以上结果说明TET 可以通过抑制上皮间质转化从而抑制OSCC 细胞的侵袭能力,与黄晏军等[19]报道的TET可以有效抑制三阴性乳腺癌的细胞增殖和迁移的发现相类似。
张雅莉等[20]发现,PD-1 及PD-L1 在宫颈癌组织中过表达,且与患者肿瘤分化程度、TNM 分期以及淋巴结转移密切相关。 有研究表明,HIF-1α 过表达与癌症及其转移、放射治疗和化学药物治疗耐药性以及患者死亡率上升有关,且抑制HIF-1α 活性可显著抑制血管生成和肿瘤生长[21-22]。 本研究发现,转染HIF-1α、PD-1、PD-L1 抑制剂细胞穿膜细胞数显著低于转染HIF-1α、PD-1、PD-L1 模拟物细胞,表明HIF-1α、PD-1 和PD-L1 表达上调可增强OSCC 细胞侵袭能力,进一步证实了HIF-1α/PD-1/PDL1 轴相关指标变化对OSCC 的影响。 本研究从HIF-1α/PD-1/PD-L1 轴入手,分析了TET 对OSCC 细胞的影响,TET 处理OSCC 细胞后,HIF-1α、PD-1 和PD-L1 蛋白表达显著下调,提示TET 可能通过下调HIF-1α、PD-1 和PD-L1 表达,抑制OSCC 细胞侵袭。
综上所述,本研究通过体外细胞实验初步探索了TET 在OSCC 细胞中的抗癌功效,发现TET 可以抑制OSCC 细胞活性及迁移侵袭能力,并揭示其可能通过抑制HIF-1α/PD-1/PD-L1 轴来抑制OSCC细胞的侵袭。 但其具体作用机制还有待更深入地探索与分析。
