温脾补肾泄浊汤辅助治疗脾肾阳虚血瘀型糖尿病肾病疗效观察
2023-12-01魏田静李红霞刘晓宇庞丽王亚立
魏田静,李红霞,刘晓宇,庞丽,王亚立
河北中医学院第二附属医院内分泌病科,河北定州073000
糖尿病肾病(DKD)是糖尿病常见的严重微血管病变之一,起病隐匿,早期症状不明显,随着病情进展可出现尿蛋白渐进性增多与肾功能减退,当出现显性蛋白尿时,病情可迅速发展为终末期肾脏病,后者是糖尿病患者死亡的常见原因[1-2]。西医治疗DKD主要以控制血糖、血压、血脂、利尿等对症支持治疗为主,仅能短期控制病情,疗效有限,难以有效抑制肾脏损害进展[3-4]。中医药在防治DKD方面具有明显优势,有助于缓解临床症状、改善肾功能并延缓病情进展[5]。DKD属中医“下消”“水肿”“虚劳”“关格”等范畴,基本病机为“阳虚”“血瘀”,脾肾阳虚兼血瘀证是其常见中医证型,针对该证型DKD治疗宜健脾补肾、活血化瘀。温脾补肾泄浊汤通过温补脾肾阳气、活血化瘀、调理水液代谢等多方面发挥作用,可改善肾小球滤过功能,减轻糖尿病肾病症状。温脾补肾泄浊汤作为临床经验方,用于治疗DKD效果满意。本研究观察了温脾补肾泄浊汤联合西医常规疗法治疗脾肾阳虚血瘀型Ⅲ、Ⅳ期DKD的临床疗效,以及患者肾脏血流动力学指标及血清炎症因子、血清转化生长因子β1(TGF-β1)、超氧化物歧化酶(SOD)水平变化。现报告如下。
1 资料与方法
1.1 临床资料 选择2020年1月—2023年1月收治的104例脾肾阳虚兼血瘀型DKD患者作为研究对象。纳入标准:①符合DKD诊断标准[6];②Mogensen分期[7]为Ⅲ~Ⅳ期;③中医辨证为脾肾阳虚兼血瘀证[8-9];④年龄30 ~ 75岁;⑤经基础降糖治疗,糖化血红蛋白(HbA1c)维持在7%以下;⑥经基础降压,舒张压维持在90 mmHg以下;⑦近3个月内无恶性高血压病、脑血管意外、心肌梗死、糖尿病酮症酸中毒、高渗性昏迷等危急重症病史;⑧研究对象对研究内容和目的知情,并自愿签署知情同意书;⑨对温脾补肾泄浊汤中成分无过敏史。排除标准:①非2型糖尿病所致肾损害;②急性肾功能衰竭或心力衰竭;③难治性水肿;④低蛋白血症;⑤泌尿系统感染等感染性疾病;⑥心、脑、肝、肺等其他重要器官功能障碍;⑦造血系统疾病;⑧自身免疫性疾病;⑨恶性肿瘤;⑩妊娠或哺乳期;⑪精神或智力障碍,无法配合本次研究。按随机数字表法分为观察组和对照组各52例。观察组男30例、女22例,年龄42 ~ 75(57.48 ± 9.25)岁,2型糖尿病[10]病程5 ~ 18(9.62 ± 2.91)年,DKD病程1 ~ 8(3.12 ± 0.74)年,Mogensen分期Ⅲ期25例、Ⅳ期27例。对照组男27例、女25例,年龄45 ~ 74(56.32 ±8.44)岁,2型糖尿病病程6 ~ 19(10.24 ± 3.17)年,DKD病程1 ~ 8(3.34 ± 0.89)年,Mogensen分期Ⅲ期28例、Ⅳ期24例。两组性别、年龄、2型糖尿病病程、DKD病程、Mogensen分期资料差异无统计学意义(P均>0.05)。本研究符合《赫尔辛基宣言》要求,经医院医学伦理委员会批准(批准文号2021-KY-06)。
1.2 治疗方法 两组均给予西医常规疗法治疗:包括给予阿卡波糖片、格列喹酮片或注射胰岛素控制血糖,使空腹血糖控制在7.8 mmol/L以下,餐后2 h血糖控制在10 mmol/L以下;给予血管紧张素转换酶抑制剂、血管紧张素Ⅱ受体拮抗剂等药物控制血压,使舒张压控制在90 mmHg以下;给予阿托伐他汀、辛伐他汀等控制血脂,使甘油三酯(TG)控制在1.7 mmol/L以下,总胆固醇(TC)控制在5.98 mmol/L以下;蛋白质摄入量控制在0.8 g/(kg·d)以下,营养不良者给予复方α-酮酸片;每日食盐摄入量控制在3 g以下;每日适当锻炼。观察组在常规治疗基础上联合温脾补肾泄浊汤治疗:处方包括黄芪、太子参、山药、丹参、泽兰各30 g,白术、芡实、金樱子、当归、牛膝各15 g,生地、五味子、肉桂各10 g,水蛭、附子各6 g,茯苓20 g,山茱萸12 g,酒大黄9 g;水肿重者加猪苓15 g、车前子10 g、益母草30 g;每日1剂,水煎取汁300 mL,分早晚2次温服(一次150 mL)。疗程1个月。
1.3 中医证候积分评分方法 参照文献[9]对患者各项主要中医症状(畏寒肢冷、神疲乏力、腰膝酸软)按照严重程度进行计分,其中无症状0分、轻度2分、中度4分、重度6分;对各项次要中医症状(口渴喜饮、肢体麻木、浮肿、尿浊、夜尿频多)按照严重程度进行计分,其中无症状0分、轻度1分、中度2分、重度3分。积分越高则症状越严重。
1.4 肾功能指标及肾脏血流动力学指标检测 分别于治疗前后采集患者空腹静脉血12 mL,3 000 r/min离心15 min,分离血清,分装密封-80 ℃冻存待检。分别采用肌氨酸氧化酶法、脲酶速率法测定血清肌酐(Cr)、尿素氮(BUN);采用免疫比浊法检测血清胱抑素C(CysC);采用简化肾脏病膳食改良试验(MDRD)公式[11]计算eGFR。分别于治疗前后收集患者晨起第1次至24 h内尿液样本,混匀后取5 mL,选用特定蛋白分析仪以免疫比浊法检测尿液β2-微球蛋白(β2-MG)、微量白蛋白;计算UAER,UAER=尿微量白蛋白×24 h尿量。分别于治疗前后选用iU22型彩色超声诊断仪(荷兰PHLIPS公司)检测双侧肾叶间动脉的收缩期峰值血流速度(PSV)、舒张末期血流速度(EDV)、阻力指数(RI)。
1.5 血清炎症相关指标、TGF-β1、SOD检测 分别于治疗前后采用免疫比浊法检测C反应蛋白(CRP),采用ELISA法检测血清肿瘤坏死因子1型受体(TNFR1)、TGF-β1、SOD;采用血细胞分析仪行血常规检查,计算中性粒细胞与淋巴细胞比值(NLR)。
1.6 临床疗效评价 参照文献[8-9]评价疗效。显效:临床症状体征基本消失,中医证候积分降低≥70%,24 h尿蛋白定量、UAER减少≥50%或恢复正常,血清Cr下降≥30%;有效:临床症状体征明显好转,中医证候积分降低30% ~ <70%,24 h尿蛋白定量、UAER减少30% ~ <50%,血清Cr下降10% ~<30%;无效:未达上述标准,甚或病情加重。总有效率=(显效例数+有效例数)/总例数×100%。
1.7 用药安全性评价 治疗过程中监测两组血、尿、便常规及肝功能,观察患者用药期间不良反应发生情况。
1.8 统计学方法 采用SPSS22.0统计软件。采用Kolmogorov-Smirnov法及Levene法检验数据的正态性和方差齐性,方差不齐或偏态分布的计量资料以M(P25,P75)表示,采用Wilcoxon秩和检验或Wilcoxon符号秩检验;呈正态分布、方差齐的计量资料以表示,采用独立样本t检验或配对样本t检验。计数资料以例(%)表示,采用χ2检验;当总例数<40或最小理论频数<1时,使用Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 两组中医证候积分比较 治疗后,两组各项中医证候积分(畏寒肢冷、神疲乏力、腰膝酸软、口渴喜饮、肢体麻木、浮肿、尿浊、夜尿频多)均较治疗前降低,且观察组低于对照组(P均<0.05)。见表1。
表1 两组各项中医证候积分比较(分,)
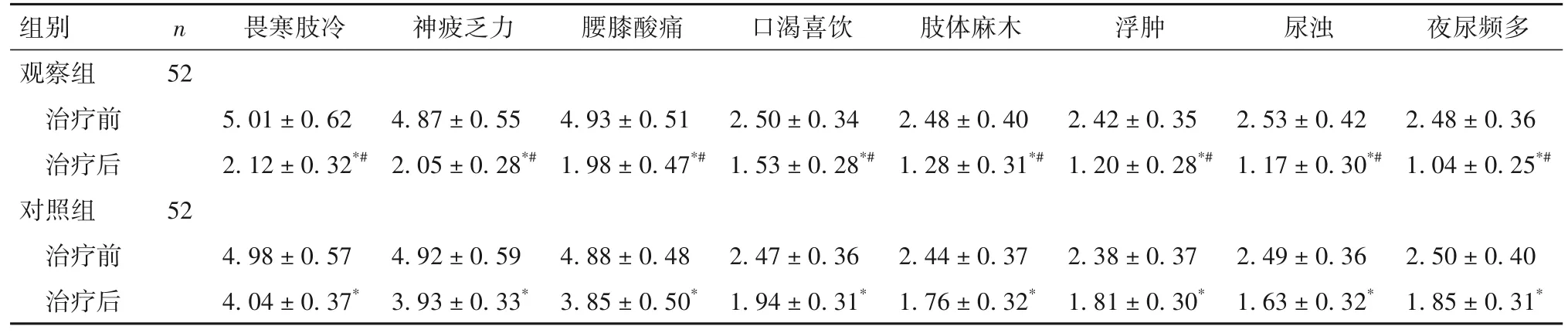
表1 两组各项中医证候积分比较(分,)
注:与同组治疗前相比,*P<0.05;与治疗后对照组相比,#P<0.05。
n 畏寒肢冷神疲乏力腰膝酸痛口渴喜饮肢体麻木浮肿尿浊夜尿频多组别观察组治疗前治疗后对照组治疗前治疗后52 5.01 ± 0.62 2.12 ± 0.32*#4.87 ± 0.55 2.05 ± 0.28*#4.93 ± 0.51 1.98 ± 0.47*#2.50 ± 0.34 1.53 ± 0.28*#2.48 ± 0.40 1.28 ± 0.31*#2.42 ± 0.35 1.20 ± 0.28*#2.53 ± 0.42 1.17 ± 0.30*#2.48 ± 0.36 1.04 ± 0.25*#52 4.98 ± 0.57 4.04 ± 0.37*4.92 ± 0.59 3.93 ± 0.33*4.88 ± 0.48 3.85 ± 0.50*2.47 ± 0.36 1.94 ± 0.31*2.44 ± 0.37 1.76 ± 0.32*2.38 ± 0.37 1.81 ± 0.30*2.49 ± 0.36 1.63 ± 0.32*2.50 ± 0.40 1.85 ± 0.31*
2.2 两组肾功能指标及肾脏血流动力学指标比较 两组治疗后UAER、尿β2-MG和血清Cr、BUN、CysC水平低于治疗前,eGFR高于治疗前(P均<0.05);观察组与对照组治疗后相比,P均<0.05。见表2。两组治疗后肾叶间动脉PSV、EDV高于治疗前,RI低于治疗前(P均<0.05);观察组与对照组治疗后相比,P均<0.05。见表3。
表2 两组肾功能相关指标比较()
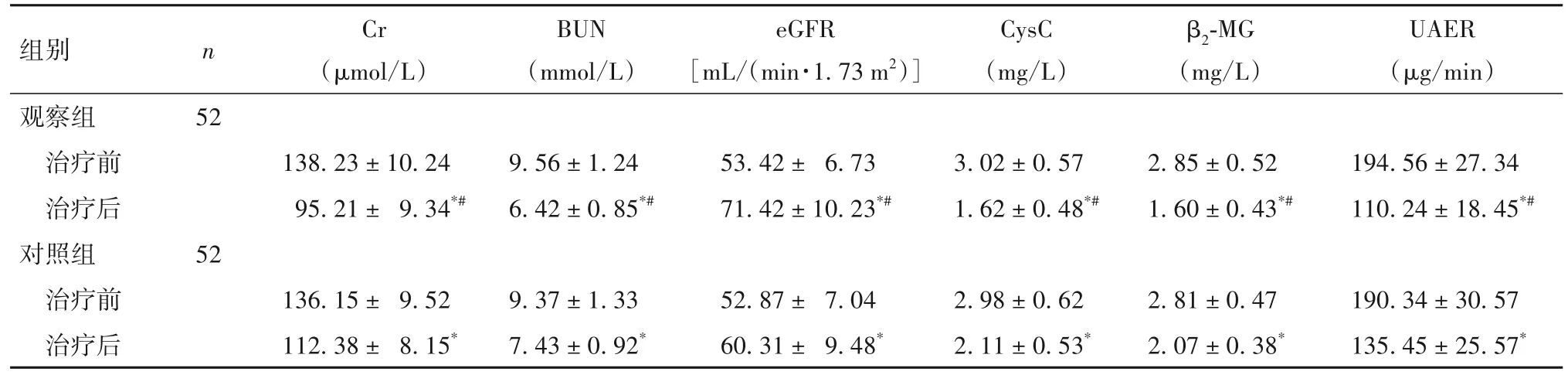
表2 两组肾功能相关指标比较()
注:与同组治疗前相比,*P<0.05;与治疗后对照组相比,#P<0.05。
n Cr(μmol/L)BUN(mmol/L)eGFR[mL/(min·1.73 m2)]CysC(mg/L)β2-MG(mg/L)UAER(μg/min)组别观察组治疗前治疗后对照组治疗前治疗后52 138.23 ± 10.24 95.21 ± 9.34*#9.56 ± 1.24 6.42 ± 0.85*#53.42 ± 6.73 71.42 ± 10.23*#3.02 ± 0.57 1.62 ± 0.48*#2.85 ± 0.52 1.60 ± 0.43*#194.56 ± 27.34 110.24 ± 18.45*#52 136.15 ± 9.52 112.38 ± 8.15*9.37 ± 1.33 7.43 ± 0.92*52.87 ± 7.04 60.31 ± 9.48*2.98 ± 0.62 2.11 ± 0.53*2.81 ± 0.47 2.07 ± 0.38*190.34 ± 30.57 135.45 ± 25.57*
表3 两组肾脏血流动力学指标及血清炎症相关指标、TGF-β1、SOD比较()
注:与同组治疗前相比,*P<0.05;与治疗后对照组相比,#P<0.05。
组别观察组治疗前治疗后对照组治疗前治疗后n PSV(cm/s)EDV(cm/s)RI CRP(mg/L)TNFR1(pg/mL)TGF-β1(ng/L)SOD(U/mL)NLR 52 27.34 ± 3.24 33.17 ± 3.65*#9.83 ± 1.18 12.76 ± 1.34*#0.67 ± 0.09 0.56 ± 0.07*#6.12 ± 0.76 3.24 ± 0.45*#2 345.82 ± 453.24 1 662.34 ± 386.45*#44.52 ± 5.82 20.23 ± 4.37*#66.38 ± 9.26 105.24 ± 11.31*#4.32 ± 0.48 2.26 ± 0.25*#52 4.41 ± 0.54 2.95 ± 0.38*26.85 ± 3.96 29.76 ± 3.23*9.79 ± 1.13 11.24 ± 1.56*0.64 ± 0.11 0.60 ± 0.08*6.08 ± 0.71 4.56 ± 0.56*2 297.56 ± 466.24 1 914.02 ± 412.18*43.76 ± 6.34 27.40 ± 4.82*65.14 ± 8.77 87.45 ± 12.02*
2.3 两组血清炎症相关指标、TGF-β1、SOD比较两组治疗后血清CRP、TNFR1、TGF-β1水平及NLR低于治疗前,血清SOD水平高于治疗前(P均<0.05);观察组与对照组治疗后相比,P均<0.05。见表3。
2.4 两组临床疗效比较 观察组显效25例、有效21例、无效6例,总有效率为88.46%;对照组分别为16、20、16例和69.23%。观察组总有效率高于对照组(P<0.05)。
2.5 两组用药安全性比较 两组治疗过程中血、尿、便常规及肝功能、腹部彩超、心电图检查等均未出现明显异常变化。观察组治疗期间出现头晕、恶心各2例,骨骼肌疼痛1例,不良反应发生率9.62%;对照组出现头晕2例,恶心、骨骼肌疼痛各1例,不良反应发生率7.69%。观察组与对照组不良反应发生率差异无统计学意义(P>0.05)。
3 讨论
DKD是导致糖尿病患者死亡的重要原因之一,其发病机制复杂,尚未完全清楚[12]。由于DKD早期缺乏典型症状,多数患者在临床确诊时病情已进展至Ⅲ ~ Ⅳ期。目前针对Ⅲ ~ Ⅳ期DKD仍缺乏特异性治疗方案,西医主要以降糖、降脂、降血压等综合治疗为主,但难以有效抑制肾损害进展,患者预后较差[13]。长期以来,中医药在DKD的治疗中积累了丰富的经验。DKD属中医“下消”“水肿”“虚劳”“关格”等范畴,为本虚标实之证,本虚尤以脾肾亏虚为主,标实以瘀血、痰湿、浊毒等为主。脾肾阳气不足,无力运化水湿,可致水肿;肾阳不足,无以藏精,可致尿浊;脾居中焦,脾气亏虚,可致尿浊;肾阳不足,温煦无权,可致小便清长;肾虚不能濡养腰府,可致腰膝酸软[14]。因此,温阳补肾、益气健脾、活血祛瘀是治疗DKD脾肾阳虚兼血瘀证的关键。
本研究采用多味中药组成的温脾补肾泄浊汤,以黄芪、山药、太子参、附子共为君药,旨在温阳补肾、益气健脾;白术、茯苓、当归、肉桂、丹参共为臣药,具有温阳利水、健脾利湿、活血祛瘀之功效;金樱子、芡实、山茱萸、五味子、酒大黄、生地、牛膝、泽兰、水蛭共为佐使,以补肾填精、益气健脾、补益肝肾、活血化瘀。黄芪可增加肾血流并利尿,改善血液循环,减轻血液高凝状态,保护肾小球基底膜;山茱萸、五味子可降低血糖,减轻氧化应激反应,可影响色氨酸、嘌呤及肠内菌代谢,减轻肾损伤;丹参可扩张外周血管,抑制血小板聚集,提高纤溶酶活性,改善血液动力学与微循环,增加肾组织灌注,抑制炎症因子释放,改善血管内皮功能;芡实保护足细胞;黄芪、水蛭可延缓肾小球纤维化进展[15-16]。
本研究中,观察组采用温脾补肾泄浊汤结合西医常规疗法治疗,临床疗效总有效率达88.46%,高于对照组的69.23%;且治疗后观察组各项中医症状积分均较对照组降低更明显。这提示在西医常规疗法基础上联合温脾补肾泄浊汤治疗能进一步促进DKD脾肾阳虚兼血瘀证患者中医症状的缓解,提高临床治疗效果。Cr、BUN是反映肾小球滤过功能的常用指标,但容易受到肾内肾外因素的影响。CysC是半胱氨酸蛋白酶抑制剂,在循环中其仅能通过肾小球滤过而被清除,是反映肾小球滤过功能的可靠内源性指标。既往认为,DKD病变主要位于肾小球,但近年来发现,DKD患者的肾小管损伤可能早于肾小球损伤[17]。β2-MG是一种单链多肽低分子蛋白质,可从肾小球自由滤过,几乎完全被近端肾小管重吸收,排出极少;而当肾小管重吸收功能出现障碍时,尿β2-MG水平可异常升高。本研究结果显示,两组治疗后UAER、尿β2-MG和血清Cr、BUN、CysC水平均较治疗前显著降低,eGFR均较治疗前显著升高,但观察组改善更明显。
研究表明,DKD早期会出现肾脏血流动力学异常,且参与DKD的发生发展[18]。肾小球高滤过和高灌注状态可引起蛋白尿。彩色多普勒超声是评价DKD患者肾脏血流动力学的可靠手段,DKD主要表现为PSV、EDV降低,RI升高。本研究中,两组治疗后肾叶间动脉PSV、EDV均较治疗前显著升高,RI显著降低,但观察组改善更明显。温脾补肾泄浊汤改善肾脏血流动力学的机制主要与扩张周围血管、缓解血管痉挛、改善血管内皮功能、提高肾脏等组织器官的血流灌注、改善肾脏微循环有关。
在DKD发生发展过程中,高血糖、胰岛素抵抗、脂代谢紊乱等多种病理过程均可激活炎症反应与氧化应激,导致肾血管内皮损伤,肾动脉阻力增大,肾组织血流灌注减少[19]。炎症细胞及炎症因子过表达及大量氧自由基生成可损伤肾组织血管,引发或加重DKD的肾脏损伤。糖尿病患者由于长期代谢紊乱,胰岛素细胞可分泌大量炎症因子,损伤微血管,并刺激肝细胞大量合成CRP,损伤肾功能。TNFR1可通过与TNF-α结合,活化多种细胞因子,引发炎症反应,诱导细胞凋亡。NLR能够反映炎症激活因子中性粒细胞与炎症调节因子淋巴细胞之间的平衡状态,是常见的炎症指标。本研究中,两组治疗后血清CRP、TNFR1水平及NLR均低于治疗前,SOD水平高于治疗前,均观察组变化更明显,提示温脾补肾泄浊汤有助于减轻DKD炎症反应。
TGF-β1升高可造成肾小球基底膜增厚与系膜增生,引发肾小球结构改变,导致ECM沉积。此外,TGF-β1还可促进肾小管上皮细胞转化为肌纤维细胞,引发或加重肾小球硬化与肾间质纤维化。本研究观察组治疗后血清TGF-β1水平低于对照组,提示温脾补肾泄浊汤结合西医常规疗法相较于单纯西医治疗能进一步减轻DKD患者肾小球硬化与肾间质纤维化,从而延缓肾功能恶化。两组治疗过程中均未出现与药物有关的严重不良反应,安全性较高。
结合以上研究结果,我们认为,温脾补肾泄浊汤联合西医常规疗法治疗脾肾阳虚血瘀型Ⅲ、Ⅳ期DKD效果明确,可降低血清炎症因子、TGF-β1、SOD水平,改善肾脏血流动力学和肾功能。
