急性胰腺炎小鼠胰腺和远隔脏器组织TRAF6、XIAP表达变化及其与细胞凋亡的关系
2023-12-01谭贞菊周翔宇陈霞
谭贞菊,周翔宇,陈霞,3
1 西南医科大学附属医院消化内科,四川泸州646000;2 西南医科大学附属医院甲状腺血管外科;3 成都医学院第一附属医院消化内科
急性胰腺炎(AP)是由多种原因引起的胰腺炎症性疾病,可表现为自限性,也可发展至多器官功能衰竭[1]。AP患者合并器官功能衰竭与胰腺坏死程度有关,坏死性胰腺炎患者的器官功能障碍严重程度与病死率呈正相关[2]。AP并发多脏器功能障碍的发病机制涉及过度炎症反应、缺血再灌注损伤、肠道细菌易位和细胞凋亡等[3]。细胞凋亡在AP发病机制中的作用也备受关注。有报道指出,细胞凋亡在急性重症胰腺炎(SAP)的发生和进展中起重要作用,是SAP多器官功能障碍和感染性并发症的重要影响因素[4]。凋亡基因的激活是AP中细胞凋亡的机制之一。此外,抗凋亡基因也可能同时被激活,这使得在AP状态下,胰腺腺泡细胞凋亡调节更为复杂[5]。既往研究已经证实了细胞凋亡在AP多器官功能障碍中的作用,但对于不同严重程度AP细胞凋亡是否存在差异研究较少。肿瘤坏死因子受体相关因子6(TRAF6)是TRAF家族成员,通过多种信号通路参与多种急性炎症性疾病[6-7]。已有研究表明,TRAF6在多种细胞凋亡介导的相关炎症过程中也发挥着关键作用[8]。凋亡抑制蛋白(IAP)是一种结构相关的蛋白质家族,可负向调节Caspase激活。X连锁凋亡抑制蛋白(XIAP)是八种哺乳动物IAP中最有效的一种,其通过抑制Caspase-3、7、9激活来阻止细胞发生凋亡。急性水肿性胰腺炎(AEP)和急性坏死性胰腺炎(ANP)主要区别在于胰腺损伤的严重程度不同,AEP可导致胰腺组织肿胀、水肿,疾病常呈自限性,预后良好;ANP是胰腺组织出现出血、坏死等损伤性改变,临床病情较重,治疗难度大,死亡风险高。AEP是ANP疾病进展过程的前期阶段,因此早期控制病情极其重要。2019年3月—2023年4月,本研究构建了AEP、ANP小鼠模型,观察胰腺和远隔脏器(包括肠、肺、肝、肾)组织中TRAF6和XIAP表达变化,并分析其与多脏器细胞凋亡的关系。现报告如下。
1 材料与方法
1.1 实验动物与主要材料 雄性C57BL/10SnJ小鼠30只,4 ~ 6周龄,体质量20 ~ 25 g,在西南医科大学实验动物中心室内饲养。饲养环境温度23 ℃,12 h∶12 h光/暗循环,食水不限。本研究经西南医科大学动物保护伦理委员会批准。雨蛙素购自MCE公司,脂多糖购自Sigma公司,总RNA纯化提取试剂盒、反转录试剂盒、RT-qPCR试剂盒购自中国YEASEN公司,BCA蛋白浓度测定试剂盒购自中国碧云天公司,Caspase-3/cleaved Caspase-3、XIAP、TRAF6抗体购自cell signaling Technology公司。
1.2 动物分组及AP模型构建 将30只小鼠随机分为对照组、AEP组、ANP组,每组10只。造模前禁食禁水12 h,AEP组注射雨蛙素50 μg/kg,每小时一次,连续10 h。ANP组注射雨蛙素50 μg/kg,每小时一次,连续13 h,最后一次注射后追加注射一次脂多糖15 mg/kg。对照组注射同等体积的磷酸盐缓冲盐水(PBS)。造模后12 h,采用颈椎脱位法处死小鼠,取出组织标本。取AEP组和ANP组胰腺组织,HE染色,镜下观察到小鼠胰腺腺体明显增大、腺泡空泡化、炎症细胞浸润、明显的间质水肿伴小叶间隔扩张;AEP组胰腺HE染色显示小叶排列紊乱,小叶边缘区腺泡细胞坏死;ANP组胰腺出现点状、局灶性坏死,解剖时可见腹腔内有少量血性渗出物。上述病理检查结果判定为造模成功。
1.3 小鼠胰腺和远隔脏器组织中TRAF6、XIAP mRNA及蛋白检测
1.3.1 TRAF6、XIAP mRNA检测 每只小鼠收集50 ~ 80 mg新鲜胰腺组织,用TRIzol提取总RNA。将RNA进行逆转录,并对互补DNA进行RT-qPCR检测。TRAF6基因上游引物序列为5′-GCCGAAATGGAAGCACAG-3′,下游引物序列为5′-CAGGGCTATGGATGACAACA-3′;XIAP基因上游引物序列为5′-GTGAAGAAGCCAGATTGAA-3′,下游引物序列为5′-TGTTCTGACCAGGCACGAT-3′;β-actin上游引物序列为5′-CGTGAAAAGATGACCCAGAT-3′,下游引物序列为5′-ACCCTCATAGATGGGCACA-3′。所有样本每次实验设置3个复孔,取均值。以β-actin为内参,以2-ΔΔCt表示目的基因相对表达量。
1.3.2 TRAF6、XIAP蛋白检测 采用Western blotting法。将各组小鼠新鲜的胰腺、肠、肝、肺、肾组织,用RIPA裂解缓冲冰上裂解30 min,4 ℃ 12 000 r/min离心15 min,提取组织总蛋白。取50 μg总蛋白加样于凝胶中,80 V电泳30 min,120 V电泳1 h,然后转移至PVDF膜。使用5% BSA室温封闭PVDF膜1.5 h,TBST洗膜3次,每次10 min,加入TRAF6、XIAP一抗,4 ℃孵育过夜。TBST洗膜后,在室温下将膜用二抗孵育1 h。TBST洗膜3次,每次10 min。用蛋白质印迹专用试剂显色成像。以β-actin为内参。使用ECL Plus化学发光系统进行显影,Image J软件分析条带灰度值,计算目的蛋白相对表达量。实验重复3次,取均值。
1.4 小鼠胰腺和远隔脏器组织细胞凋亡率测算及凋亡蛋白检测 将各组小鼠的胰腺、肠、肝、肺、肾组织切片脱蜡,水化,蛋白酶工作液37 ℃孵育30 min,将载玻片置于含有200 mL的0.1 mol/L柠檬酸缓冲液的塑料瓶中,用350 W微波辐照5 min。载玻片用PBS冲洗两次,与末端脱氧核苷酸转移酶和核苷酸混合物在潮湿盒子中孵育60 min,阴性对照只添加50 μL标记溶液。孵育后PBS冲洗3次。加入50 μL过氧化物酶孵育30 min,滴加DAB工作液室温显色10 min。PBS漂洗切片3次,用苏木精染色,脱水,密封,显微镜下拍照。凋亡细胞胞核呈棕色。每项检测都设置阴性对照。显微镜拍照后用Image J软件统计阳性细胞占比。细胞凋亡率=凋亡细胞数/每个视野总细胞数×100%。采用Western blotting法检测各组小鼠的胰腺、肠、肝、肺、肾组织中的cleaved Caspase-3蛋白,方法参考“1.3.2”。
1.5 统计学方法 采用SPSS25.0统计软件。计量资料以表示,多组比较采用单因素方差分析,两组比较采用t检验。相关性分析采用Pearson相关分析法。P<0.05为差异有统计学意义。
2 结果
2.1 各组胰腺和远隔脏器组织中TRAF6、XIAP mRNA及蛋白表达比较 ANP组、AEP组、对照组胰腺组织中TRAF6 mRNA相对表达量分别为1.54 ±0.06、1.23 ± 0.10、0.94 ± 0.08,XIAP mRNA相对表达量分别为1.29 ± 0.06、0.56 ± 0.07、0.97 ± 0.07。AEP组胰腺组织中XIAP mRNA表达低于ANP组(P<0.05)。ANP组胰腺、肺组织中TRAF6蛋白表达与对照组差异有统计学意义,ANP组各组织中XIAP蛋白表达高于对照组(P均<0.05);AEP组各组织中TRAF6蛋白表达高于对照组,AEP组胰腺、肺、肾组织中XIAP蛋白表达高于对照组(P均<0.05)。AEP组胰腺、肠、肝、肺、肾组织中TRAF6蛋白表达高于ANP组,XIAP蛋白表达低于ANP组(P均<0.05)。见表1。
表1 各组胰腺和远隔脏器组织中TRAF6、XIAP蛋白表达比较()
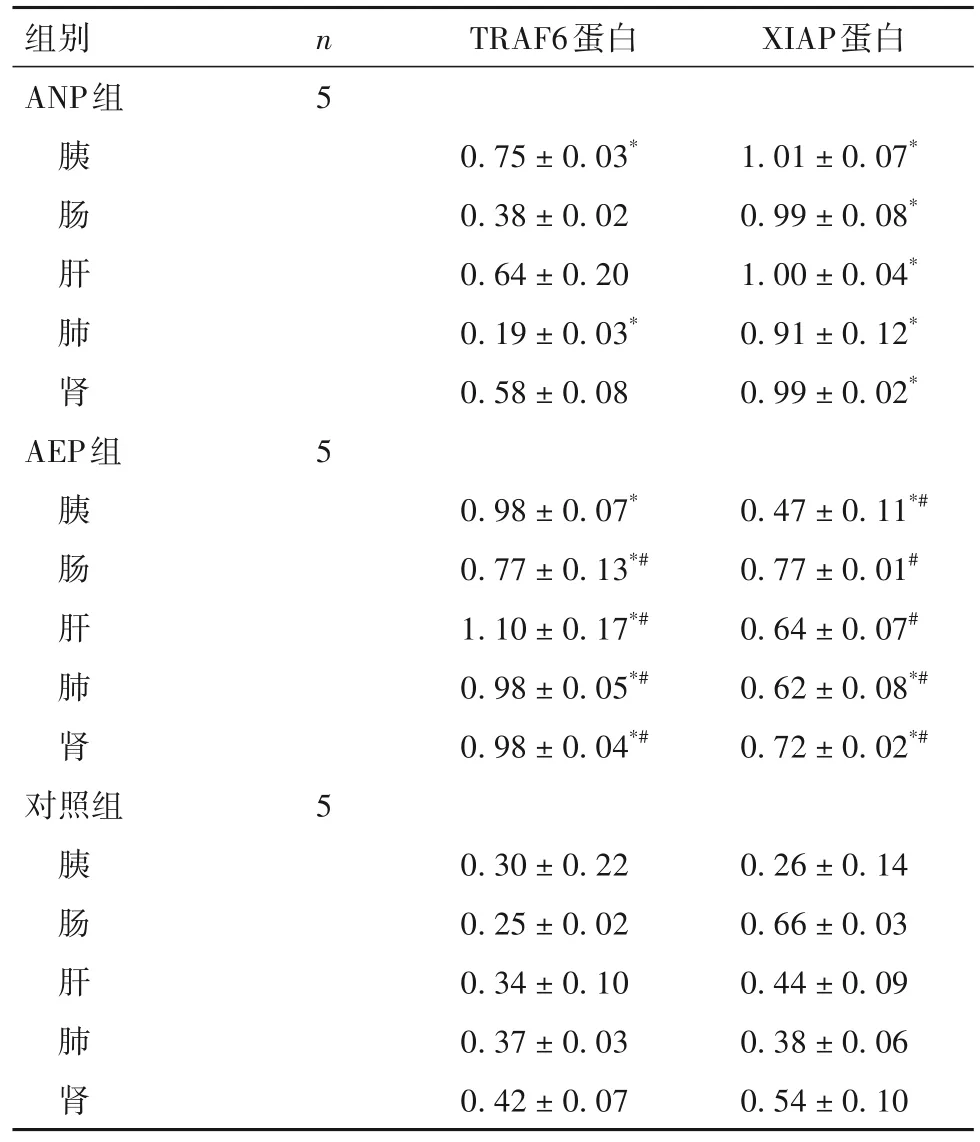
表1 各组胰腺和远隔脏器组织中TRAF6、XIAP蛋白表达比较()
注:与对照组相比,*P<0.05;与ANP组相比,#P<0.05。
组别ANP组胰肠肝肺肾AEP组胰肠肝肺肾对照组胰肠肝肺肾n5 TRAF6蛋白XIAP蛋白0.75 ± 0.03*0.38 ± 0.02 0.64 ± 0.20 0.19 ± 0.03*0.58 ± 0.08 1.01 ± 0.07*0.99 ± 0.08*1.00 ± 0.04*0.91 ± 0.12*0.99 ± 0.02*5 0.98 ± 0.07*0.77 ± 0.13*#1.10 ± 0.17*#0.98 ± 0.05*#0.98 ± 0.04*#0.47 ± 0.11*#0.77 ± 0.01#0.64 ± 0.07#0.62 ± 0.08*#0.72 ± 0.02*#5 0.26 ± 0.14 0.66 ± 0.03 0.44 ± 0.09 0.38 ± 0.06 0.54 ± 0.10 0.30 ± 0.22 0.25 ± 0.02 0.34 ± 0.10 0.37 ± 0.03 0.42 ± 0.07
2.2 各组胰腺和远隔脏器组织细胞凋亡率及凋亡蛋白表达比较 对照组胰腺及远隔脏器组织中凋亡细胞较少,AEP组和ANP组凋亡细胞均增加,AEP组凋亡细胞较ANP组明显增多(图1)。AEP组胰腺、肠、肝、肺、肾组织细胞凋亡率均大于ANP组,AEP组和ANP组胰腺、肠、肝、肺、肾组织细胞凋亡率大于对照组,AEP组胰腺、肠、肝、肺、肾组织中cleaved Caspase-3表达高于ANP组和对照组,ANP组肠、肺、肾组织中cleaved Caspase-3表达高于对照组(P均<0.05)。见表2。
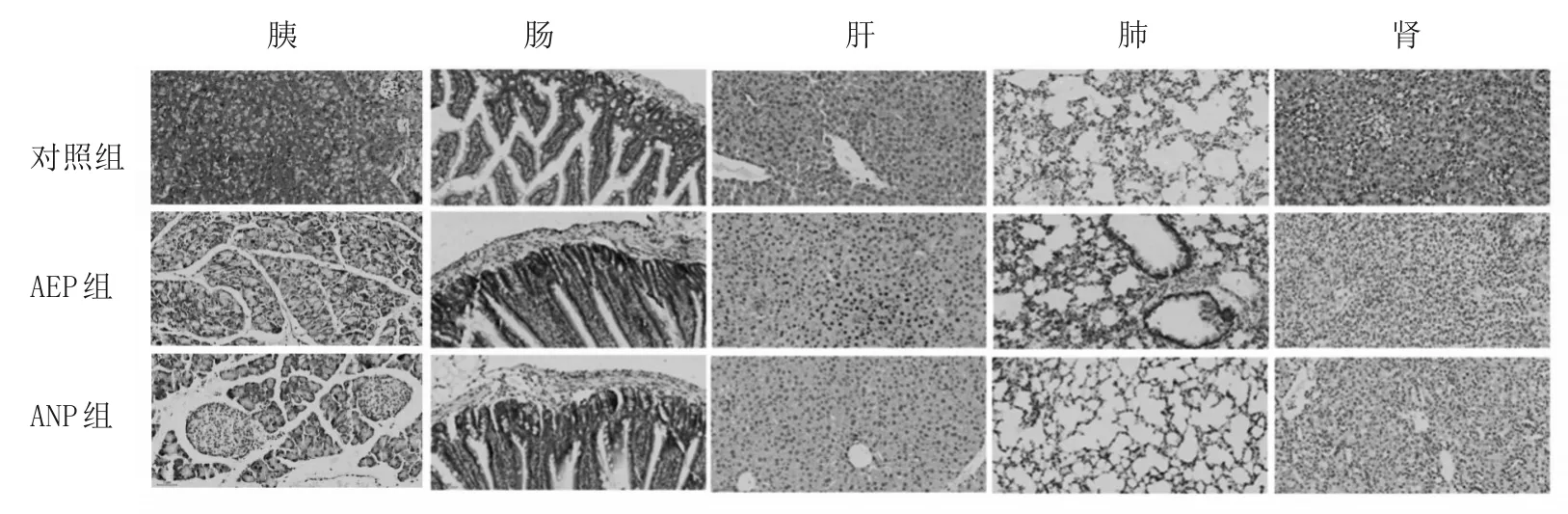
图1 各组胰腺、肠、肝、肺、肾组织细胞凋亡情况(DAB染色,×200)
表2 各组胰腺及远隔脏器细胞凋亡率、cleaved Caspase-3蛋白表达比较()
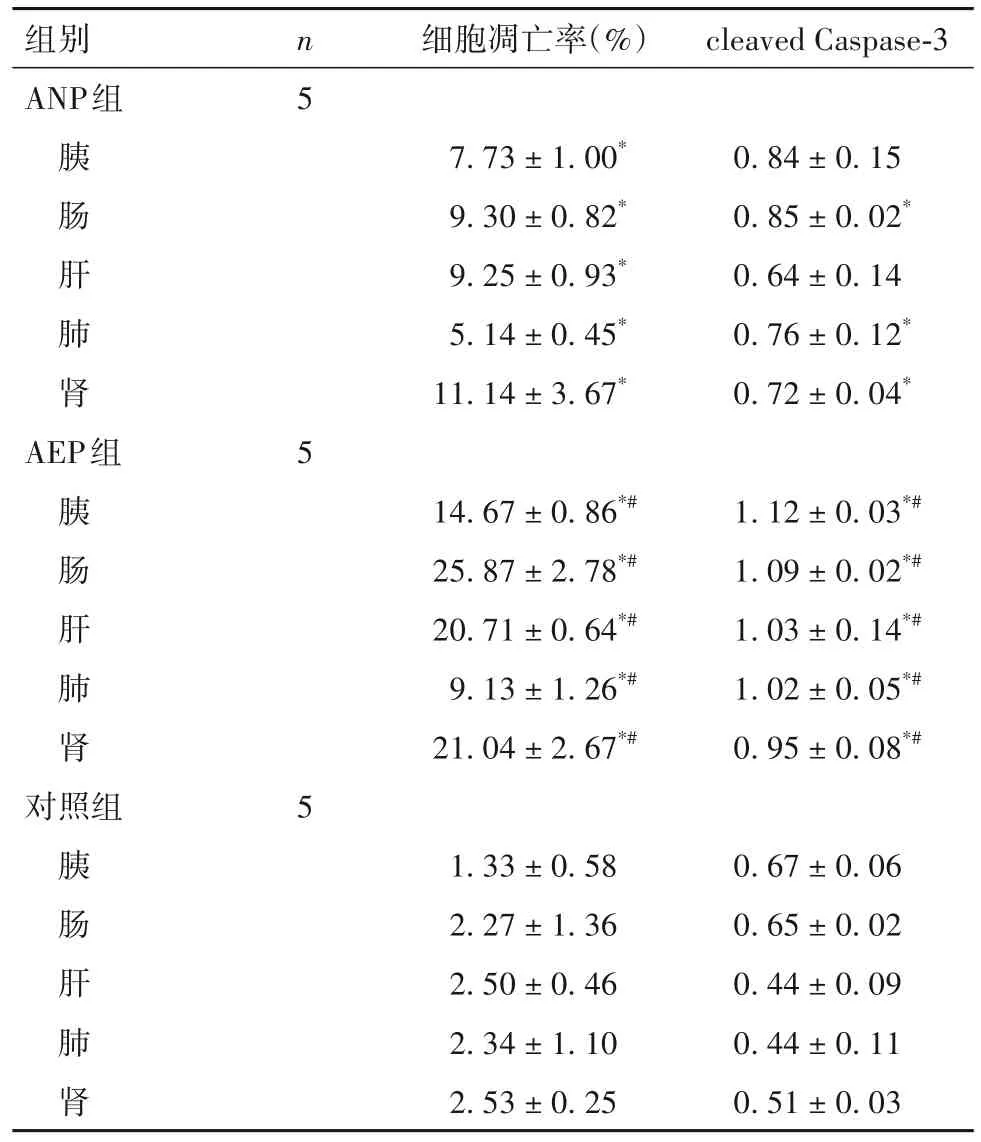
表2 各组胰腺及远隔脏器细胞凋亡率、cleaved Caspase-3蛋白表达比较()
注:与对照组相比,*P<0.05;与ANP组相比,#P<0.05。
组别ANP组胰肠肝肺肾AEP组胰肠肝肺肾对照组胰肠肝肺肾n5细胞凋亡率(%)cleaved Caspase-3 7.73 ± 1.00*9.30 ± 0.82*9.25 ± 0.93*5.14 ± 0.45*11.14 ± 3.67*0.84 ± 0.15 0.85 ± 0.02*0.64 ± 0.14 0.76 ± 0.12*0.72 ± 0.04*5 14.67 ± 0.86*#25.87 ± 2.78*#20.71 ± 0.64*#9.13 ± 1.26*#21.04 ± 2.67*#1.12 ± 0.03*#1.09 ± 0.02*#1.03 ± 0.14*#1.02 ± 0.05*#0.95 ± 0.08*#5 0.67 ± 0.06 0.65 ± 0.02 0.44 ± 0.09 0.44 ± 0.11 0.51 ± 0.03 1.33 ± 0.58 2.27 ± 1.36 2.50 ± 0.46 2.34 ± 1.10 2.53 ± 0.25
2.3 胰腺炎小鼠胰腺和远隔脏器组织组织中凋亡指标与TRAF6、XIAP表达的相关性 胰腺炎小鼠胰腺、肠、肝组织细胞凋亡率与TRAF6蛋白表达呈正相关(r分别为0.934、0.770、0.834),胰腺、肠、肝、肺组织细胞凋亡率与XIAP蛋白表达呈负相关(r分别为-0.928、-0.846、-0.973、-0.681);胰腺炎小鼠胰腺、肠、肝、肺组织中cleaved Caspase-3蛋白与TRAF6蛋白表达呈正相关(r分别为0.797、0.973、0.478、0.441),胰腺、肝、肺组织cleaved Caspase-3蛋白表达与XIAP蛋白表达呈负相关(r分别为-0.798、-0.842、-0.846),P均<0.05。
3 讨论
AP严重程度的调控机制目前尚未完全阐明。现有研究表明,AP状态下细胞凋亡与多器官功能损伤的发生有关[9]。本研究结果显示,随着AP病理改变的加重,多器官组织细胞凋亡的程度也有所不同。在肠、肝、肺、肾等胰腺远隔脏器均可见细胞凋亡,且AEP组细胞凋亡较ANP组更明显。然而,细胞凋亡在AEP向ANP进展中的作用及详细机制仍有待进一步研究。与远隔脏器的细胞凋亡情况类似,胰腺组织细胞凋亡与AP的严重程度也有关。在以往实验研究的重症胰腺炎动物模型中,器官组织以坏死为主,凋亡较少,而轻度胰腺炎模型坏死较轻,但凋亡程度较高[10]。已有证据表明,胰腺腺泡细胞凋亡被认为是一种保护性反应,可以减轻AP的严重程度[9]。由此推测,胰腺腺泡细胞凋亡可能有助于控制AP重症的发生发展。
细胞凋亡是一种复杂的生物学现象,它受各种调控途径的诱导,同时也受多种调控基因的影响。有许多细胞因子与细胞凋亡有关。目前普遍认为,细胞凋亡的共同途径是Caspase的激活。Caspase-3是细胞凋亡的关键执行者,是细胞凋亡信号转导过程中的核心环节。当细胞接收到凋亡信号时,胞质内的Caspase-3激活被剪切为cleaved Caspase-3活性状态,cleaved Caspase-3继续活化其下游底物如PARP、Caspase-6等,从而发挥促进凋亡的作用,因此测定cleaved Caspase-3可以反映细胞凋亡水平[11]。AP状态下一些致病因素诱导Caspase-3激活可能是胰腺细胞凋亡的机制之一。本研究结果显示,AEP组胰腺、肠、肝、肺、肾组织中cleaved Caspase-3蛋白表达高于ANP组,这种表达趋势与细胞凋亡结果相一致。
TRAF6是一种E3泛素连接酶,是肿瘤坏死因子(TNF)超家族和toll样/白细胞介素(IL)-1受体超家族的关键适配器分子。TRAF6可介导多种信号通路,激动或抑制TRAF6表达有望实现对多种相关疾病的治疗目的[12]。除了在免疫调节和肿瘤发病中的作用外,TRAF6在多种细胞凋亡介导的炎症过程中发挥着关键作用[8]。TRAF6对细胞凋亡的抑制或促进作用取决于器官和炎症刺激的类型。有研究报道,TRAF6可促进卡介苗诱导的巨噬细胞凋亡[13]。抑制或竞争性结合TRAF6可促进胶质瘤细胞、内皮细胞、人乳腺癌细胞的凋亡[14-15]。本研究结果显示,TRAF6 mRNA在AEP和ANP小鼠中的表达均被激活。但既往有研究表明,TRAF6不是在转录水平上发挥作用,而是在翻译后的蛋白水平进行对凋亡的调控[16]。也有关于AP的研究提示,TRAF6通过调节腺泡细胞凋亡在雨蛙素诱导的轻度AP中发挥胰腺保护作用[16]。这一研究结论与本研究结果类似,AEP组胰腺、肠、肝、肺、肾组织中的TRAF6蛋白表达高于ANP组,且AEP组胰腺和远隔脏器组织细胞凋亡率及cleaved Caspase-3表达高于ANP组,cleaved Caspase-3表达与TRAF6蛋白表达呈正相关,提示TRAF6蛋白可能通过诱导细胞凋亡在轻度AP进程中发挥保护胰腺的作用。
凋亡调控基因XIAP是一种E3泛素连接酶,是IAP家族中最强的凋亡抑制因子。XIAP能通过抑制Caspase和其他方式调节细胞凋亡。当抑制Caspase-3和Caspase-7活性时,XIAP的BIR2结构域与活性位点底物沟槽结合,阻断正常蛋白进入,从而阻断细胞凋亡进程。有报道显示,胰腺炎状态下,XIAP是关键的Caspase调节因子,抑制XIAP可使胰腺淀粉酶水平和NF-κB活性降低,TNF-α和IL-6释放减少,Caspases活性增加,胰腺腺泡细胞凋亡增强,坏死减少[17]。在雨蛙素诱导的大鼠胰腺炎模型中,降解XIAP可促进Caspase激活,XIAP表达与胰腺细胞凋亡及Caspase-3、7、9表达呈负相关[18],这一结论与本研究结果一致。本研究中,与ANP组相比,AEP组胰腺及肠、肝、肺、肾等远隔脏器中XIAP蛋白表达明显下调,导致XIAP对胰腺及远隔脏器细胞凋亡的抑制作用减弱,从而引起AEP组胰腺及远隔脏器组织细胞凋亡率和cleaved Caspase-3表达上调,因此XIAP在AP中可能通过抑制胰腺及远隔脏器组织细胞的凋亡,从而影响胰腺炎的病情。
综上所述,AP小鼠胰腺和远隔脏器组织中TRAF6、XIAP表达异常,且与细胞凋亡指标存在相关性;RAF6、XIAP在AEP与ANP中的表达趋势有所差异。在AP状态下,TRAF6和XIAP对细胞凋亡具有调控作用,导致不同严重程度AP胰腺及远隔脏器组织细胞凋亡的差异,同时这种细胞凋亡差异可能影响AP的严重程度。进一步研究AP发生发展过程中RAF6、XIAP对细胞凋亡的调控作用,有望为AP治疗提供新的方向。
