二甲双胍对肺泡上皮细胞氧化损伤的抑制作用及其机制
2023-12-01李鹏欧阳运萍陈涛赵博杨小军
李鹏,欧阳运萍,陈涛,赵博,杨小军
1 唐山职业技术学院附属医院急诊科,河北唐山063000;2 唐山职业技术学院附属医院消化内科;3 唐山职业技术学院附属医院重症医学科
急性肺损伤为严重的呼吸系统疾病,威胁生命。研究表明,活化转录因子3(STAT3)、核转录因子-κB(NF-κB)信号通路参与调控急性肺损伤的发生发展,能够由促炎因子触发,参与细胞增殖、凋亡、炎症反应等病理生理过程[1-2]。因此,对急性肺损伤的发病机制进行研究并开发新的有效治疗药物具有重要意义[3-4]。目前临床一般使用糖皮质激素与其他抗炎药物辅助呼吸支持治疗急性肺损伤,虽然有一定疗效,但急性肺损伤患者的生活质量及病死率仍旧无法得到较好改善。张楚怡[5]研究显示,NF-κB信号通路与Ⅱ型肺泡上皮细胞的上皮—间质转化(EMT)进程密切相关。有研究表明,二甲双胍能够通过NF-κB信号通路抑制肿瘤细胞生长[6]。Ⅱ型肺泡上皮细胞较难分离获取且难以在体外传代,是氧化损伤的主要靶点[7]。有学者利用过氧化氢(H2O2)构建体外急性肺损伤细胞模型,发现姜黄素对H2O2诱导的A549细胞氧化损伤有治疗作用[8]。人肺泡上皮细胞A549与Ⅱ型肺泡上皮细胞形态及生化特性相似,因此,2021年6月—2022年12月,本研究以A549细胞为研究对象,观察二甲双胍对H2O2诱导的A549细胞氧化损伤的抑制作用,并基于EMT及NF-κB信号通路调控探讨相关机制。现报告如下。
1 材料与方法
1.1 细胞与主要实验材料 人肺泡上皮细胞A549购自武汉益普生物科技有限公司。二甲双胍、H2O2、NF-κB通路抑制剂BAY 11-7082、NF-κB通路激活剂Prostratin购自上海源叶生物科技有限公司,F-12K培养基、胎牛血清购自北京索莱宝生物科技有限公司,CCK-8购自南京诺唯赞有限公司,ELISA检测试剂盒购自上海恒远生物科技有限公司,一抗[鼠抗人NF-κB p65、p-NF-κB p65、E-钙黏蛋白、N-钙黏蛋白、波形蛋白、纤维黏连蛋白(FN)及内参蛋白(β-actin)]、辣根过氧化物酶标记的二抗(山羊抗鼠IgG)购自上海翌圣生物科技股份有限公司。BZ-X倒置荧光显微镜购自中国基恩士有限公司,VS-840-1型层流超净工作台购自上海博迅实业有限公司,3H16RI型智能高速冷冻离心机购自湖南赫西仪器装备有限公司,Victor X3型全自动酶标仪购自美国Perkin Elmer公司。
1.2 细胞分组处理及二甲双胍作用浓度筛选 将冻存的A549细胞于-80 ℃超低温冰箱中取出并进行复苏,加入F-12K培养基(含10%胎牛血清、1%青—链霉素)于37 ℃、5% CO2环境培养,待细胞贴壁(80% ~ 90%)后传代,取第3代(对数生长期细胞)进行实验。将细胞分为对照组、模型组、二甲双胍组、BAY 11-7082组、抑制剂组、激活剂组。对照组不给予药物干预,模型组、二甲双胍组、BAY 11-7082组、抑制剂组、激活剂组给予400 μmol/L H2O2刺激24 h构建体外急性肺损伤细胞模型;二甲双胍组在此基础上分为三个浓度亚组,分别给予2.5、5、10 mmol/L的二甲双胍;BAY 11-7082组加入5 mmol/L的BAY 11-7082。采用CCK-8试剂盒检测细胞活力,对照组、模型组、BAY 11-7082组及2.5、5、10 mmol/L二甲双胍组细胞活力分别为0.97 ± 0.09、0.40 ±0.04、0.83 ± 0.06、0.47 ± 0.03、0.71 ± 0.04、0.76 ±0.05,模型组细胞活力低于对照组,5、10 mmol/L二甲双胍组细胞活力高于模型组(P均<0.05),选择5 mmol/L为二甲双胍最佳作用浓度。抑制剂组、激活剂组造模后给予5 mmol/L二甲双胍,并分别加入5 μmol/L的BAY 11-7082和1 μmol/L的Prostratin。后置培养箱(37 ℃、5% CO2)培养细胞,各组均干预24 h。
1.3 细胞形态和生长观察 取各组细胞,倒置显微镜下观察细胞形态并拍照记录。
1.4 细胞迁移率测算 取各组细胞接种于6孔板,细胞密度达90%后用移液器枪头(200 μL)划痕,后置培养箱(于37 ℃,5% CO2)培养24 h。显微镜下拍照记录0 h(S0)和24 h(S24)划痕情况。Image J软件分析迁移面积。细胞迁移率=(S0迁移面积-S24迁移面积)/S0迁移面积×100%。
1.5 细胞培养液上清丙二醛(MDA)、超氧化物岐化酶(SOD)检测 采用ELISA法检测各组细胞培养液上清中的MDA、SOD,按试剂盒说明书操作。
1.6 细胞中EMT及NF-κB信号通路相关蛋白检测 收集各组细胞,提取总蛋白定量后上样,电泳后转膜,封闭2 h。加入稀释一抗(NF-κB p65、p-NF-κB p65、E-钙黏蛋白、N-钙黏蛋白、波形蛋白、FN及β-actin)4 ℃孵育过夜后TBST洗涤,加入二抗(山羊抗鼠IgG)孵育2 h,洗涤3次,凝胶成像系统显影后拍照记录。Image J软件分析蛋白灰度值,以目的蛋白灰度值与β-actin灰度值的比值表示目的蛋白相对表达量。
1.7 统计学方法 采用SPSS26.0软件。符合正态分布的计量资料以表示,多组比较采用单因素方差分析,两两比较采用Dunnett′st检验;不符合正态分布的计量资料以M(P25,P75)表示,采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞形态及生长情况比较 干预24 h后,对照组和抑制剂组细胞生长良好,具有较强的贴壁能力,细胞数量较多且形状为正常生长状态,碎片较少;二甲双胍组和BAY 11-7082组细胞生长状态次之;模型组和激活剂组细胞生长受抑制最明显,细胞数量最少,贴壁能力最弱,细胞形状不规则且细胞碎片增多。见图1。
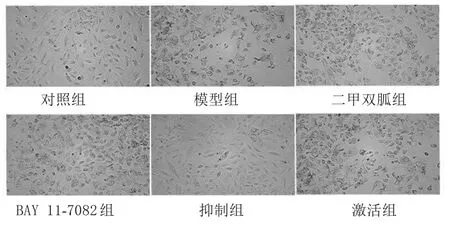
图1 各组细胞形态
2.2 各组细胞培养液上清中MDA、SOD水平比较与对照组相比,模型组细胞培养液上清MDA水平升高、SOD水平降低(P均<0.05)。与模型组相比,二甲双胍组和BAY 11-7082组MDA水平降低、SOD水平升高(P均<0.05)。与二甲双胍组相比,抑制剂组MDA水平降低、SOD水平升高,激活剂组MDA水平升高、SOD水平降低(P均<0.05)。见表1。
表1 各组细胞培养液上清中MDA、SOD水平比较()
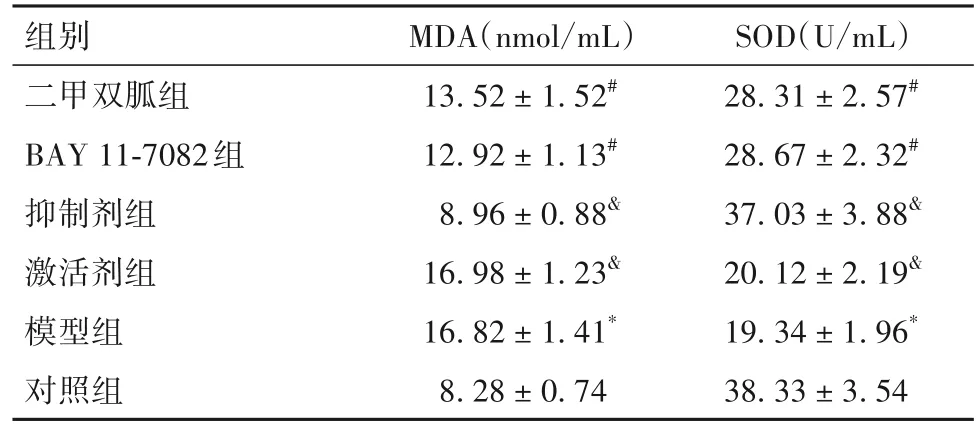
表1 各组细胞培养液上清中MDA、SOD水平比较()
注:与对照组相比,*P<0.05;与模型组相比,#P<0.05,与二甲双胍组相比,&P<0.05。
SOD(U/mL)28.31 ± 2.57#28.67 ± 2.32#37.03 ± 3.88&20.12 ± 2.19&19.34 ± 1.96*38.33 ± 3.54组别二甲双胍组BAY 11-7082组抑制剂组激活剂组模型组对照组MDA(nmol/mL)13.52 ± 1.52#12.92 ± 1.13#8.96 ± 0.88&16.98 ± 1.23&16.82 ± 1.41*8.28 ± 0.74
2.3 各组细胞迁移能力比较 对照组、模型组、二甲双胍组、BAY 11-7082组、抑制剂组、激活剂组细胞迁移率分别为5.73% ± 0.48%、7.02% ± 2.32%、20.83% ± 1.79%、20.14% ± 1.73%、6.29% ±0.43%、34.51% ± 2.39%。与对照组相比,模型组细胞迁移率显著升高(P<0.05)。与模型组相比,二甲双胍组和BAY 11-7082组细胞迁移率降低(P均<0.05);与二甲双胍组相比,抑制剂组细胞迁移率下降,激活剂组细胞迁移率增高(P均<0.05)。见图2。

图2 各组细胞迁移情况(×4)
2.4 各组细胞EMT相关蛋白表达比较 模型组E-钙黏蛋白表达低于对照组,N-钙黏蛋白、波形蛋白及FN表达高于对照组(P均<0.05)。二甲双胍组、BAY 11-7082组E-钙黏蛋白表达高于模型组,N-钙黏蛋白、波形蛋白及FN表达低于模型组(P均<0.05)。与二甲双胍组相比,抑制剂组E-钙黏蛋白表达升高,N-钙黏蛋白、波形蛋白及FN表达降低;激活剂组E-钙黏蛋白表达下降,N-钙黏蛋白、波形蛋白及FN表达增加(P均<0.05)。见表2。
表2 各组细胞EMT相关蛋白表达比较()
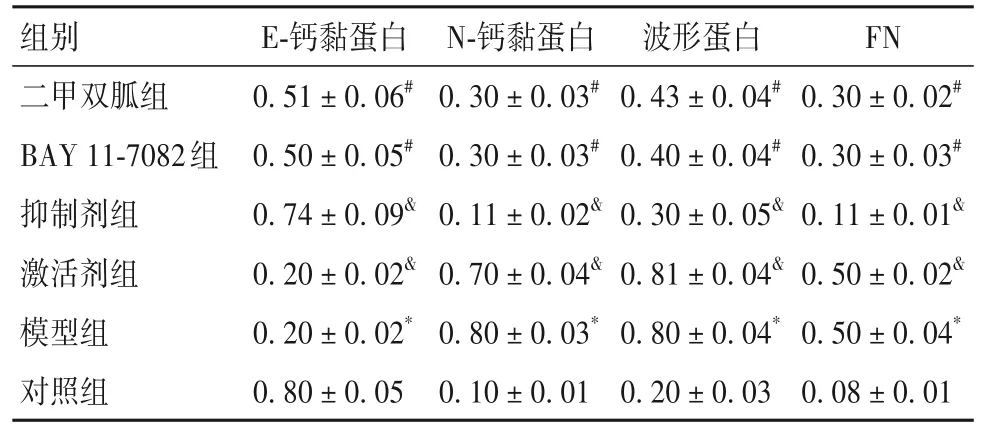
表2 各组细胞EMT相关蛋白表达比较()
注:与对照组相比,*P<0.05;与模型组相比,#P<0.05,与二甲双胍组相比,&P<0.05。
FN 0.30 ± 0.02#0.30 ± 0.03#0.11 ± 0.01&0.50 ± 0.02&0.50 ± 0.04*0.08 ± 0.01组别二甲双胍组BAY 11-7082组抑制剂组激活剂组模型组对照组E-钙黏蛋白0.51 ± 0.06#0.50 ± 0.05#0.74 ± 0.09&0.20 ± 0.02&0.20 ± 0.02*0.80 ± 0.05 N-钙黏蛋白0.30 ± 0.03#0.30 ± 0.03#0.11 ± 0.02&0.70 ± 0.04&0.80 ± 0.03*0.10 ± 0.01波形蛋白0.43 ± 0.04#0.40 ± 0.04#0.30 ± 0.05&0.81 ± 0.04&0.80 ± 0.04*0.20 ± 0.03
2.5 各组细胞NF-κB信号通路相关蛋白表达比较 模型组p-NF-κB p65蛋白表达高于对照组(P<0.05)。二甲双胍组和BAY 11-7082组p-NF-κB蛋白表达低于模型组(P均<0.05)。抑制剂组p-NF-κB p65蛋白表达低于二甲双胍组,激活剂组p-NF-κB p65蛋白表达高于二甲双胍组(P均<0.05)。见表3。
表3 各组细胞NF-κB信号通路相关蛋白表达比较()

表3 各组细胞NF-κB信号通路相关蛋白表达比较()
注:与对照组相比,*P<0.05;与模型组相比,#P<0.05,与二甲双胍组相比,&P<0.05。
p-NF-κB p65 0.21 ± 0.02#0.20 ± 0.03#0.10 ± 0.02&0.40 ± 0.02&0.42 ± 0.02*0.10 ± 0.01组别二甲双胍组BAY 11-7082组抑制剂组激活剂组模型组对照组NF-κB p65 0.11 ± 0.02 0.10 ± 0.01#0.11 ± 0.01 0.10 ± 0.02 0.10 ± 0.02 0.10 ± 0.01
3 讨论
急性肺损伤作为呼吸系统常见疾病,病理特征多表现为肺泡水肿和肺间质损害,可由创伤、烧伤、感染和休克引发,发病急、预后差[9]。因缺乏有效治疗方法,急性肺损伤发病率及病死率较高,受到学者们的广泛关注[10]。急性肺损伤会导致较为严重的并发症,因此研发药物减轻急性肺损伤对于治疗肺脏疾病具有重要意义[11]。二甲双胍是临床常用的双胍类口服降糖药[12]。近年来研究发现,除了具有降糖作用外,二甲双胍还能有效减轻细胞或组织损伤。盛琦等[13]指出,二甲双胍可减轻H2O2诱导的细胞损伤。WANG等[14]的研究表明,二甲双胍能够减轻脂多糖诱导的急性肺组织损伤。但二甲双胍的肺保护作用机制尚不明确。
本研究结果显示,H2O2处理后A549细胞活力明显降低,而中高浓度二甲双胍处理后细胞活力得到恢复,提示H2O2对细胞活力有抑制作用,而二甲双胍能够逆转这一作用。后续实验结果表明,H2O2诱导后细胞生长明显受到抑制,迁移率、MDA水平上升,SOD水平下降,提示H2O2促进细胞迁移并加剧了氧化损伤。在经过二甲双胍或BAY 11-7082处理后,上述指标变化被显著扭转,提示二甲双胍和BAY 11-7082都可以抑制H2O2诱导的A549细胞迁移,具有减轻氧化损伤的作用。肺纤维化后肺泡结构损坏,上皮细胞及巨噬细胞受损,并释放出大量促纤维化因子,促进Ⅱ型肺泡上皮细胞发生EMT。研究显示,急性肺损伤早期E-钙黏蛋白表达水平降低,波形蛋白表达水平升高[15]。本研究结果表明,H2O2诱导能够抑制E-钙黏蛋白表达,促进N-钙黏蛋白、波形蛋白及FN蛋白表达,二甲双胍或BAY 11-7082处理后,E-钙黏蛋白表达增高,而N-钙黏蛋白、波形蛋白及FN表达降低,提示二甲双胍和BAY 11-7082可能是通过上调E-钙黏蛋白的表达和下调N-钙黏蛋白、波形蛋白、FN的表达,从而抑制H2O2诱导的A549细胞迁移并减轻氧化损伤。
NF-κB信号通路在细胞分化、凋亡、迁移过程中均发挥重要生物学功能。研究显示,NF-κB信号通路在急性肺损伤炎症过程中也发挥重要作用[16]。研究证实,下调NF-κB信号通路蛋白表达能够通过降低氧化应激损伤和炎症反应从而减轻急性肺损伤[17]。裴彩霞等[18]研究发现,桔梗皂苷D能够作用于NF-κB信号通路从而减轻脂多糖诱导的急性肺损伤。另有研究显示,在脂多糖诱导的急性肺损伤中,二甲双胍能够发挥保护作用[19]。CHEN等[20]研究认为,二甲双胍可能通过抑制NF-κB信号通路来发挥抗炎作用。本研究检测了各组细胞中的NF-κB信号通路相关蛋白,结果显示,模型组p-NF-κB p65蛋白表达高于对照组;二甲双胍组和BAY 11-7082组p-NF-κB蛋白表达低于模型组;抑制剂组p-NF-κB p65蛋白表达低于二甲双胍组,激活剂组p-NF-κB p65蛋白表达高于二甲双胍组,提示二甲双胍和BAY 11-7082可能抑制了NF-κB通路的信号转导,二甲双胍可能是通过抑制NF-κB信号通路,上调E-钙黏蛋白表达,下调N-钙黏蛋白、波形蛋白、FN表达,从而抑制H2O2诱导的A549细胞迁移并减轻氧化损伤。
综上所述,二甲双胍可减轻H2O2诱导的人肺泡上皮细胞A549氧化损伤,可能与其抑制NF-κB信号通路、抑制细胞迁移和EMT有关。但本研究仅对二甲双胍与NF-κB信号通路的作用进行了观察,二甲双胍抑制细胞迁移和EMT是否与其他通路相关仍有待进一步研究。
