异钩藤碱对哮喘小鼠气道炎症的影响Δ
2023-12-01华诏召张昌容张淇华周素芳贵州中医药大学第一附属医院中医经典科贵阳55000贵州中医药大学第二附属医院产科贵阳55000贵州中医药大学微生态研究中心贵阳55000贵州医科大学临床微生物与免疫学教研室贵阳55000江西中医药大学岐黄国医书院南昌005
蔡 金 ,华诏召 ,张昌容 ,黄 丹 ,张淇华 ,王 毅 ,周素芳 ,刘 莲 ,龚 安 (.贵州中医药大学第一附属医院中医经典科,贵阳 55000;.贵州中医药大学第二附属医院产科,贵阳 55000;.贵州中医药大学微生态研究中心,贵阳 55000;.贵州医科大学临床微生物与免疫学教研室,贵阳 55000;5.江西中医药大学岐黄国医书院,南昌 005)
哮喘是一种常见的以气道高反应性和气道炎症为特征的疾病,以咳嗽、喘息、胸闷和呼吸困难为主要症状,无法治愈。除了避免接触过敏原,只能使用β 肾上腺素受体激动剂、吸入性皮质类固醇或白三烯D4 受体拮抗剂治疗哮喘,但长期使用上述药物容易引发白内障、骨质疏松等不良反应,故寻找新的治疗方案至关重要[1]。异钩藤碱(isorhynchophylline,IRN)是钩藤的主要活性成分之一,具有抗高血压、保护神经、抗增殖和抗炎等多种生物学效应[2],主要用于治疗心血管和中枢神经系统疾病[3]。Zhu 等[4]研究发现,IRN 能抑制炎症因子的产生以及气道平滑肌细胞的增殖并诱导其凋亡,具有治疗哮喘的潜在作用。单核细胞趋化蛋白1(monocyte chemotactic protein-1,MCP-1)也被称为CC 趋化因子配体2(CC chemokine ligand 2,CCL2),是CC 趋化因子家族的成员,可与CC 趋化因子受体2(CC chemokine receptor 2,CCR2)结合,在单核巨噬细胞和T 细胞的迁移中起关键作用,是治疗慢性炎症性疾病和急性肺损伤的潜在靶点[5―6]。基于以上文献,本研究拟探讨IRN 调节MCP-1/CCR2 信号通路对哮喘小鼠气道炎症反应的影响,旨在为寻找治疗哮喘新药提供参考。
1 材料
1.1 主要仪器
402AI型超声雾化器购自江苏鱼跃医疗设备股份有限公司;CX43 型光学显微镜购自日本Olympus 公司;elx808型多功能酶标仪购自美国BioTek公司;IC1000型全自动细胞计数器购自北京众力挽生物科技有限公司;RM2235型石蜡切片机购自德国Leica公司。
1.2 主要药品与试剂
IRN 对照品(货号Ⅱ0310,纯度≥98%)、苏木精-伊红(hematoxylin and eosin,HE)染色液(货号G1120)均购自北京索莱宝科技有限公司;醋酸地塞米松片(货号02621,规格0.75 mg)购自浙江仙琚制药股份有限公司;卵清蛋白(货号9006-59-1)购自美国Sigma Aldrich 公司;MCP-1/CCR2 信号通路激活剂CCL2 蛋白[货号JN-(Ea)-02244]购自美国R&D Systems公司;肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素13(interleukin-13,IL-13)、IL-4 酶联免疫吸附测定(ELISA)试剂盒(货号分别为ml002095、ml063123、ml0631556)均购自上海酶联生物科技有限公司;BCA 蛋白定量试剂盒(货号P0012)、RIPA缓冲液(货号P0013)均购自上海碧云天生物技术有限公司;小鼠MCP-1、CCR2、甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体和辣根过氧化物酶标记的山羊抗小鼠IgG 二抗(货号分别为ab308522、ab273050、ab8245、ab205719)均购自英国Abcam公司。
1.3 实验动物
SPF级雌性BALB/c小鼠,7周龄,体重(18±2)g,由陆军军医大学医学实验动物中心提供,生产许可证号为SCXK(渝)2022-0011。小鼠饲养在单独通风的无菌笼里,室温为22 ℃,相对湿度控制在(50±5)%,12 h 昼夜交替,并随时获得标准食物和正常饮用水。本研究所有动物实验均经贵州中药大学动物实验伦理委员会批准(伦理编号20220006)。
2 方法
2.1 哮喘小鼠模型的建立、分组与给药
参照文献方法[7]建立哮喘小鼠模型:随机选取50只小鼠,分别在第1、7、14天腹膜内注射20 μg卵清蛋白和2 mg 氢氧化铝佐剂,在第21 至27 天通过超声雾化器吸入3%卵清蛋白溶液(每天1 次,每次30 min)。另取10只小鼠,分别在第1、7、14天腹膜内注射等剂量的无菌磷酸盐缓冲液(PBS),在第21至27天通过超声雾化器吸入3%无菌PBS(每天1 次,每次30 min),标记为空白对照组。当造模小鼠出现烦躁不安、脾气躁动、张口喘息并伴有饮水、喷嚏增多等现象,标志着哮喘小鼠模型建立成功。将50只造模成功的小鼠随机分为哮喘组、IRN低剂量(IRN-L)组、IRN 高剂量(IRN-H)组、IRN-H+CCL2组、阳性对照组,每组10只。其中,阳性对照组小鼠腹腔注射2 mg/kg地塞米松,同时灌胃生理盐水[8];IRN-L组、IRN-H 组小鼠分别灌胃10、20 mg/kg IRN[9],同时腹腔注射生理盐水;IRN-H+CCL2 组小鼠灌胃20 mg/kg IRN,同时腹腔注射7.5 ng CCL2[10];哮喘组及空白对照组小鼠分别灌胃及腹腔注射等体积的生理盐水,每天1 次,连续2周。
2.2 小鼠呼吸间歇值的检测
干预结束后,小鼠按50 mg/kg 腹腔注射2%戊巴比妥钠,麻醉成功后,切开气管进行插管。将小鼠放入与呼吸机相连的空腔中,待其呼吸稳定后,分别以3.125、6.25、12.5 mg/mL 乙酰甲胆碱激发,以分析气道高反应指标——呼吸间歇(enhanced pause,Penh)值。
2.3 标本采集
气道高反应指标检测结束后,摘除小鼠眼球,取血0.3~0.5 mL,在室温下静置2 h 后,以2 500 r/min 离心20 min,收集血清储存在-80 °C下备用;然后,处死小鼠进行组织分离并暴露气管,用0.5 mL预冷的PBS冲洗左肺,收集支气管肺泡灌洗液,在4 ℃下以1 500 r/min 离心10 min,收集上清液储存在-80 °C下备用;分离右肺组织,部分固定在4%甲醛溶液中,用于病理学检测,另一部分储存在-80 °C下备用。
2.4 小鼠血清中IL-4、IL-13、TNF-α水平的检测
取“2.3”项下血清样本,按照试剂盒说明书进行操作,利用多功能酶标仪检测吸光度值,然后根据标准曲线计算小鼠血清中IL-4、IL-13、TNF-α水平。
2.5 小鼠支气管肺泡灌洗液中炎症细胞的检测
取“2.3”项下支气管肺泡灌洗液上清液,以PBS 重悬,在细胞沉降前将细胞悬液移入离心管中,并进行瑞氏染色,将混合物孵育5 min,采用全自动细胞计数器对炎症细胞[嗜酸性粒细胞(eosinophil,EOS)、淋巴细胞(lymphocyte,LYM)和中性粒细胞(neutrophil,NEU)]进行分类计数。
2.6 小鼠肺组织病理学变化及炎症细胞浸润评分的检测
取“2.3”项下固定在4%甲醛溶液的小鼠肺组织,经石蜡包埋、切片(5 μm)后用HE 染色。使用光学显微镜下观察肺组织病理学变化,参照文献方法[11]评估炎症细胞浸润评分,评分标准如下:0分,无炎症细胞浸润;1分,少量炎症细胞浸润;2 分,层厚为1 个细胞,炎症细胞构成环状;3分,层厚为2~4个细胞,炎症细胞构成环状;4分,层厚大于4个细胞,炎症细胞构成环状。
2.7 小鼠肺组织中MCP-1、CCR2蛋白表达水平的检测
取“2.3”项下冻存的小鼠右肺组织,加入RIPA 缓冲液研磨后于冰上裂解,离心后(4 ℃,3 000 r/min,15 min)取上清液,采用BCA蛋白定量试剂盒检测蛋白浓度,沸水煮10 min使蛋白变性;每个样品取40 μg变性蛋白,经过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离(电压90 V),并在冰上转移到聚偏二氟乙烯膜上,加入5%脱脂奶粉,室温下封闭2 h;将封闭液稀释的MCP-1、CCR2、GAPDH 一抗(稀释比均为1∶500)加至聚偏二氟乙烯膜上,摇床孵育30 min,4 ℃静置过夜;以TBST缓冲液洗膜,室温下加入二抗(稀释比为1∶1 000),摇床孵育2 h;TBST 缓冲液洗膜,将膜浸泡在ECL 化学发光液中进行显色、成像。使用Image J软件对蛋白条带进行量化,以目标蛋白与内参蛋白(GAPDH)条带的灰度值比值表示目标蛋白的表达水平。
2.8 统计学方法
采用SPSS 27.0 软件对实验数据进行统计分析,并以GraphPad Prism 8.0 软件作图。计量资料以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。检验水准α=0.05。
3 结果
3.1 IRN对小鼠Penh值的影响
小鼠分别用3.125、6.25、12.5 mg/mL 乙酰甲胆碱激发后,与空白对照组比较,哮喘组小鼠Penh 值均显著增加(P<0.05);与哮喘组比较,IRN-L 组、IRN-H 组、阳性对照组小鼠Penh 值均显著降低(P<0.05);与IRN-L 组比较,IRN-H 组、阳性对照组小鼠Penh 值均显著降低(P<0.05);IRN-H 组与阳性对照组比较,差异均无统计学意义(P>0.05);与IRN-H 组比较,IRN-H+CCL2 组小鼠Penh值均显著增加(P<0.05)。结果见表1。
表1 各组小鼠气道高反应指标Penh 值的检测结果(±s,n=10)

表1 各组小鼠气道高反应指标Penh 值的检测结果(±s,n=10)
a:与空白对照组比较,P<0.05;b:与哮喘组比较,P<0.05;c:与IRN-L组比较,P<0.05;d:与IRN-H组比较,P<0.05。
组别空白对照组哮喘组IRN-L组IRN-H组IRN-H+CCL2组阳性对照组3.125 mg/mL剂量下Penh值0.11±0.01 0.65±0.07a 0.45±0.05b 0.21±0.03bc 0.52±0.06d 0.18±0.02bc 6.25 mg/mL剂量下Penh值0.86±0.09 2.14±0.22a 1.57±0.16b 1.02±0.11bc 1.66±0.17d 0.92±0.10bc 12.5 mg/mL剂量下Penh值2.07±0.21 6.54±0.66a 3.85±0.39b 2.27±0.23bc 4.48±0.45d 2.11±0.22bc
3.2 IRN对小鼠血清中IL-4、IL-13、TNF-α水平的影响
与空白对照组比较,哮喘组小鼠血清中IL-4、IL-13、TNF-α水平均显著升高(P<0.05);与哮喘组比较,IRNL 组、IRN-H 组、阳性对照组小鼠血清中IL-4、IL-13、TNF-α 水平均显著降低(P<0.05);与IRN-L 组比较,IRN-H组、阳性对照组小鼠血清中IL-4、IL-13、TNF-α水平均显著降低(P<0.05);IRN-H 组与阳性对照组比较,差异均无统计学意义(P>0.05);与IRN-H组比较,IRNH+CCL2 组小鼠血清中IL-4、IL-13、TNF-α 水平均显著升高(P<0.05)。结果见表2。
表2 各组小鼠血清中IL-4、IL-13、TNF-α 水平的检测结果(±s,n=10,pg/mL)
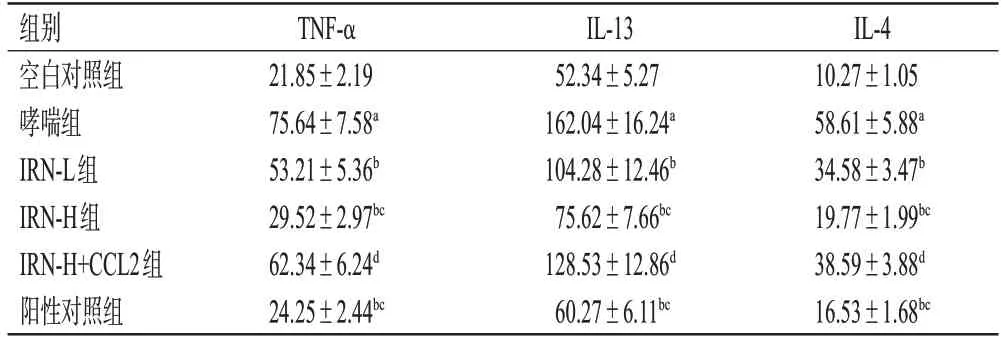
表2 各组小鼠血清中IL-4、IL-13、TNF-α 水平的检测结果(±s,n=10,pg/mL)
a:与空白对照组比较,P<0.05;b:与哮喘组比较,P<0.05;c:与IRN-L组比较,P<0.05;d:与IRN-H组比较,P<0.05。
IL-4 10.27±1.05 58.61±5.88a 34.58±3.47b 19.77±1.99bc 38.59±3.88d 16.53±1.68bc组别空白对照组哮喘组IRN-L组IRN-H组IRN-H+CCL2组阳性对照组TNF-α 21.85±2.19 75.64±7.58a 53.21±5.36b 29.52±2.97bc 62.34±6.24d 24.25±2.44bc IL-13 52.34±5.27 162.04±16.24a 104.28±12.46b 75.62±7.66bc 128.53±12.86d 60.27±6.11bc
3.3 IRN 对小鼠支气管肺泡灌洗液中EOS、LYM 和NEU数量的影响
与空白对照组比较,哮喘组小鼠支气管肺泡灌洗液中EOS、LYM、NEU 数量均显著增加(P<0.05);与哮喘组比较,IRN-L 组、IRN-H 组、阳性对照组小鼠支气管肺泡灌洗液中EOS、LYM、NEU 数量均显著降低(P<0.05);与IRN-L组比较,IRN-H组、阳性对照组小鼠支气管肺泡灌洗液中EOS、LYM、NEU数量均显著降低(P<0.05);IRN-H 组与阳性对照组比较,差异均无统计学意义(P>0.05);与IRN-H 组比较,IRN-H+CCL2 组小鼠支气管肺泡灌洗液中EOS、LYM、NEU 数量均显著增加(P<0.05)。结果见表3。
表3 各组小鼠炎症细胞数量的检测结果(±s,n=10,×104 mL-1)

表3 各组小鼠炎症细胞数量的检测结果(±s,n=10,×104 mL-1)
a:与空白对照组比较,P<0.05;b:与哮喘组比较,P<0.05;c:与IRN-L组比较,P<0.05;d:与IRN-H组比较,P<0.05。
NEU 0.78±0.08 2.88±0.29a 2.17±0.23b 1.27±0.13bc 2.26±0.23d 1.14±0.12bc组别空白对照组哮喘组IRN-L组IRN-H组IRN-H+CCL2组阳性对照组EOS 0.55±0.06 2.08±0.21a 1.53±0.16b 0.81±0.09bc 1.66±0.17d 0.72±0.08bc LYM 2.55±0.27 6.85±0.69a 3.86±0.39b 2.89±0.29bc 4.55±0.46d 2.75±0.28bc
3.4 IRN 对小鼠肺组织病理学变化及炎症细胞浸润评分的影响
与空白对照组(炎症细胞浸润评分为0.78±0.08)比较,哮喘组小鼠肺组织炎症细胞浸润较明显,并有细胞肿胀、脱落现象发生,炎症细胞浸润评分(3.37±0.35)显著升高(P<0.05);与哮喘组比较,IRN-L 组、IRN-H 组、阳性对照组小鼠气道及支气管周围炎症细胞浸润减少,病理损伤得到改善,炎症细胞浸润评分(2.27±0.13、1.07±0.11、0.86±0.09)均显著降低(P<0.05);与IRN-L组比较,IRN-H 组、阳性对照组小鼠病理损伤进一步得到改善,炎症细胞浸润评分均显著降低(P<0.05);IRNH 组与阳性对照组比较,差异无统计学意义(P>0.05);与IRN-H 组比较,IRN-H+CCL2 组小鼠病理损伤加重,出现细胞肿胀、脱落现象,炎症细胞浸润评分(2.46±0.25)显著增加(P<0.05)。具体显微图见图1。
3.5 IRN对小鼠肺组织中MCP-1、CCR2蛋白表达水平的影响
与空白对照组比较,哮喘组小鼠肺组织中MCP-1、CCR2蛋白表达水平均显著升高(P<0.05);与哮喘组比较,IRN-L组、IRN-H组、阳性对照组小鼠肺组织中MCP-1、CCR2 蛋白表达水平均显著降低(P<0.05);与IRN-L组比较,IRN-H 组、阳性对照组小鼠肺组织中MCP-1、CCR2 蛋白表达水平均显著降低(P<0.05);IRN-H 组与阳性对照组比较,差异均无统计学意义(P>0.05);与IRN-H 组比较,IRN-H+CCL2 组小鼠肺组织中MCP-1、CCR2 蛋白表达水平均显著升高(P<0.05)。结果见图2、表4。
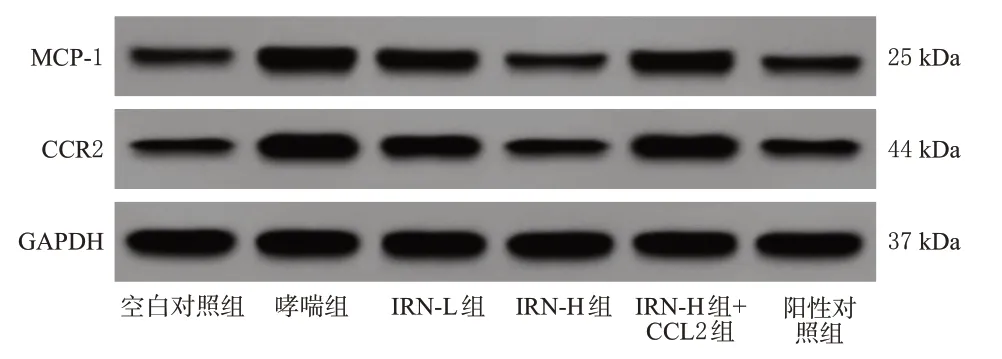
图2 各组小鼠肺组织中MCP-1、CCR2 蛋白表达的电泳图
表4 各组小鼠肺组织中MCP-1、CCR2 蛋白表达水平的检测结果(±s,n=10)

表4 各组小鼠肺组织中MCP-1、CCR2 蛋白表达水平的检测结果(±s,n=10)
a:与空白对照组比较,P<0.05;b:与哮喘组比较,P<0.05;c:与IRN-L组比较,P<0.05;d:与IRN-H组比较,P<0.05。
CCR2/GAPDH 0.34±0.04 1.18±0.12a 0.75±0.08b 0.42±0.05bc 0.88±0.09d 0.38±0.04bc组别空白对照组哮喘组IRN-L组IRN-H组IRN-H+CCL2组阳性对照组MCP-1/GAPDH 0.21±0.03 0.86±0.19a 0.55±0.06b 0.24±0.03bc 0.66±0.07d 0.23±0.03bc
4 讨论
本研究通过注射和吸入卵清蛋白的方法建立哮喘小鼠模型,当小鼠出现烦躁不安、脾气躁动、张口喘息并伴有饮水、喷嚏增多等现象,标志着哮喘小鼠模型建立成功,可进入下一步研究。IRN是一种四环氧吲哚生物碱,具有抗炎、神经保护及抗氧化作用[9]。IRN可以减轻吸入二氧化硅导致的肺部炎症反应和纤维化[12]。此外,Li 等[13]通过体内外实验研究发现,IRN 可能通过抑制自噬来减轻哮喘症状,可成为治疗哮喘的潜在药物。基于以上调研,笔者推测IRN可能具有改善哮喘的作用。本研究结果显示,哮喘小鼠经IRN 干预后,病理损伤得到改善;炎症细胞浸润评分,Penh值,IL-4、IL-13、TNF-α水平以及EOS、NEU、LYM数量均明显降低;且IRN高剂量干预效果与阳性对照药相当。这表明IRN 可通过抑制气道炎症反应来发挥改善哮喘的作用,与文献调研结果基本吻合,但其作用机制仍需深入探索。
趋化因子是一类能诱导反应细胞定向趋化的细胞因子,能引导表达趋化因子受体的细胞迁移到局部趋化因子配体浓度高的位点,从而导致炎症反应。作为趋化因子家族的成员,MCP-1(又称CCL2)与其受体CCR2参与了多种炎症和神经退行性疾病的发生[14]。研究表明,CCL2 与哮喘儿童的炎症反应密切相关,研究其相关机制可为儿童特应性哮喘的诊断标志物挖掘提供方向[15]。本研究发现,哮喘小鼠肺组织中MCP-1、CCR2蛋白表达水平均显著升高,提示哮喘发生可能与MCP-1/CCR2信号通路激活有关;经IRN 干预后,MCP-1、CCR2 蛋白表达水平均显著降低,哮喘小鼠的炎症反应也显著减弱,病理损伤也得到改善,推测IRN 可能通过抑制MCP-1/CCR2信号通路的激活来减轻哮喘小鼠的气道炎症。为证明上述推测,本研究以MCP-1/CCR2信号通路激活剂CCL2 进行验证,结果发现,CCL2 逆转了高剂量IRN 对哮喘小鼠的保护作用,表明IRN对哮喘小鼠的气道炎症具有抑制作用,可能与抑制MCP-1/CCR2信号通路的激活有关。
综上所述,IRN 可能通过抑制MCP-1/CCR2 信号通路的激活来减少哮喘小鼠气道炎症因子的释放,从而达到改善哮喘的目的;但由于哮喘发病机制复杂,后续将进一步深入研究。
