2型糖尿病患者血糖波动与血清网膜素-1及氧化应激因子的关系
2023-12-01朱明明李宗虎郑宪玲王颖霞张树杰
朱明明, 李宗虎, 郑宪玲, 王颖霞, 张树杰
(河北省邯郸市中心医院, 1. 内分泌一科, 2. 健康体检科, 河北 邯郸, 056001)
2型糖尿病(T2DM)主要是由胰岛素分泌不足或胰岛素抵抗引起的高血糖症,以多尿、多饮、多食和消瘦为典型特征[1]。T2DM病因复杂,与氧化应激反应、糖脂代谢紊乱、遗传和环境等因素有关[2-3]。研究[4]显示, T2DM会造成多种慢性并发症,如大血管病变、神经病变和骨质疏松等,严重危害患者生命健康。血糖波动又称为血糖变异,与T2DM慢性并发症的发生及发展密切相关。血清网膜素(Omentin)是一种保护性脂肪因子,分为Omentin-1和Omentin-2, 在血液中的主要存在形式为Omentin-1, 可增强胰岛素敏感性,并在T2DM及骨质疏松的发展中起调节作用[5]。研究[6]认为,氧化应激反应也参与了T2DM及其慢性并发症的发展过程,并与血清Omentin-1互相拮抗。多项研究[7-8]证实,血糖波动可通过多种代谢途径激活氧化应激反应和炎性细胞因子,引起血管内皮细胞损伤,最终导致大血管病变。本研究探讨T2DM患者血糖波动与血清Omentin-1及氧化应激因子的关系,现报告如下。
1 资料与方法
1.1 一般资料
选取2021年6月—2023年1月河北省邯郸市中心医院收治的134例T2DM患者作为T2DM组,另随机选取同期在该院行健康体检者67例作为对照组。根据平均血糖波动幅度(MAGE)[9]的不同将T2DM组患者又分为血糖平稳组(MAGE<3.9 mmol/L)81例和血糖波动组(MAGE≥3.9 mmol/L)53例。纳入标准: ① T2DM组符合T2DM诊断标准[9]; ② 患者及其家属均对本研究知情同意。排除标准: ① 妊娠期、哺乳期女性患者; ② 精神疾病患者; ③ 合并重要脏器功能病变者; ④ 合并恶性肿瘤者或近1个月内使用过影响糖代谢药物者; ⑤ 合并感染性疾病及免疫系统疾病者。
T2DM组中,男79例,女55例,年龄39~58岁,平均(48.52±3.27)岁,平均体质量指数(23.14±1.08) kg/m2。血糖平稳组中,男49例,女32例,年龄39~58岁,平均(48.94±4.22)岁,平均体质量指数(22.99±1.22)kg/m2, 平均病程(4.14±1.02)年。血糖波动组中,男30例,女23例,年龄39~58岁,平均(47.71±1.82)岁,平均体质量指数(23.37±0.87) kg/m2, 平均病程(4.55±1.48)年。对照组中,男38例,女29例,年龄40~59岁,平均(49.36±3.41)岁,平均体质量指数(23.49±1.67) kg/m2。各组基线资料比较,差异无统计学意义(P>0.05)。本研究经医院伦理委员会审核批准。
1.2 方法
叮嘱入组者禁食12 h、禁饮8 h, 采集晨起空腹静脉血3 mL, 经离心处理后取上层清液,放置于-80 ℃环境中保存备用。采用酶联法检测血清Omentin-1、8-异前列腺素F2α(8-iso-PGF2α)、过氧化氢酶(CAT)、8-羟化脱氧鸟苷(8-OHDG)、谷胱甘肽过氧化物酶(GPX)和谷胱甘肽(GSH)水平,试剂及试剂盒均由艾美捷科技有限公司提供; 采用硫代巴比妥酸比色法检测血清丙二醛(MDA), 试剂及试剂盒由武汉伊莱瑞特生物科技股份有限公司提供; 采用羟胺法检测超氧化物歧化酶(SOD)水平,试剂及试剂盒购自江西江蓝纯生物试剂有限公司。所有检测步骤均按照说明书操作。
所有患者入院后,采用雅培瞬间血糖仪(雅培公司)行连续3 d的血糖跟踪检测。通过置于手臂上部外侧的传感器进行实时血糖监测,告知患者佩戴后1 h采用血糖仪检测血糖值并记录, 4次/d(三餐前及睡前)。监测期间患者的进食时间基本固定,避免加餐及服用影响血糖代谢的药物。记录3 d后,根据血糖值计算日内MAGE、平均血糖标准差(SDBG)、日间血糖波动幅度(MODD)、最大血糖波动幅度(LAGE)。
1.3 观察指标
① 比较T2DM组与对照组血糖波动参数、血清Omentin-1和氧化应激因子水平; ② 比较血糖平稳组与血糖波动组血清Omentin-1和氧化应激因子水平; ③ 采用Pearson相关性分析探讨MAGE与血清Omentin-1和氧化应激因子的关系。
1.4 统计学分析

2 结 果
2.1 T2DM组与对照组血糖波动参数比较
T2DM组MAGE、SDBG、MODD和LAGE水平均高于对照组,差异有统计学意义(P<0.01)。见表1。

表1 T2DM组与对照组血糖波动参数比较 mmol/L
2.2 T2DM组与对照组血清Omentin-1和氧化应激因子水平比较
T2DM组Omentin-1、SOD、CAT、GPX和GSH水平低于对照组, MDA、8-iso-PGF2α、8-OHDG水平高于对照组,差异有统计学意义(P<0.01)。见表2。

表2 T2DM组与对照组血清Omentin-1和氧化应激因子水平比较
2.3 血糖平稳组与血糖波动组患者血清Omentin-1和氧化应激因子水平比较
血糖波动组Omentin-1、SOD、CAT、GPX和GSH水平低于血糖平稳组, MDA、8-iso-PGF2α、8-OHDG水平高于血糖平稳组,差异有统计学意义(P<0.01)。见表3。

表3 血糖平稳组与血糖波动组患者血清Omentin-1和氧化应激因子水平比较
2.4 MAGE与血清Omentin-1和氧化应激因子的关系
Pearson相关性分析显示, MAGE与血清Omentin-1、SOD、CAT、GPX、GSH水平均呈负相关(P<0.01), 与MDA、8-iso-PGF2α、8-OHDG水平均呈正相关(P<0.05或P<0.01)。见表4。
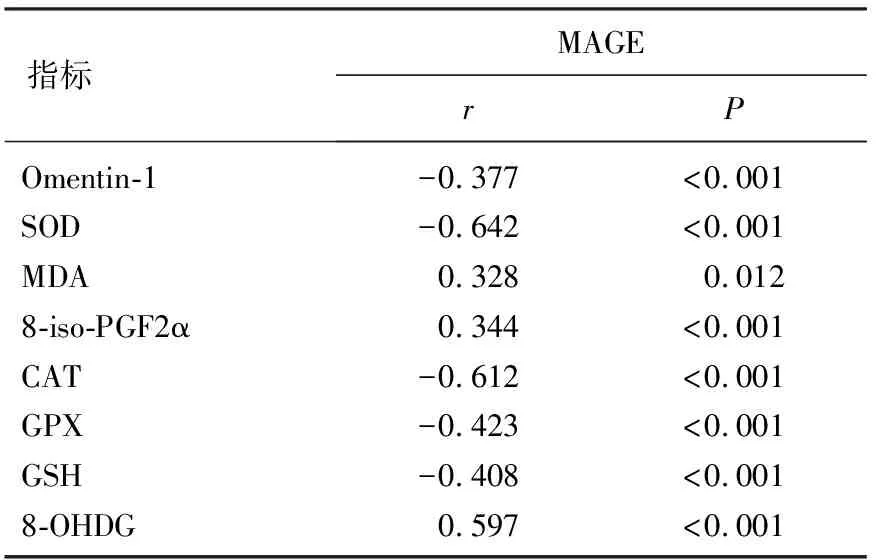
表4 MAGE与血清Omentin-1和氧化应激因子的关系
3 讨 论
血糖波动是指血糖水平的最高值与最低值之间波动的幅度,正常人也会存在一定的血糖波动,但波动幅度低且多数为无效波动[10]。LIU M等[11]研究显示,血糖波动范围较大可加速T2DM的进程,且发生并发症的可能性也较高。相关研究[12]显示,血糖波动也可影响氧化应激反应。由此可见,血糖波动与氧化应激反应之间存在一定联系。有研究[13]证实,血清Omentin-1与氧化应激反应具有相关性,推测血糖波动可能与血清Omentin-1有关,但具体机制尚未完全明确。
动态血糖监测系统(CGMS)是目前临床较为新颖的监测T2DM患者血糖变化情况的手段,可反映全天血糖信息,帮助医生实时了解患者血糖波动情况,从而发现隐匿性高血糖和低血糖[14]。本研究通过CGMS评估T2DM患者血糖波动幅度,可精确反映血糖波动幅度参数,如MAGE、SDBG、MODD和LAGE等,以此来了解T2DM患者血糖变化趋势。本研究结果显示, T2DM组MAGE、SDBG、MODD和LAGE水平均显著高于对照组,说明T2DM组患者存在较大的血糖波动,可能是因T2DM患者正处于高氧化应激状态,而此种应激状态会促进肾上腺激素的分泌并提高脂肪酸水平,加速糖原分解,导致血糖升高,使患者出现更为明显的血糖波动。
本研究中, T2DM组Omentin-1、SOD、CAT、GPX和GSH水平显著低于对照组, MDA、8-iso-PGF2α、8-OHDG水平显著高于对照组,提示血清Omentin-1、SOD、MDA、8-iso-PGF2α、CAT、GPX、GSH和8-OHDG均可能参与T2DM的发生和发展。血清Omentin-1是一种新型脂肪因子,可通过刺激胰岛素受体信号通路中的蛋白激酶B(AKT)发生磷酸化,增强胰岛素敏感性[15]。当其水平异常降低时,将加重胰岛素抵抗,导致血糖升高。此外,血清Omentin-1水平的降低也可促使相关炎症因子释放,而后通过影响Th1/Th2比例失衡进而导致胰岛素抵抗,最终使血糖升高[16]。SOD、MDA、CAT、GPX、GSH均为临床常用的氧化应激反应检测指标[17],其中SOD作为一种抗氧化酶,可反映机体清除氧自由基和抵抗氧化性损伤的能力; MDA是SOD的代谢终末产物,可反映氧自由基的生成量; CAT在保护细胞免受氧化应激损伤中起关键作用; GPX具有清除过氧化氢、参与炎症调节等作用; GSH是一种抗氧化剂,有助于清除自由基和其他有害物质,具有保护细胞和组织免受氧化应激的作用。8-iso-PGF2α是公认的脂质过氧化标志物,是血糖波动研究中最常用的氧化应激生物标志物,其值越大说明氧化应激反应程度越严重[18]。8-OHDG是DNA氧化损伤的特异性生物标志物,可评估体内氧化损伤和修复程度,也常用于糖尿病研究中。SOD、MDA、CAT、GPX、GSH及8-iso-PGF2α、8-OHDG水平出现异常变化,提示机体存在较为强烈的应激反应,可能会促进胰高血糖素的分泌,加重胰岛素抵抗,导致血糖升高而出现高血糖症。
研究[19]证实MAGE是衡量血糖波动的金标准,其水平变化可反映血糖整体水平和离散趋势。本研究根据其水平变化将T2DM患者分为血糖平稳组和血糖波动组,结果显示血糖波动组Omentin-1、SOD、CAT、GPX和GSH水平显著低于血糖平稳组, MDA、8-iso-PGF2α、8-OHDG水平显著高于血糖平稳组; Pearson相关性分析也显示, MAGE与血清Omentin-1、SOD、CAT、GPX和GSH水平均呈负相关,与MDA、8-iso-PGF2α、8-OHDG水平均呈正相关,这与既往部分研究[20-21]类似,说明T2DM患者血糖波动与血清Omentin-1呈负相关,与氧化应激反应呈正相关。考虑原因为血糖波动会增强核因子-κB与蛋白激酶C活性,从而引起机体的氧化应激反应。当其波动幅度过大时,会对血管内皮细胞造成损伤,促进细胞凋亡,再加之血糖波动时会激活多种通路,最终导致患者氧化应激反应加重[22], 从而参与T2DM的发生和发展。血清Omentin-1可通过影响激活AKT信号通路的活性来维持血糖波动平衡,当其水平下降时,会抑制信号通路活性来使血糖水平不断上升,导致T2DM患者血糖波动较大。此外,血清Omentin-1主要由脂肪细胞合成,而脂肪组织是氧化应激反应较为强烈的部位,且活性氧自由基可抑制脂肪细胞Omentin-1的产生[23],故推测血清Omentin-1也可通过影响氧化应激反应来间接影响血糖波动。
综上所述, T2DM患者体内存在较为明显的血糖波动,血糖波动不仅与血清Omentin-1水平相关,还与氧化应激因子有关。
