血浆致动脉硬化指数联合胰岛素抵抗指数对2型糖尿病患者估算肾小球滤过率降低的预测价值
2023-12-01胡秀娟惠灿灿王淑倩印小蓉崔梦捷黄沁仪尹杨柳
胡秀娟, 惠灿灿, 王淑倩, 印小蓉, 崔梦捷,黄沁仪, 尹杨柳, 张 雅, 孙 艳
(1. 安徽医科大学第一附属医院 老年内分泌科, 安徽 合肥, 230022;2. 安徽医科大学, 安徽 合肥, 230032)
糖尿病肾脏疾病(DKD)是糖尿病最主要的慢性并发症之一,其主要诊断依据是尿微量白蛋白,随着患者尿液中白蛋白的增多和估算肾小球滤过率(eGFR)的降低,DKD逐渐进展为终末期肾病[1]。研究[2]显示, eGFR的早期下降可作为糖尿病患者合并肾脏并发症的预测指标,故早期监测并随访eGFR水平能有效防治DKD的发生与发展。DKD的发生机制与高糖导致的慢性炎症/肾小球动脉硬化/脂代谢紊乱均有关。血浆致动脉硬化指数(AIP)是甘油三酯(TG)与高密度脂蛋白胆固醇(HDL-C)比值的对数转换值,可反映血脂变化[3]。AIP及胰岛素抵抗所致慢性炎症与DKD的发生存在一定相关性,且可作为终末期肾病的独立预测因子[4], 而胰岛素抵抗指数(HOMA-IR)是目前反映胰岛素抵抗的常用指标。本研究探讨AIP联合HOMA-IR对2型糖尿病(T2DM)患者eGFR降低的预测价值,以期为早期防治DKD提供循证医学依据。
1 对象与方法
1.1 研究对象
选取2020年8月—2022年5月于安徽医科大学第一附属医院干部内分泌科住院治疗的125例T2DM患者作为研究对象。纳入标准: ① 年龄≥18岁者; ② 符合T2DM诊断标准[5], 且既往3个月内接受稳定降糖方案治疗者; ③ 病历资料完整者。排除标准: ① 1型或其他类型糖尿病患者; ②合并糖尿病酮症酸中毒等严重并发症者; ③ 既往3个月内出现高血糖高渗状态或严重反复低血糖事件者; ④ 伴有严重心脑血管疾病、肝脏或肾脏功能障碍疾病者; ⑤ 合并恶性肿瘤或精神障碍者。
1.2 方法
收集所有患者的一般资料,包括年龄、病程、收缩压(SBP)、舒张压(DBP)等。嘱患者入院后禁食8~10 h, 次日早晨抽取患者肘静脉血,使用生化分析仪检测相关生化指标,包括空腹胰岛素(FINS)、空腹血糖(FBS)、糖化血红蛋白(HbA1c)、总胆固醇(TC)、甘油三酯(TG)、极低密度脂蛋白胆固醇(VLDL-C)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、胱抑素C(CysC)、脂蛋白a[Lp(a)]、肌酐(Cr)、eGFR、尿酸(UA)、24 h尿蛋白,并计算AIP[公式为AIP=log(TG/HDL-C)]和HOMA-IR[公式为HOMA-IR=FBS×FINS/22.5]。依据eGFR水平,将患者分为单纯T2DM组[eGFR≥90 mL/(min·1.73 m2)] 76例和eGFR降低组[eGFR<90 mL/(min·1.73 m2)]49例。
1.3 统计学分析

2 结 果
2.1 一般资料及生化指标比较
2组患者AIP、HOMA-IR、年龄、病程、DBP、FINS、TG、CysC、Lp(a)、Cr、UA、24 h尿蛋白比较,差异有统计学意义(P<0.05), 见表1。

表1 2组患者一般资料及生化指标比较
2.2 T2DM患者eGFR降低的二元Logistic回归分析及联合预测模型构建
以患者eGFR水平(eGFR未降低=0, eGFR降低=1)作为因变量,以AIP、HOMA-IR为自变量,进行二元Logistic回归分析,结果显示, AIP、HOMA-IR水平升高均为T2DM患者eGFR降低的独立危险因素(OR=2.148, 95%CI: 0.446~10.348,P=0.025;OR=1.170, 95%CI: 1.058~1.294,P=0.002)。根据分析结果建立AIP与HOMA-IR对T2DM患者eGFR降低的联合预测模型,公式为Logit(P)=-1.764+0.765×AIP+0.157×HOMA-IR, 见表2。

表2 AIP与 HOMA-IR联合预测T2DM患者eGFR下降的二元Logistic回归分析结果
2.3 AIP、HOMA-IR单独及联合预测T2DM患者eGFR下降的ROC曲线分析
ROC曲线分析结果显示,单独AIP预测T2DM患者eGFR下降的曲线下面积(AUC)为0.605(95%CI: 0.501~0.709), 截断值为0.48, 此时敏感度为27%, 特异度为96%; 单独HOMA-IR预测T2DM患者eGFR下降的AUC为0.707(95%CI: 0.600~0.810), 截断值为0.32, 此时敏感度为66%, 特异度为76%; AIP联合HOMA-IR预测的AUC为0.710(95%CI: 0.600~0.820), 截断值为0.31, 此时敏感度为66%, 特异度为73%。见图1。
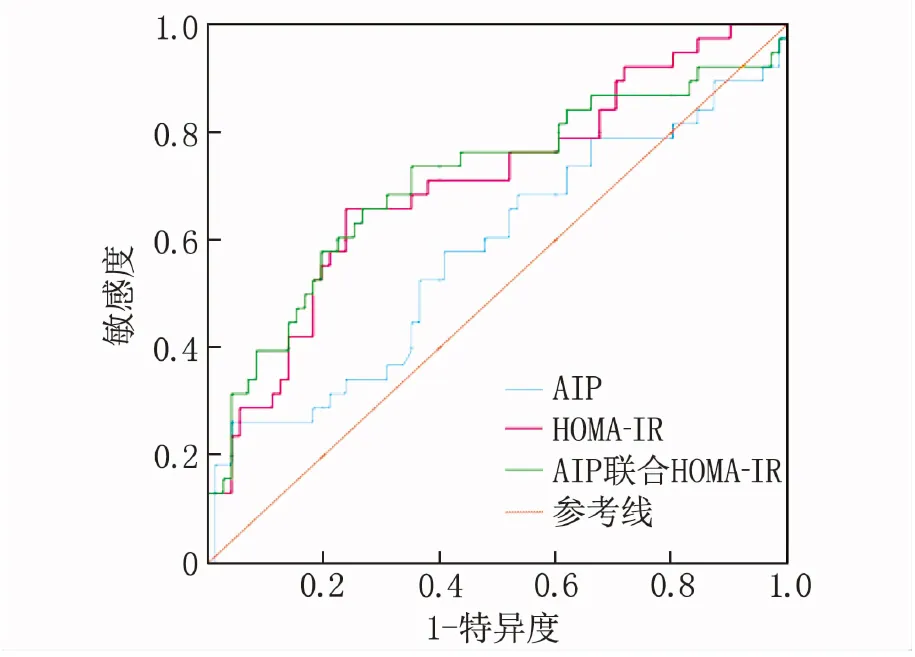
图1 AIP、HOMA-IR单独及联合预测eGFR下降的ROC曲线
3 讨 论
DKD是由糖尿病导致的慢性肾脏病,也是导致终末期肾病的首位病因。DKD起病十分隐匿,出现临床症状时大多已达到大量蛋白尿期,且DKD进展至终末期肾病的速度显著快于其他类型肾脏疾病,故早期发现并干预对于延缓DKD进展和提高患者生存率具有重要意义[6]。
引起eGFR变化的因素有很多,例如年龄、病程、DBP、CysC、Lp(a)、Cr、UA、24 h尿微量白蛋白等均与eGFR相关。动脉粥样硬化病理过程是多种因素作用的结果,年龄、病程的增加和高血压均会加重该病理过程[7]并加剧肾脏损害,从而导致eGFR下降。CysC由机体内有核细胞产生,虽由多个途径合成,但清除路径只有1条,即只能通过肾小球滤过作用排出,因此CysC能够反映患者肾小球滤过率,对肾功能的评估灵敏度较高[8]。研究[9]显示,血清Lp(a)水平升高与肾脏疾病相关,随着患者肾功能损害程度的增加,患者eGFR水平逐渐下降,与本研究结果一致。Cr也是目前常用的肾功能评价指标,其主要由肾小球进行滤过,可反映机体慢性肾病情况,与eGFR呈负相关,临床也应早期监测。嘌呤代谢的最终产物是UA, 人体内约70%的UA经肾脏排泄。UA具有抗氧化性和促氧化性,研究[10]结果显示UA主要通过促进慢性炎症,抑制内皮一氧化氮合成酶释放,并激活肾素-血管紧张素-醛固酮系统,直接影响内皮细胞功能和血管平滑肌功能,从而引起微血管病变,对糖尿病患者肾脏造成损害,引发DKD, 导致eGFR下降。24 h尿蛋白能够反映肾脏微血管早期改变,评估早期肾小球损害状况,与T2DM患者eGFR下降相关[11]。
脂代谢紊乱是动脉粥样硬化的重要致病因素, AIP作为一种新型综合血脂指标,能够反映血浆脂蛋白代谢的相互作用[12], 避免了单一血脂指标的不足,可作为预测动脉粥样硬化的有效指标。既往研究[13-14]发现, AIP对心血管疾病、代谢综合征、自身免疫疾病等均具有一定预测价值。ZHOU Y P等[15]研究发现, AIP与T2DM患者eGFR水平呈负相关。本研究发现, AIP升高是T2DM患者eGFR降低的独立危险因素,且ROC曲线证实AIP对T2DM患者eGFR降低具有良好的预测价值。
胰岛β细胞通过分泌胰岛素调节血糖,以维持正常的血糖水平,胰岛素抵抗与胰岛β细胞功能之间存在动态变化[16]。胰岛素抵抗是糖尿病及慢性肾脏病发生的始动因素之一,也是贯穿疾病全程的独立危险因子[17]。在胰岛素抵抗的作用下,胰岛素介导的扩血管作用减弱,血管舒缩功能失调,导致肾小球毛细血管内高灌注、高压力、高滤过,长期“三高”状态使得内皮细胞受损、肾小球广泛硬化、足细胞进一步损伤,从而加剧肾脏损害,导致eGFR下降。本研究发现, HOMA-IR水平越高, T2DM患者发生eGFR下降的风险越高。因此,减轻胰岛素抵抗对延缓患者病程进展具有重要的临床意义。
综上所述, AIP、HOMA-IR均为T2DM患者eGFR降低的独立危险因素,两者联合预测eGFR降低的价值高于单独预测。此外, HOMA-IR独立预测T2DM患者eGFR下降的效能优于AIP, 提示胰岛功能的影响可能大于脂代谢的影响。
