血清MCP-1、sTLR4、ox-AAT水平在胎膜早破合并绒毛膜羊膜炎中的变化及对新生儿早发型败血症的预测价值
2023-11-30王文宁倪银枝魏楠楠
王文宁,倪银枝,魏楠楠
(郸城县妇幼保健院,河南 周口 477150 )
胎膜早破(PROM)为妊娠期并发症,极易引起出生7 d 内新生儿产生早发型败血症(EOS)。绒毛膜羊膜炎(CAM)为引起PROM 危险因素,尤其是亚临床CAM,但因亚临床CAM 缺少典型临床表现与有效实验室诊断,目前仅依靠胎膜病理与羊水穿刺检测作诊断金标准,而羊水穿刺检测为侵入性检查方式,胎膜病理检查仅能为诊断标准,临床应用时均存在限制,且对于预测新生儿EOS 的意义不显著[1]。单核细胞趋化蛋白1(MCP-1)参与炎性反应过程,能利用单核细胞的趋化活性加剧炎性反应[2]。氧化型α1-抗胰蛋白酶(ox-AAT)与PROM 合并亚临床CAM 具有紧密联系,可调节其炎性反应[3]。以往研究表明,Toll 样受体(TLR4)与晚期糖基化终产物(RAGE)受体结合,可介导炎性反应[4]。目前,临床关于MCP-1、可溶性TLR4(sTLR4)、ox-AAT 能否作新生儿EOS 早期预警分子并未明确报道,故笔者期望通过探讨上述因子为早期预测EOS 血清指标可行性,为临床研究予以理论依据。
1 资料与方法
1.1 基础资料
回顾性选取郸城县妇幼保健院2020 年11 月至2022 年12 月收治的80 例PROM 产妇为研究对象。其中41 例男性新生儿,39 例女性新生儿;产妇年龄21~45 岁,平均(32.59±5.75)岁;PROM>12 h。全部产妇的产后胎盘组织予以病理检测,由病理科两名经验丰富病理医师予以阅片以诊断是否发生CAM,其中CAM 组43 例(轻度17 例、中度14 例、重度12 例)、非CAM 组37 例。CAM诊断标准[5]:HE 染色之后进行观察,绒毛膜与羊膜组织内中性粒细胞浸润状况,超出3~4 个/高倍视野诊断是CAM,如果<3 个/高倍视野或者未产生浸润现象,属于无感染症状。按照胎膜内浸润中性粒细胞数据分成3 个等级,即轻度为中性粒细胞5~10 个/高倍视野、中度为中性粒细胞11~30 个/高倍视野、重度为中性粒细胞>30 个/高倍视野。
1.2 入组条件
纳入条件:行阴道足月分娩;阴道液涂片、妇科阴道检查、临床表现与羊膜镜检查等诊断为PROM,早破时间>12 h;分娩前无宫外感染,血常规正常;母婴临床资料完整;产妇知情本研究,且签订同意书。
排除条件:分娩伴染色体异常、先天性心脏病、严重先天畸形、遗传代谢类病变新生儿产妇;伴严重免疫系统病变、急性与慢性严重感染、合并出血性病变、血液系统病变与恶性肿瘤产妇;合并生殖道畸形的产妇。
1.3 血清检测方法
收集全部产妇宫缩前5 mL 静脉血于采集管内,静置0.5 h,3 000 r/min 转速持续离心5 min,取血清,放在-80℃冰箱内保存待检。利用酶联免疫吸附法测血清sTLR4、ox-AAT、MCP-1 水平。
1.4 观察指标
①观察两组血清MCP-1、sTLR4、ox-AAT 水平。②统计新生儿出生7 d 内发生EOS 状况,对比EOS 产妇(28 例)与非EOS 产妇(52 例)血清MCP-1、sTLR4、ox-AAT 水平。EOS 诊断标准[6]:经过外周血标本的病原菌抗原或者DNA 检查结果为阳性;非特异性检测指标≥2 条结果异常,包括血小板计数≤1×1011/L、白细胞计数<5×109/L、出生12 h 杆状粒细胞/中性粒细胞≥0.16、微量红细胞沉降率≥5 mm/h、C 反应蛋白≥8 μg/mL 等。③分析血清MCP-1、sTLR4、ox-AAT 水平与合并CAM、CAM 严重程度、发生EOS 的相关性。④偏回归分析新生儿发生EOS 的影响因素。⑤分析血清MCP-1、sTLR4、ox-AAT 水平预测新生儿发生EOS 的价值。
1.5 统计学方法
采用SPSS 22.0 统计学软件处理数据。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,进一步两两组间比较采用LSD-t检验,两组间比较采用独立样本t检验,组内比较采用配对t检验;计数资料以百分率(%)表示,行χ2检验;采用受试者工作特征(ROC)曲线,获取曲线下面积(AUC)、置信区间、敏感度、特异度及cut-off 值;相关性采用Spearman 分析;影响因素采用Logistic 回归模型。P<0.05 为差异有统计学意义。
2 结果
2.1 两组血清MCP-1、sTLR4、ox-AAT 水平比较
与非CAM 组相比,宫缩前CAM 组血清MCP-1、sTLR4、ox-AAT 水平较高,差异有统计学意义(t=18.489、21.422、26.865,均P<0.001);轻度、中度、重度CAM 产妇宫缩前血清MCP-1、sTLR4、ox-AAT 水平比较:轻度<中度<重度,差异有统计学意义(P<0.05)。见表1。
表1 两组血清MCP-1、sTLR4、ox-AAT 水平比较(± s)

表1 两组血清MCP-1、sTLR4、ox-AAT 水平比较(± s)
2.2 EOS 产妇和非EOS 产妇血清MCP-1、sTLR4、ox-AAT 水平比较
EOS 产妇宫缩前血清MCP-1、sTLR4、ox-AAT水平高于非EOS 产妇,差异有统计学意义(P<0.05)。见表2。
表2 EOS 产妇和非EOS 产妇血清MCP-1、sTLR4、ox-AAT 水平比较(± s)
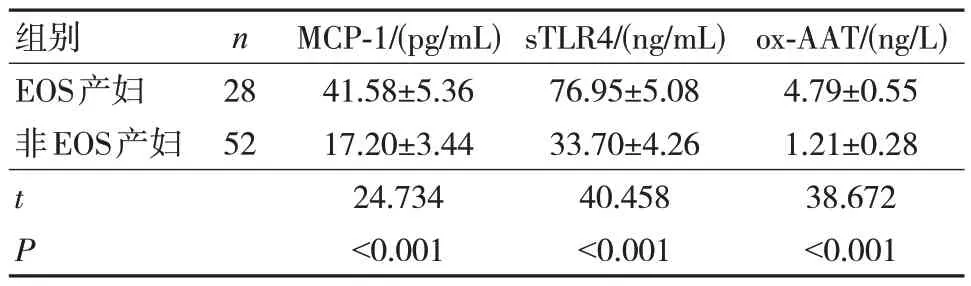
表2 EOS 产妇和非EOS 产妇血清MCP-1、sTLR4、ox-AAT 水平比较(± s)
2.3 血清MCP-1、sTLR4、ox-AAT 水平与合并CAM、CAM 严重程度、发生EOS 的相关性
宫缩前血清MCP-1 水平与合并CAM、CAM 严重程度、发生EOS 呈正相关(P<0.05);宫缩前血清sTLR4 水平与合并CAM、CAM 严重程度、发生EOS 呈正相关(P<0.05);宫缩前血清ox-AAT 水平与合并CAM、CAM 严重程度、发生EOS 呈正相关(P<0.05)。见表3。
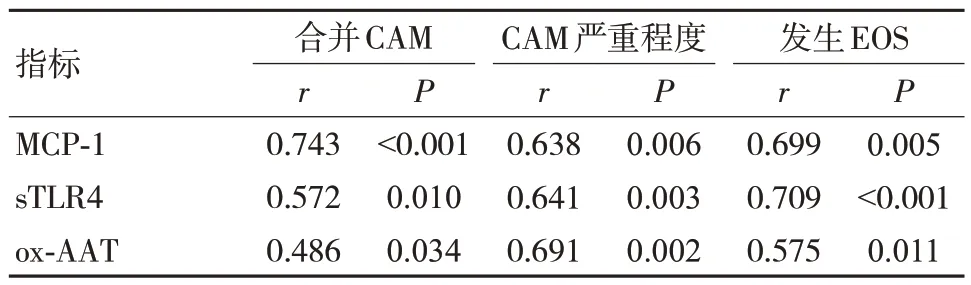
表3 分析血清MCP-1、sTLR4、ox-AAT 水平与合并CAM、CAM 严重程度、发生EOS 的相关性
2.4 偏回归分析新生儿发生EOS 的影响因素
以新生儿是否发生EOS 为因变量,将PROM产妇宫缩前血清MCP-1、sTLR4、ox-AAT 水平作为自变量,对自变量进行赋值(以80 例的平均值为界:≤平均值=1,>平均值=2)。Logistic 回归分析显示,PROM 产妇宫缩前血清 MCP-1(>25.73 pg/mL)、sTLR4(>48.84 ng/mL)、ox-AAT(>2.46 ng/L)水平是新生儿发生EOS 的危险因素。见表4。

表4 偏回归分析新生儿发生EOS 的影响因素
2.5 ROC 分析血清MCP-1、sTLR4、ox-AAT 水平预测新生儿发生EOS 的价值
以新生儿发生EOS 的PROM 产妇为阳性样本,以新生儿未发生EOS 的PROM 产妇为阴性样本绘制ROC 曲线。结果显示,宫缩前PROM 产妇血清MCP-1、sTLR4、ox-AAT 水平联合预测新生儿发生EOS 的AUC 为0.806,最佳诊断敏感度、特异度分别为89.29%、71.15%。见表5。

表5 ROC 分析血清MCP-1、sTLR4、ox-AAT 水平预测新生儿发生EOS 的价值
3 讨论
PROM 为因感染、宫内压异常、胎膜发育不良、子宫功能异常等原因导致的胎膜破裂,如果胎膜破裂超出24 h,增加新生儿产生败血症风险[7]。CAM 为引起PROM 危险因素,已逐渐变成共识,且我国具有较高感染率,多数CAM 者于发病早期无明显典型感染表现,仅有少数晚期患者产生血常规异常、体温升高及阴道分泌物异味等状况[8]。CAM 影响母婴结局,约超出40%CAM 患者发生早产,甚至引起宫内感染、胎儿窘迫、新生儿窒息与早期败血症等[9]。此外,CAM 为引起EOS 独立危险因素,近几年,随医疗技术与护理水平发展,新生儿败血症死亡率有所降低,仍为引起早产儿或者胎膜早破的围产儿死亡重要原因[10]。故早干预、早诊断对于降低死亡率与改善预后具有重要意义。
炎性反应为机体经过识别危险因子后对于创伤、病原菌等危险事件所做出防御反应[11]。警报素为内源性的一类危险因子,能聚集与活化抗原提呈细胞,诱发固有免疫细胞的应答,而高迁移率族蛋白B1(HMGB1)为典型警报素的家族成员之一,其通过和TLR4、RAGE 的受体相结合,参与炎性反应、细胞生物学行为与免疫反应调控等多个生理病理过程,而sTLR4 为其受体于血清中可溶形式[12]。本研究结果显示,CAM 组血清sTLR4 水平高于非CAM 组,且随病情加重而升高,并和CAM 发生、CAM 病情程度呈正相关。其原因可能为,sTLR4 和TLR4 受体的胞外接受域相似,能作诱饵受体来阻断TLR4 和HMGB1 配体相结合,故sTLR4 被作为是TLR4 负调节机制,于炎症时含量升高,能作为急性炎性反应时期的诊断生物标志物。故于CAM 发生过程中,TLR4 介导急性炎性反应能起到更加重要作用。MCP-1 对于单核细胞、巨噬细胞与T 淋巴细胞等具有强趋化活性,遭受促炎因子的刺激时可通过调节多种细胞聚集与迁移来参与炎性反应的发生与发展过程[13]。本研究中,MCP-1 在CAM 组中呈高表达,且随病情加重而升高,与CAM 发生、病情程度成正比。提示MCP 可作为临床辅助诊断CAM 指标之一。α1-AT 能竞争性的抑制胶原酶、胰蛋白酶等分泌,具有抗感染效果,能和NE 处在平衡状况,发挥保护组织作用,ox-AAT 为局部炎症引起α1-AT氧化存在形式,对于炎性反应不具有抑制效果,加快PROM 产生[14]。本研究中,与非CAM 组相比,宫缩前CAM 组血清ox-AAT 水平较高,轻度血清ox-AAT 水平<中度<重度,与合并CAM、CAM 严重程度成正比,提示ox-AAT 可为临床评估CAM 病情指标之一。
EOS 为新生儿在出生7 d 内出现全身炎性反应,起病较为隐匿,且进展快速,尤其是新生儿的免疫系统尚未发育完善,极易引起脓毒血症,甚至严重者可死亡[15]。故早干预、早诊断对于降低新生儿EOS 的死亡率与改善预后有积极意义。本研究中,EOS 产妇宫缩前血清MCP-1、sTLR4、ox-AAT 水平高于非EOS 产妇,且高水平为新生儿EOS 发生的危险因素,此外,ROC 曲线指出,宫缩前血清MCP-1、sTLR4、ox-AAT 水平联合预测新生儿发生EOS 的敏感性与特异性明高高于单一血清,证实MCP-1、sTLR4、ox-AAT 联合应用时可有效预测新生儿EOS 的发生风险,为临床早期制定防治措施提供可靠依据。分析原因为EOS 发生与炎性反应相关,而血清MCP-1、sTLR4、ox-AAT水平均参与炎性反应,故EOS 发生与MCP-1、sTLR4、ox-AAT 存在关联性。
综上所述,PROM 合并HCA 产妇中血清MCP-1、sTLR4、ox-AAT 水平呈高表达状况,联合应用时有效预测新生儿EOS 的发生风险,可为临床早期防治措施的制定起到指导作用。
