大气CO2浓度升高对红豆树苗木光合生理和形态的影响
2023-11-29韦小丽王明彬余大龙
韦 忆,韦小丽,2*,王明彬,王 嫚,余大龙
(1.贵州大学林学院,贵州 贵阳 550025;2.贵州省森林资源与环境研究中心,贵州 贵阳 550025)
据世界气象组织(WMO)报道,CO2作为温室气体主要成分之一,其全球观测值在2020年已升至(413.2±0.2)μmol/mol[1];联合国政府间气候变化专门委员会(IPCC)最新报告指出,未来大气CO2浓度还将持续升高[2]。植物在这样的气候变化下将直接或间接地受到影响,但这一影响在不同物种之间表现出较大的差异[3-4]。多数情况下,当前大气中CO2浓度还不能满足多数植物光合作用所需,因此当环境CO2浓度升高时自然会提高植物光合速率,进而促进植物生长[5-7]。但也有研究认为,将植物长期置于高CO2浓度环境中,其初始出现的光合作用被增强的效果会逐渐减弱,甚至消失,出现“光合适应现象”[8]。植物的叶片形态及其内部组织结构更是影响树木生理过程的重要组成部分[9-10],因此探究植物光合作用和叶片解剖结构在高浓度CO2环境中的变化也十分重要[11]。
红豆树(Ormosiahosiei)是豆科蝶形花亚科红豆属植物,是国家Ⅱ级重点保护植物,为中国特有,在我国南方各省均有分布[12]。但因其自然生境遭到破坏和人类不合理的利用,再加上自身繁衍能力和传播扩散能力较差等因素影响,其现存天然资源不多[13-15]。通过总结现有研究发现,有关红豆树的研究多数集中在优化育苗、造林技术和群落调查等方面[16-17],而关于环境适应性的研究较少,仅在干旱胁迫方面有相关报道[18-19],未见对大气CO2浓度升高的响应和适应性研究。近年来,有学者认为大气CO2浓度升高对豆科4种乔木幼苗生理和生长的影响与其生态特性有关[20-21],其中喜光树种的反应大于耐阴树种。前人对海南红豆树(Ormosiapinnata)的研究发现,大气CO2浓度长期升高(2005—2009年)显著增加其净光合速率并促进了生物量的积累,但这一研究重点关注植物与土壤的碳积累过程[22]。此外,邱浩杰等[23]利用最大熵模型(MaxEnt)模拟4种气候情景下红豆树在末次盛冰期、全新世中期、当代适生区分布格局的变化,其结果表明红豆树在未来的适生面积将大幅减少,特别是在高CO2浓度排放情景(PCR8.5)下,但这只是模型模拟的结果,实际情况的变化尚不清晰。因此,红豆树在大气CO2浓度升高环境下苗期光合生理以及形态变化方面的应对策略是一个值得探讨的课题。为此,本研究通过人工模拟大气CO2浓度升高环境,探究不同CO2浓度升高条件下红豆树苗木在光合特性、叶片结构和表观特征的变化,旨在揭示未来气候变化下红豆树对大气CO2浓度升高的响应策略,以期对其未来的生存状况进行预见分析并采取有效应对措施。
1 材料与方法
1.1 试验材料
供试材料为从贵州省惠水县苗圃基地购买的同一种源的2年生红豆树容器苗。于2021年1月选取长势一致的健壮苗木移栽至装有2.5 kg风干基质的塑料花盆中(口径18 cm,高25 cm),每盆栽植1株,其中盆栽基质按黄心土与珍珠岩体积比3∶1配制,其主要理化性质为:有机质61.17 g/kg、全氮0.86 g/kg、碱解氮73.52 mg/kg、全磷0.52 g/kg、有效磷0.97 mg/kg、全钾14.66 g/kg、速效钾36.56 mg/kg,pH 6.4。在缓苗4个月后选取长势一致且健康的苗木,测定其初始平均株高和地径分别为(58.5±7.0)cm和(7.21±0.90)mm。
1.2 试验设计及观测方法
1.2.1 试验设计
试验设计3个CO2浓度水平,即400(自然CO2浓度,CK)、600(E1)和800 μmol/mol(E2)。将盆栽苗置于开顶式气室(open top chamber, OTC)中,通入工业CO2,气室内的CO2浓度通过CO2传感器装置(GMP-220, 芬兰)控制在目标浓度范围内。每个处理设置3个重复,每个重复13株苗,持续处理146 d(2021年4月17日至9月10日)。于试验前在每盆基质中环状沟施复合肥(N、P、K质量比为15∶4∶6)7 g以保证其营养充足,在试验期间每3天采用喷洒装置均匀浇灌盆栽苗1次,保持土壤湿润,同时及时清除杂草以避免其他因素对试验的干扰。
1.2.2 表观特征指标测定
1)株高、地径:于处理前和处理后,测定各处理中所有苗木的株高、地径,用钢卷尺测量株高(精确至0.1 cm),用数显游标卡尺测量地径(精确至0.01 mm)。株高和地径的净生长量为:处理前株高和地径与处理后株高和地径之差;高径比为处理后株高与处理后地径之比。
2)叶面积及干质量:处理结束后,每重复选取5株标准株的成熟功能叶作为测定材料,用叶面积扫描仪(EPSON V700 Photo)对叶片进行扫描,用图像分析系统(WinSEEDLE)对图像进行分析,整理数据得出不同处理的叶面积。之后,将叶片收集并标号后装信封105 ℃杀青40 min,再在80 ℃下烘48 h至恒定质量,称量得到叶干质量(精确至0.001 g)。比叶重为叶干质量与叶面积之比[24]。
1.2.3 叶片解剖结构测定
处理结束后取标准株的成熟功能叶作为材料,每个处理重复3次取样,将叶片固定于酒精醋酸福尔马林固定液FAA中,24 h后采用常规石蜡切片法[25]切片,番红-固绿染色,切片厚度4 μm;切片通过光学显微镜(Nikon Eclipse,日本)观察,并用显微成像系统(Nikon DS-U3,日本)扫描后以ImageJ软件测定叶片厚度和上表皮(U-ep)、下表皮(L-ep)、栅栏组织(PT)及海绵组织(ST)厚度等指标,精确至0.01 μm。
1.2.4 生理指标测定
1)光合色素含量及光合关键酶活性。在测定光合的植株上取新鲜成熟功能叶作为材料,采用乙醇浸提紫外分光光度法[26]测定叶绿素a(Chl a)、叶绿素b(Chl b)和胡萝卜素(Car)含量,计算总叶绿素(Chl a+b)含量;叶绿素a/b(Chl a/b)为叶绿素a与叶绿素b含量比。同样,将采集的成熟叶片用酶联免疫试剂盒(苏州科铭生物)测定核酮糖-1,5-二磷酸羧化/加氧酶(RuBisCO)及RuBisCO活化酶(RCA)活性,具体操作按试剂盒使用说明书进行。
2)气体交换参数。处理结束后,每重复选取3株标准株,每株随机选取3片成熟功能叶作为测定对象,采用Li-6800便携式光合作用测量系统(美国),于晴天9:00—11:00测定叶片净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr),并计算水分利用效率(EWUE,EWUE=Pn/Tr)。
3)叶绿素荧光参数。处理结束后,每重复选取3株标准株,每株随机选取3片成熟功能叶作为测定对象,采用多通道连续检测调制荧光-Monitorig-PAM(Walz,德国)于20:30后(充分暗适应)诱导叶绿素荧光动力学曲线,获取实际光化学效率[Y(Ⅱ)]、最大光化学效率(Fv/Fm)、光化学淬灭系数(qP、qL)和非光化学淬灭系数(qN、NPQ)。
1.3 数据处理
用Excel 2019进行数据统计,运用SPSS 20.0中单因素方差分析对数据进行差异显著性分析,Duncan法进行多重比较,使用Origin 2022进行图表绘制,试验中红豆树苗表观特征图用Photoshop 2019进行处理。
2 结果与分析
2.1 大气CO2浓度升高对红豆树苗光合生理特征的影响
2.1.1 光合色素含量及关键酶活性
大气CO2浓度升高对红豆树苗叶片的光合色素含量有显著影响(图1a)。叶绿素a含量在E2处理下较E1和CK分别增加3.66%、7.04%;类胡萝卜素含量在E2处理下较E1和CK分别增加22.32%、23.47%,但叶绿素a和类胡萝卜素含量在E1和CK处理之间均差异不显著。叶绿素b含量在E2和E1处理下分别较CK增加12.97%、12.62%;总叶绿素含量在E2和E1处理下分别较CK显著增加8.65%、6.11%,但叶绿素b和总叶绿素含量在E2和E1处理之间差异不显著。此外,与光合色素含量变化趋势不同,叶绿素a/b的值在E2和E1处理下分别较CK处理降低了4.90%、8.44%,但E2和E1之间差异不显著。上述表明,大气CO2浓度升高时,类胡萝卜素、叶绿素a、叶绿素b及总叶绿素的含量增加,但两个高CO2浓度处理之间各指标差异不显著。

图中不同小写字母代表同一指标差异达显著(P<0.05)水平。下同。Significant differences among same index in the representation of lowercase letters in the figure (P<0.05).The same below.图1 不同CO2浓度处理对红豆树光合色素含量及关键酶活性的影响Fig. 1 Effects of different CO2 concentrations on photosynthetic pigment content and key photosynthetic enzymes of Ormosia hosiei seedlings
大气CO2浓度升高对红豆树苗叶片的RuBisCO和RCA活性影响显著(图1b)。其中:RuBisCO活性在不同处理之间差异显著(P<0.05),在E2和E1处理下分别较CK提高了25.11%、12.75%,E2较E1提高10.96%;RCA活性在E2处理下较E1和CK分别提高99.98%、85.36%,但E1和CK之间差异不显著。这说明大气CO2浓度升高有助于提高苗木RuBisCO和RCA活性,其中以E2处理下增幅最大。
2.1.2 气体交换参数
大气CO2浓度升高对红豆树苗气体交换参数有显著影响(表1)。净光合速率和胞间CO2浓度在各处理之间均表现出显著差异(P<0.05),其中,净光合速率在E2和E1处理下分别较CK增加235.40%、104.42%,E2较E1增加64.07%;胞间CO2浓度在E2和E1处理下较CK分别增加97.49%、50.91%,E2较E1增加30.87%;气孔导度在E2和E1处理下分别较CK增加59.48%、43.94%,但E2和E1之间差异不显著;蒸腾速率在E2处理较CK增加39.65%,但E1和CK之间、E2和E1之间差异均不显著;水分利用率在E2和E1处理下分别较CK增加134.19%、61.97%,E2较E1增加44.59%。总体上看,大气CO2浓度升高尤其是升高至E2水平时能显著增加红豆树叶片净光合速率和胞间CO2浓度,并显著提高其水分利用效率。
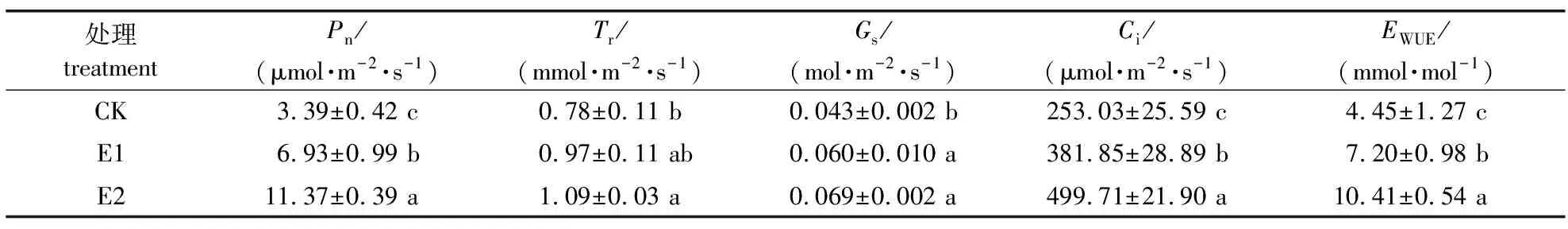
表1 不同CO2浓度处理对红豆树苗气体交换参数的影响
2.1.3 叶绿素荧光参数
不同CO2浓度处理对红豆树苗最大光化学效率(Fv/Fm)有显著影响,而对实际光化学效率[Y(Ⅱ)]的影响不显著(图2)。其中,Fv/Fm在E2处理下分别较E1和CK显著降低了22.38%、29.46%,E1较CK降低了9.12%。此外,红豆树在环境CO2浓度升高条件下,其光化学淬灭系数(qP、qL)非光化学淬灭系数(qN、NPQ)的变化也不同,qP和qL在E2处理下分别较CK显著增加了44.30%、134.84%,但E1与CK之间差异不显著;同时,qN和NPQ在各处理间差异均不显著。上述结果表明,大气CO2浓度升高降低了红豆树潜在光合能力,却显著提高了红豆树光系统Ⅱ(PSⅡ)的实际光合能力; CO2浓度升高还显著增强了红豆树的光合活性,而热耗散能力(光保护能力)不受影响。
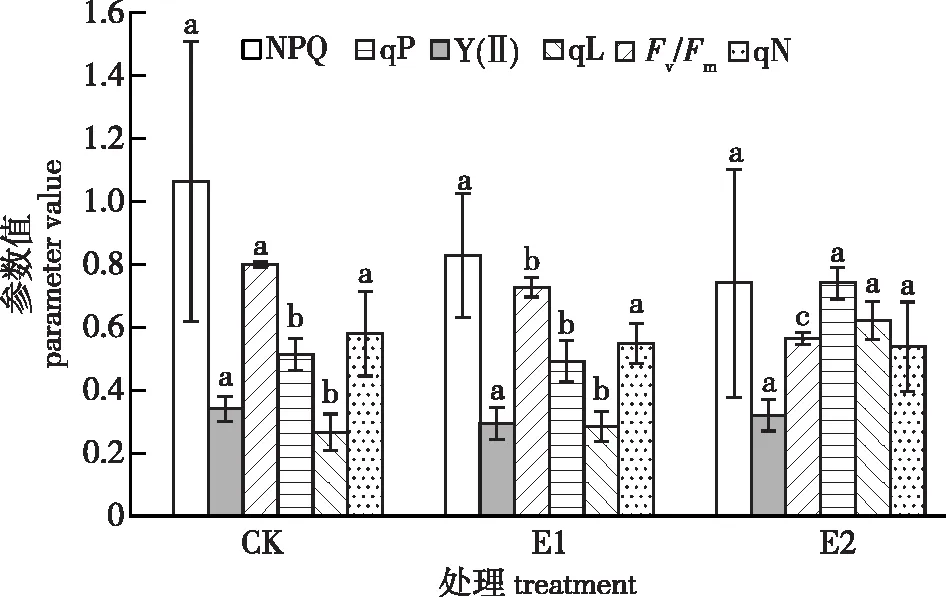
图2 不同CO2浓度处理对红豆树叶绿素 荧光参数的影响Fig. 2 Effects of different CO2 concentrations on Chlorophyll fluorescence parameters of O. hosiei seedlings
2.2 大气CO2浓度升高对红豆树苗叶片结构的影响
通过对红豆树苗叶片解剖结构的观察,红豆树叶片具有明显的上表皮、下表皮、栅栏组织和海绵组织,其中栅栏组织由1层长型细胞整齐排列而成,海绵组织由多层细胞松散随机排列而成,具有较大的细胞间隙(图3)。红豆树叶片的上、下表皮厚度在不同CO2浓度环境差异不显著,但其栅栏组织、海绵组织厚度差异显著(P<0.05)(图3)。栅栏组织厚度在E2和E1处理下分别较CK增加23.94%、20.27%,E2和E1之间差异不显著;海绵组织厚度在E2和E1处理下分别较CK显著减少93.07%、69.53%,E2较E1减少13.88%。由于海绵组织厚度随CO2浓度升高而降低趋势大于栅栏组织厚度增加趋势,因此叶片厚度在E2处理下较E1和CK减少31.39%、34.47%,但E1和CK之间差异不显著(P>0.05)。可见,红豆树叶片通过增加栅栏组织厚度、降低海绵组织厚度来适应高CO2浓度环境。

图3 不同CO2浓度处理对红豆树叶片解剖结构的影响Fig. 3 Effects of different CO2 concentrations on leaf anatomical structure of O. hosiei seedlings
2.3 大气CO2浓度升高对红豆树苗表观特征的影响

图4 不同CO2浓度处理下红豆树表观特征Fig. 4 The apparent characteristic of O. hosiei seedlings under different CO2 concentrations
不同CO2浓度处理对红豆树苗表观特征的影响如图4所示,其株高、地径的净生长均随环境CO2浓度升高而增加(表2)。在E2处理下株高净生长量较E1和CK分别显著增加5.76%、6.90%(P<0.05),但E1和CK之间差异不显著;在E2和E1处理下地径净生长量分别较CK增加13.35%、8.32%,E2较E1增加4.64%;但在E2和E1处理下高径比分别较CK减少6.34%、10.19%,E1和E2之间差异不显著。
在高CO2浓度环境中红豆树苗叶面积显著增加,比叶重显著降低(P<0.05),但其叶干质量差异不显著(表2)。其中,在E2和E1处理下叶面积分别较CK增加64.94%、28.78%,E2较E1增加28.09%;比叶重在E2和E1处理下分别较CK减少31.68%、24.26%,但E2和E1之间差异不显著。表明红豆树苗通过增加叶面积、降低比叶重来适应高CO2浓度环境。

表2 不同CO2浓度处理对红豆树表观特征的影响
3 讨 论
3.1 红豆树苗光合生理对大气CO2浓度升高的响应
光合作用是绿色植物通过吸收光能、同化CO2和水,并制造有机物释放氧气的过程[27],其中光合色素含量及构成与植物对光能吸收和传递的能力息息相关[28],以往研究中,当环境CO2浓度较高时,植物叶片中的光合色素含量因物种不同而存在差异[29],如马尾松(Pinusmassoniana)幼苗在高浓度CO2处理下叶绿素含量显著降低[30],而何平[31]研究发现升高环境CO2浓度促进了油桐(Verniciafordii)叶绿素含量增加,但对烟草(Nicotianatabacum)影响不大。本试验结果显示,在高CO2浓度环境下有助于促进红豆树叶绿素和类胡萝卜素的合成,尤其是叶绿素b。这样的结果有可能促进植物产生更多的捕光色素蛋白复合体,进而增强叶绿体对光能的吸收[32-33]。同时,有研究认为与非豆科植物相比,豆科植物特有根瘤及时补充了高CO2浓度条件下植物所需氮素,为其叶绿素合成提供充足氮素[34],而这是否为红豆树苗叶绿素含量升高的原因有待进一步研究。
核酮糖-1,5-二磷酸羧化/加氧酶(RuBisCO)和RuBisCO活化酶(RCA)的活性提高是植物光合速率提升的重要途径[35-36]。多数研究认为,长期处于高CO2浓度环境中的植物会因氮素缺乏而采取养分最优分配导致光合关键酶的活性降低[8],而短期处于该环境中则使其叶片的碳交换速率加快,从而显著提高植物光合关键酶的活性[37]。本试验结果与多数短期试验结果一致,在高浓度CO2环境中,红豆树苗的RuBisCO和RCA活性均显著高于对照组。此外,当前因多数C3植物的胞间CO2浓度未达到饱和状态,所以当升高环境中CO2浓度时将促进多数C3植物在其细胞间保持较高CO2浓度水平[5,37],植物胞间CO2浓度升高则有助于提高CO2与O2的比值,减少O2对RuBP的竞争,促进RuBisCO羧化反应,进而促进光合作用[38]。本试验中红豆树苗的胞间CO2浓度在高CO2浓度环境中也与多数C3植物的响应一致,最终促使其净光合速率在高浓度CO2的2个处理中较CK大幅提高了1~2.4倍。叶片气孔是植物气体交换的重要通道[39],升高CO2浓度时,气孔导度的响应在不同物种之间差异显著。多数研究表明,CO2升高将降低植物气孔导度[40-41];但也有相反的结论,如木荷(Schimasuperba)响应高浓度CO2环境2个月时会出现其气孔导度升高现象[29],有关枸杞(Lyciumchinense)的研究也得出相同结论[42]。本试验中红豆树叶片的气孔导度在高浓度CO2环境中显著增加,促进了叶片对CO2和水分的交换,进而提高了光合速率。目前关于环境CO2浓度升高后气孔导度上升原因的报道较少,Sreeharsha等[43]认为这样的结果可能是由于CO2浓度升高改变了保卫细胞信号传导模式,并且在CO2处理的同时伴随着环境温度的升高,也可能导致植物叶片保持较高气孔导度[44],但其具体原因还需进一步探究。此外,红豆树苗蒸腾速率在高CO2浓度环境中的增加小于净光合速率的增加,因而其水分利用率显著升高,表明红豆树通过减缓蒸腾速率,加快光合速率的增长而适应高CO2浓度环境。
光系统Ⅱ(PSⅡ)是植物光合作用过程中受环境影响的最初位点[45]。1931年,Kuatsky等曾发现PSⅡ天线中特殊叶绿素a的荧光诱导现象,并将此与光合作用联系起来,之后便促生了叶绿素荧光的相关理论,并广泛运用于光合作用研究[46-47]。Fv/Fm是反映各种胁迫下植物光合作用受抑制程度的重要指标[48];Y(Ⅱ)反映实际光合能力的强弱;qP、qL是基于不同模型计算的光化学淬灭系数,反映了PSⅡ天线色素吸收光能用于光化学电子传递份额,也用来反映其开放程度[49];qN、NPQ反映以热耗散消耗多余光的能力[50]。在现有研究中,环境CO2浓度升高对植物叶绿素荧光参数的影响因物种不同而不同[51]。本研究结果显示,当大气CO2浓度升高至较高水平将使红豆树Fv/Fm的值降低,但其Y(Ⅱ)的变化不显著。张仟雨等[45]研究大豆对升高CO2浓度的响应也有相同结果,认为其原因可能是PSⅡ反应中心受到破坏。本研究中大气CO2浓度显著增加了红豆树的光化学效率,对非光化学效率的影响不显著,这表明环境CO2浓度升高增加了红豆树PSⅡ的光化学电子传递比例和开放程度,增强了其实际光合能力,但其热耗散能力受环境CO2浓度升高的影响不显著,前人研究CO2浓度升高对银杏的影响也得出高CO2浓度将有利于其叶绿素将光能转化为化学能[52]。
3.2 红豆树苗叶片结构和表观特征对大气CO2浓度升高的响应
多数植物的叶片厚度随环境CO2浓度增加而增厚[53],但也有较少植物种叶片厚度表现出变薄趋势[54]。通过对红豆树叶片解剖结构的观察发现,红豆树苗叶片的栅栏组织厚度随环境CO2浓度升高而变厚,海绵组织厚度则随之变薄,但由于栅栏组织的变化幅度小于海绵组织,因此红豆树苗的叶片厚度在高浓度CO2环境中总的来说变得更薄,这与本试验中比叶重值的变化一致。植物叶片在高浓度CO2环境中表现出的这些特点有利于增加其叶绿体数量,缩短CO2在叶内传导的距离,使其具有更强的光合能力[55]。此外,Pritchard等[53]综合分析了多个升高CO2浓度对植物叶面积的变化研究发现,58%的植物叶面积都随环境CO2浓度升高而增大,本试验结果与这些研究结果一致。因此,在高CO2浓度环境中红豆树苗从叶片形态和光合生理方面均表现出较高光合能力,最终促进了其株高和地径的生长。但由不同CO2浓度对其高径比的影响发现,红豆树苗在高浓度CO2环境下茎的伸长生长小于增粗生长,因而高径比降低。
总之,在本研究中,大气CO2浓度升高增加了红豆树光合作用底物,提高了其光能捕捉和利用能力,光合活性增加而光保护能力不受影响,叶片随CO2浓度升高产生适应性变化,红豆树通过生理和形态的协同作用促进了其生长。这系列响应与那些因长期大气CO2浓度增加而出现光合下调的树种相比,是否更适应于未来的气候变化,成为在未来提高森林碳汇的潜力树种,需要在后续研究中探明红豆树对长期CO2浓度升高环境的响应。
