紫荆种子吸胀和层积过程中不同相态水分变化的核磁共振检测
2023-11-29解志军朱长红李淑娴
宫 楠,祖 鑫,解志军,朱长红,李淑娴*
(1.南京林业大学林草学院,南方现代林业协同创新中心,江苏 南京 210037; 2.襄阳市林业科学技术推广站,湖北 襄阳 441022)
种子萌发是植物生命周期的开始,也是最重要的阶段。种子萌发过程包括吸水、萌动和发芽3个阶段[1]。只有吸水后种胚活细胞内部的蛋白质、酶等大分子物质和细胞器才会陆续发生水合作用,为种子萌发提供必要的营养物质。
随着科学技术的发展,低场核磁共振(low-field nuclear magnetic resonance, L-NMR)技术因其具有快速、准确和无损动态监测水分分布情况的特点,在农业和食品领域中得以广泛应用[2]。NMR技术是指具有特定磁矩的原子核(一般指1H)在恒定磁场和交变磁场的作用下,发生能级跃迁、产生共振信号的一种物理过程[3]。其中样品的自旋-自旋弛豫时间(即横向弛豫时间T2)的长短反映了水分的自由度,弛豫时间越短,弛豫谱上对应的峰位置就越左,水分的自由度越低,相反水分的自由度则越高[4],因此可以通过T2弛豫谱中波峰的位置来判断样品中水分的相态。牟红梅等[5]应用核磁共振技术发现小麦(Triticumaestivum)灌浆过程中麦穗存在结合水(1~15 ms]、半结合水(15~100 ms]和自由水(100~500 ms]3种相态的水,结合水的含量随籽粒干物质的增加而持续增大。付晓记等[6]利用核磁共振技术发现花生(Arachishypogaea)浸种期间,结合水弛豫时间和幅值变化不大,但自由水的信号幅值增强,弛豫时间向右偏移,说明浸种期间自由水含量增加,水分流动性增强。Lechowska等[7]在油菜(Brassicanapus)种子的吸水萌发过程中发现存在4种不同的相态,前2 h种子内各相态水分变化幅度最大,整个吸水过程主要发生变化的为结合水。Bai等[8]发现在苦荞(Fagopyrumtataricum)种子萌发过程中存在强结合水(弛豫时间0.1~0.2 ms)、弱结合水(弛豫时间2~6 ms)、难流动水(弛豫时间21.5~37.6 ms)及自由水(弛豫时间115~351 ms)4种相态,且在整个过程中强结合水变化不明显,萌发结束时仅增加20%,而其他3种相态的水分显著变化。NMR技术虽在种子科学技术中有一定应用,在林木种子领域也有少量研究,但对具有休眠特性的种子在吸胀、层积过程中水分相态变化的研究尚未见报道。
紫荆(Cercischinensis)为豆科(Caesalpiniaceae)紫荆属(Cercis)落叶灌木,花紫红色,颜色艳丽,是春季主要园林观赏树种之一[9]。紫荆的叶、花、树皮可入药,因此紫荆的药用价值也很高[10]。紫荆可采用分株、压条、组培等繁殖方式,但在生产上主要以播种繁殖为主[11]。紫荆种子种皮透性差且种皮与胚乳中存在发芽抑制物,因此紫荆种子具有综合休眠特性(物理休眠+生理休眠),需热水浸种后再低温层积以解除其休眠[12]。紫荆种子前期研究主要集中在种子休眠特性和解除方法,而对于种子解除休眠和吸胀萌发过程中水分相态变化的研究较少。本研究采用低场核磁共振技术对紫荆种子吸胀、层积过程中水分相态的变化进行测定,再结合营养物质含量的变化,探究不同相态的水分在种子吸水萌发过程中的作用,以期为紫荆种子萌发过程中各相态水分与物质变化研究提供参考。
1 材料与方法
1.1 试验材料
紫荆种子于2020年11月采集于山东临沂,净种并采用水选法去除空粒、瘪粒和虫害粒,置于4 ℃冰箱保存。种子千粒质量为26.46 g,种子含水率为10.34%,硬实率高达78.20%。
1.2 试验方法
1.2.1 紫荆种子吸水率测定
随机选取紫荆种子150粒,3次重复,称质量后置于烧杯中,用80 ℃热水恒温浸泡5 min后,使其自然冷却吸胀,分别于浸种0、3、6、9、12、15、18、24、30、36、48 h 时取出种子,擦拭种子表面水分后称质量,对照为干种子直接置于装有清水的烧杯中进行浸种。按下式计算种子的吸水率并绘制吸水曲线。
式中:p为吸水率;m为未浸种种子的质量,g;m1为吸水后各测定时间点种子的质量,g。
1.2.2 紫荆种子休眠的解除及发芽率测定
随机选取热水处理后解除硬实性的紫荆种子,吸水24 h后将其与湿沙按1∶3的体积比混合,湿沙湿度以手握成团、一触即散为宜,置于塑料发芽盒(13 cm ×19 cm ×12 cm)中,在4 ℃的冷库中低温层积,层积期间要经常检查水分状况,保持沙子处于湿润、通气状态。分别于层积0 d(S0)、15 d(S15)、30 d(S30)、45 d(S45)、60 d(S60)时,随机取出30粒种子,3次重复。将发芽盒底部铺设双层滤纸加一层脱脂棉做成发芽床,使用蒸馏水将发芽床完全浸湿后,将取出的上面5个层积阶段的种子置于发芽床上,放入25 ℃的光照培养箱中进行发芽率测定实验。
1.2.3 弛豫谱峰面积与紫荆种子含水量关系的构建
NMR技术的横向弛豫时间T2弛豫谱峰面积与样品中氢质子的数量成正比,故可以通过峰面积大小反映水分质量的多少。参照宋平等[13]的方法将传统的质量信号转换成核磁信号,再通过回归分析,构建T2弛豫谱峰面积与水分质量的回归方程,运用决定系数R2校验方程的拟合效果。
1.2.4 紫荆种子吸胀及层积过程中水分相态及含量变化的测定
1)吸胀阶段种子水分相态变化的测定:随机选取热水处理5 min后明显吸胀紫荆种子30粒,重复3次,用吸水纸擦拭表面水分后置于玻璃试管中,在低场核磁共振仪中进行检测(吸水0 h)。测定后,立刻将种子放入清水中继续浸种,分别于吸水3、6、9、12、15、18、24 h时取出种子,擦干种子表面的水分后置于玻璃试管中再次测定,直至吸水24 h为止。测定所用设备的型号:MesoMR23-060H-1(苏州纽迈分析仪器股份有限公司);磁体强度0.5 T;射频脉冲频率21.24 MHz;探头线圈直径25 mm;磁体温度32 ℃。测定时,采用自旋回波技术(CPMG)脉冲序列,并利用联合代数迭代(SIRT)进行反演,迭代次数为10 000,最终得到T2弛豫图谱。CPMG脉冲序列主要参数有:主频为21 MHz;偏移频率为240 068.61 Hz;90°脉冲射频脉宽为5.52 μs,180°脉冲射频脉宽为11.04 μs;信号采样点数为720 024,重复采样等待时间为4 000 ms,重复采样次数为32,回波时间为0.2 ms,回波个数为18 000。
2)不同层积阶段种子水分相态变化的测定:种子按照1.2.2的方法进行低温层积,分别于S0、S15、S30、S45、S60时取出种子,擦拭干净后放入低场核磁共振仪中测定水分相态及其含量。
1.2.5 紫荆种子层积解除休眠过程中营养物质含量的测定
分别于S0、S15、S30、S45、S60时取出紫荆种子,擦干表面污物和水分,每次称取0.7 g样品(约30粒),重复3次,采用蒽酮比色法测定可溶性糖含量,蒽酮乙酸乙酯法测定淀粉含量,考马斯亮蓝法测定可溶性蛋白含量[14]。
1.3 数据分析
用Excel 2021对试验数据进行整理,Origin 2022b进行制图,并采用SPSS 17.0对各测定指标进行数据处理和方差分析。
2 结果与分析
2.1 解除硬实性后紫荆种子的吸水特性
紫荆种子的吸水曲线如图1所示。热水处理解除硬实性后种子的吸水率远高于对照组。根据热水处理后紫荆种子吸水速率的不同,可将吸水曲线划分为3个阶段:(0,9] h阶段,种子快速吸水阶段,3 h时种子吸水率仅为12.10%,6 h时吸水率迅速增加至58.79%,9 h时吸水率达76.42%,较3 h时增加了64.32%;(9,24] h阶段,种子吸水速率逐渐减慢,24 h时吸水率为96.42%,较9 h时仅增加20%,且各测定时间点的结果间差异不显著;24 h后种子进入平衡吸水期,各测定结果间的吸水率无显著差异,因此紫荆种子在吸水24 h时达到饱和状态。对照种子的吸水率大致分成两个阶段:0~18 h时吸水速率较快,18 h吸水率为14.62%,远低于同时期热水处理后种子的吸水率;随后种子的吸水速率变慢,48 h时吸水率仅为18.51%。

图中不同小写字母表示同一处理在α = 0.05水平下差异显著。下同。The different lowercase letters in the figure indicate significant difference at 0.05 level for the same treatment. The same below.图1 紫荆种子的吸水曲线Fig. 1 Absorption curves of Cercis chinensis seeds during imbibition
2.2 层积过程中紫荆种子的发芽率
S0处理时紫荆种子发芽率仅为26.67%,S30处理时发芽率可达54.44%,是S0的2倍。S45处理时发芽率为56.67%,与S30时差异不显著。随着层积时间的延长,发芽指数持续增加,S30时发芽指数已由对照的0.70增加到1.29,增加了83.73%,S60处理时发芽指数达到最大值1.70,较对照增加了141.58%。总的来说,随着层积时间的延长,种子萌发速度更快、更整齐,层积处理可有效解除休眠,促进其萌发。根据紫荆种子层积不同阶段发芽率的结果,将S0—S30划分为层积前期,S30—S60划分为层积后期。
2.3 核磁共振T2弛豫峰面积与紫荆种子水分质量的关系
紫荆种子核磁共振T2弛豫谱峰面积与水分质量的拟合曲线见图2。在显著水平α=0.05进行回归分析,发现紫荆种子水分质量与峰面积之间具有明显的线性关系,其线性回归方程为y= 164 604.7x+ 4 962.3,其中,y为核磁共振T2弛豫谱峰面积,x为样品的水分质量。R2= 0.999 6,方程拟合程度较好,紫荆种子核磁共振T2弛豫谱峰面积与其水分质量具有较好的相关性。
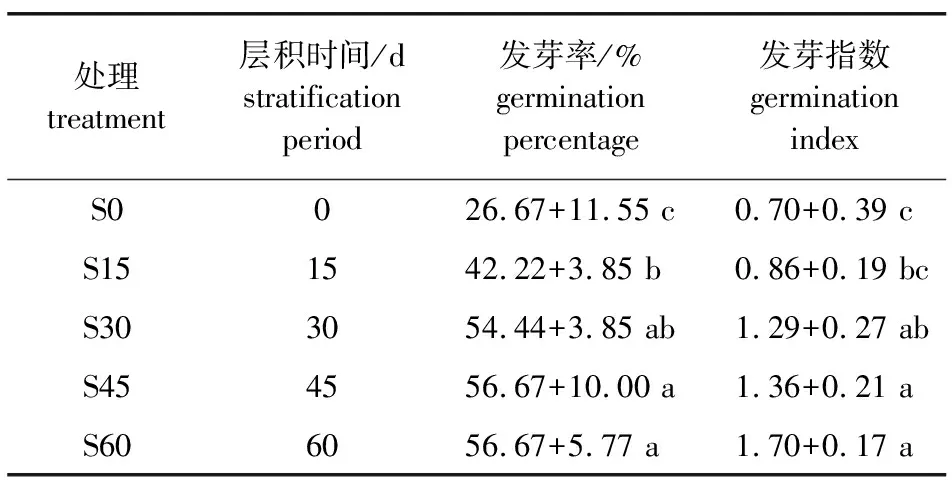
表1 紫荆种子层积过程中发芽率的变化
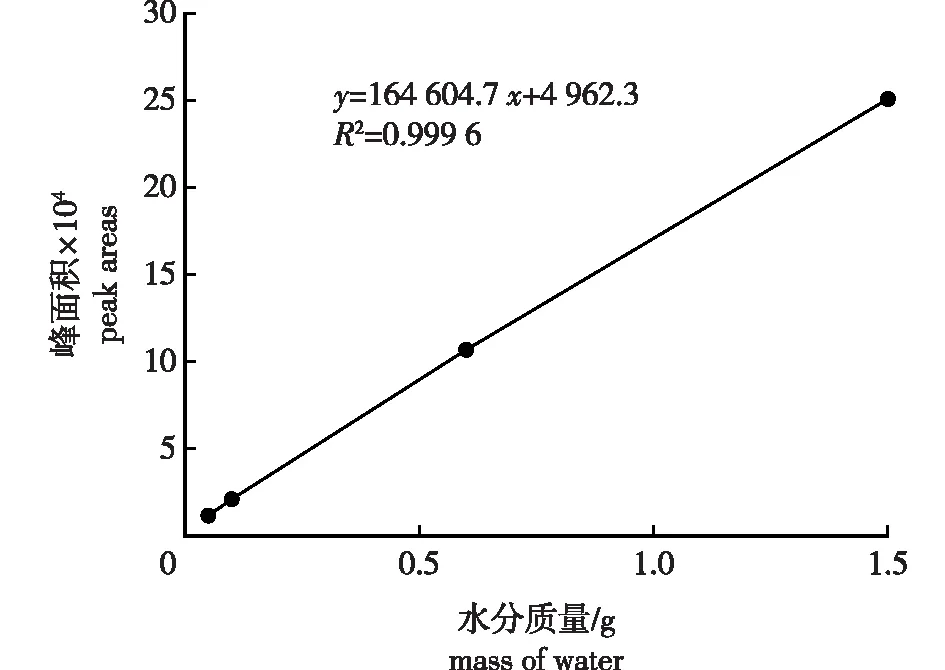
图2 紫荆种子T2弛豫峰面积与水分质量的回归关系Fig. 2 Regressive relationship between the peak areas of T2 NMR relaxation spectrum and water mass of C. chinensis seeds
2.4 紫荆种子吸胀过程中水分相态的变化
2.4.1 水分相态的划分
对紫荆种子吸胀阶段进行水分分布状况的动态监测发现,此过程中T2弛豫范围主要是0.01~1 000 ms(图3)。整个吸胀过程出现过3种相态的水分,将最短弛豫时间(0.01~1.00] ms部分的组分定义为束缚水(bound water)T2a,这部分水通过氢键与生物大分子如蛋白质、淀粉等相结合,流动性差,其信号幅值用A2a表示;较长弛豫时间(1~200] ms部分的组分定义为自由水(free water)T2b,此相态水为游离状态,在细胞内外可以自由流动,其信号幅值用A2b表示;弛豫时间(200,1 000] ms最长部分的组分为刚进入种子中的水分,将其定义为T2c,这部分水的流动性极强,比自由水活性还大,其信号幅值用A2c表示;整个弛豫范围的总水分定义为T总,用A表示紫荆种子的总水分含量,A=A2a+A2b+A2c。

图3 紫荆种子在吸胀过程中的T2反演图谱Fig.3 Spectrum inversion of transverse relaxation time T2 of C. chinensis seeds during imbibition

图4 紫荆种子吸胀过程中各水分相态峰顶点时间、峰面积及峰比例的变化Fig. 4 Changes in peak time, peak areas and peak proportion of each water phase in C. chinensis seeds during imbibition
由图3还可以发现,不同吸水阶段,T2弛豫谱波峰位置并不相同,也就是说水分相态有较大差异:0 h时T2弛豫谱有2个明显的波峰,即此时存在2种不同相态的水,从左到右各峰值所在区间T2弛豫时间分别为T2a、T2b;吸水3 h时,T2弛豫谱仍是有2个明显的波峰,但波峰位置明显不同,此时虽然仍存在束缚水T2a,但与自由水T2b区分不明显,也就是说不能将束缚水和自由水严格区分开来。同时弛豫谱出现了新的波峰T2c;吸水6 h以后,所有的T2图谱均存在2个明显的波峰T2b、T2c,各峰顶点虽然明显右移,但波峰位置比较稳定。
2.4.2 各相态水分的变化规律
紫荆种子吸胀过程中各相态水分峰顶点时间的动态变化见图4a。吸水0~3 h过程中,束缚水含量虽呈减少趋势,但因3 h时束缚水与自由水的峰区分不明显,故无法比较T2a峰顶点时间、峰面积和峰比例的变化,此过程中自由水T2b的峰顶点时间大幅下降。3 h后,紫荆种子中出现了T2c,且T2b和T2c的峰顶点时间均呈持续增加的趋势,但T2b各测定时间点差异不显著,T2c变化幅度较大:12、24 h时T2c的峰顶点时间较3 h时分别显著增加了26.30%、59.45%。整个吸胀过程中T2b和T2c两个峰均向右偏移,说明这一阶段,水分的自由度变高,水分的流动性增强。
紫荆种子吸胀过程中各相态水分峰面积变化如图4b所示。吸胀过程中T2b峰面积先迅速增加再趋于缓慢变化:0~3 h阶段,由于种子内的束缚水向自由水转化,故T2b峰面积大幅度增加,增加了86.84%;3~6 h阶段,峰面积虽然仍是显著增加,但幅度明显减小,较3 h时仅增加了15.10%;随后至24 h时,峰面积一直处于缓慢变化中,各测定结果间差异不显著。而在此过程中,T2c峰面积一直呈持续增加的变化趋势:吸胀24 h时峰面积增至7 993.42,比3 h时增加了294.37%。T总的变化趋势与T2b峰面积的变化相同。
峰比例的变化趋势与峰面积类似(图4c),T2b峰比例呈先迅速上升再缓慢下降的变化趋势:3 h时峰比例达到最大值98.02%,较0 h时显著增加了119.83%;24 h时峰比例下降至93.79%,比3 h时的最高点下降了4.32%。而此阶段T2c峰比例仍呈持续增加的变化趋势,24 h时峰比例升至最高值6.21%。总之,整个吸胀过程,种子内的水分绝大部分(超过90%)为自由水,由于种子的持续吸水使种皮得以软化,后期吸收的水分,较多地充满了种皮和维管束等组织的间隙,因而T2c的比例有所增加。
2.5 紫荆种子层积过程中各相态水分的变化规律
对紫荆种子层积过程中水分相态进行动态监测发现,其T2图谱有2个明显的波峰,即存在2种不同相态的水(图5)。根据水分相态划分的标准,将层积过程中水分的相态分为T2b和T2c。
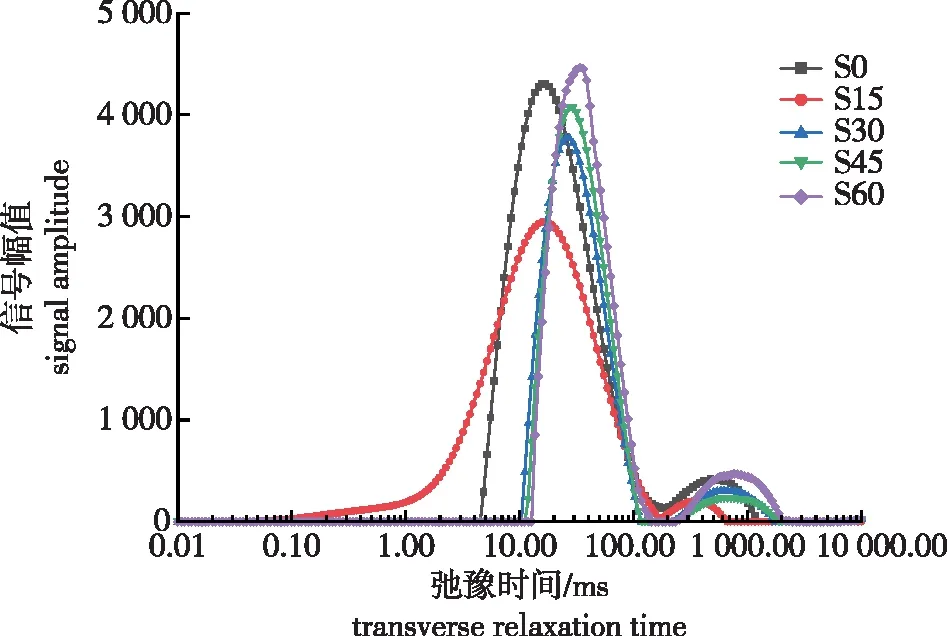
图5 紫荆种子在层积过程中的T2反演图谱Fig. 5 Spectrum inversion of transverse relaxation time T2 of C. chinensis seeds during stratification

图6 紫荆种子层积过程中各相态水分峰顶点时间、峰面积及峰比例的变化Fig. 6 Changes in peak time, peak areas and peak proportion of each water state in C. chinensis seeds during stratification
紫荆种子层积过程中峰顶点时间的动态变化见图6a。总的来说,层积过程中T2b的峰顶点时间呈持续上升的变化趋势:S0时T2b峰顶点时间为15.70 ms;S15时峰顶点时间略有增加,但差异不显著;S30时显著增加至24.67 ms,较S0时增加了57.15%;S45时T2b的峰顶点时间继续显著增加至28.35 ms;S60时再次急速增加至峰值34.97 ms,较S30时增加了41.72%。层积过程中,T2c峰顶点时间呈先下降后上升的波动变化趋势:S0时T2c峰顶点时间为462.30 ms;S15时峰顶点时间下降至349.10 ms,较S0时下降了24.49%;随后各层积阶段各峰顶点时间均呈上升趋势,于S60时到达峰值778.26 ms,较S30时显著增加了29.41%。总的来说,随着紫荆种子层积时间的延长,T2b、T2c的峰顶点时间呈增加的趋势,即峰顶点向右偏移,说明层积过程中水分的流动性在逐渐增强。
紫荆种子层积过程中T2b和T2c以及T总峰面积的动态变化如图6b所示。T2b峰面积呈先下降再上升的变化趋势,各结果间差异显著。S0时T2b峰面积为120 811.17,S30时下降至108 633.39,较S0时下降了10.08%;层积后期T2b峰面积持续增加,S60时增至最大值128 642.44,较最低值S30增加了18.42%。层积过程中T2c呈“下降—上升—下降—上升”的波浪上升趋势,各相邻阶段的结果差异显著:S0时峰面积为7 979.10;S15时峰面积下降至2 519.15,下降了68.43%;S30时T2c峰面积急速增加,略高于S0,但二者差异不显著;S45时T2c峰面积再次下降,较S30时下降了36.22%,但仍高于之前的最低值S15;S60时峰面积再次上升至峰值,较之前的S30时峰值增加了41.64%。层积过程中,T总呈先下降再缓慢上升最后快速上升的变化趋势,S15时较S0显著下降了11.50%,随后显著上升,但一直显著低于S0,直到S60时再次快速增加至最大值,较S0显著增加了9.98%。
T2b的峰比例呈“上升—下降—上升—下降”的波浪下降趋势(图6c),且相邻两阶段结果差异显著:S0时紫荆种子中T2b峰比例为93.79%;S15时增至97.79%,较S0时增加了4.27%;S30时峰比例急剧下降,且显著低于S0;S45时峰比例再次上升,较S30时增加了4.87%;随后S60时峰比例迅速下降至最低值90.83%。T2c的峰比例变化趋势与T2b完全相反且变化幅度更为剧烈:S15时峰比例从6.21%迅速下降至2.21%,较S0时下降了64.41%;S30时峰比例急速上升至峰值且显著高于S0;S45时T2c峰比例下降至4.87%,比S30时下降了37.56%;S60时峰比例再次上升至峰值,其值显著高于之前的峰值S30,且较S30时增加了17.67%。上述结果说明,层积过程中紫荆种子T2b和T2c的峰面积和峰比例在波动变化,但最终还是使水分向流动性更强的趋势发展。
2.6 紫荆种子层积过程中营养物质含量的变化
休眠解除过程中,种子内部生理代谢增强,大分子有机物一方面不断氧化分解为种子萌发供能,另一方面转化为可被直接吸收利用的小分子营养物质,在种子萌发过程中发挥重要作用。由图7a可知,层积过程中淀粉含量呈逐渐减少的变化趋势,S0时淀粉含量最高,达到38.16 mg/g;S30时下降至26.10 mg/g,比S0显著下降了31.59%;层积后期,淀粉含量虽仍持续下降,但差异不显著。
层积过程中可溶性糖含量整体呈上升趋势(图7b),S0时含量为12.29 mg/g;S15时略微增加,但二者差异不显著;S30时含量迅速增加,比S0时增加了84.46%;至S45时,含量增加至峰值26.62 mg/g,比S0时增加了116.60%;随后可溶性糖含量略微下降,但层积后期(30~60 d)各结果间差异不显著。
层积过程中可溶性蛋白含量呈“上升—下降”的变化趋势(图7c):S0时含量较低,为7.35 mg/g;S15时急速增至峰值20.20 mg/g,比S0时增加了174.61%;随后含量缓慢下降,但仍显著高于S0,层积后期含量差异不显著;S60时含量为13.27 mg/g,较峰值显著下降了34.29%。
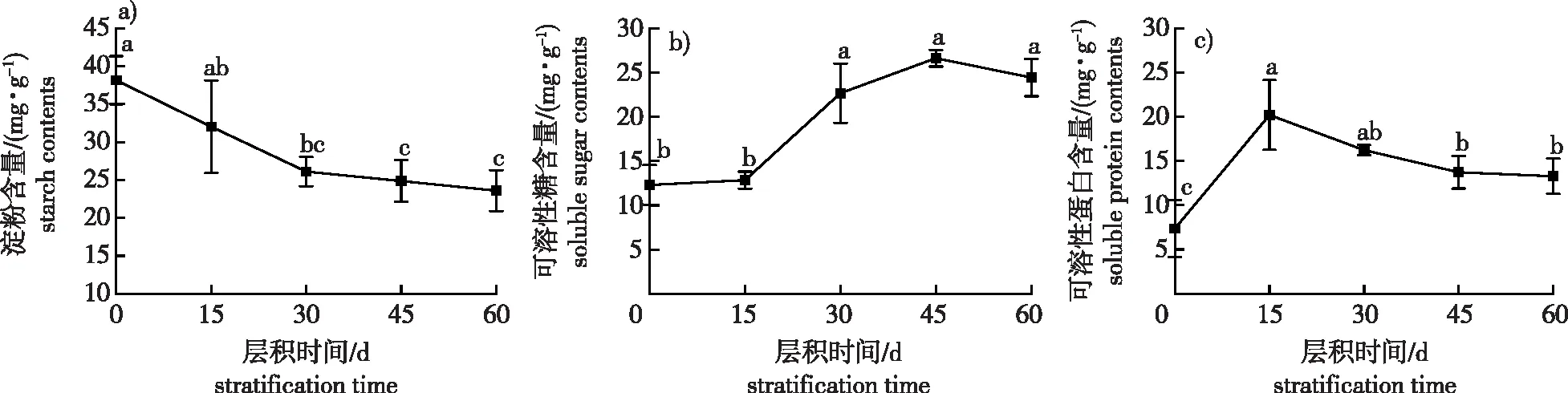
图7 紫荆种子层积过程中营养物质含量的变化Fig. 7 The changes in nutrient contents of C. chinensis seeds during stratification
3 讨 论
3.1 紫荆种子吸胀过程中弛豫谱波峰数量的变化
种子中营养物质的种类不同,氢质子所受的化学键力也不相同,因而通过NMR技术可以测得种子中水分弛豫时间的差异[7]。根据弛豫谱波峰位置的差异,可以将水分划分成不同相态。本研究发现热水处理后的紫荆种子(吸水0 h)内存在束缚水(T2a,弛豫时间0.01~1.00 ms)和自由水(T2b,弛豫时间≥1~200 ms),但随着种子的不断吸水,束缚水逐渐减少,这与糙米[15]、合欢(Albiziajulibrissin)[16]等种子吸水过程中束缚水的变化趋势大致相同。而袁鸣等[17]则发现刺槐种子内部的水分分为3个相态:束缚水(弛豫时间0.1~1.0 ms)、不易流动水(弛豫时间≥1~100 ms)和自由水(弛豫时间≥100~1 000 ms)。Troutman等[18]认为不同种子其营养物质的组成不同,氢质子所受的化学键力也不相同,因而弛豫谱波峰的数量也会有差异。吸水3 h后紫荆种子内除了自由水,又出现了一种存在于种皮与胚乳间隙的新相态的水分(弛豫时间200~1 000 ms),杜恬恬等[16]发现合欢种子吸水后也出现了此相态的水分。
3.2 紫荆种子吸胀过程中各相态水分的动态变化
种子内部存在许多亲水物质,水分进入种子后首先与亲水物质结合,所以紫荆种子吸水早期(0~6 h)增加的水分主要是自由水,这也是此阶段自由水峰面积迅速增加的主要原因。随着种子的不断吸水,亲水物质对水分的吸附能力逐渐达到饱和,因而吸水6 h后T2b峰面积无显著差异,即自由水含量变化不大。总的来说,紫荆种子吸胀过程中,自由水峰面积的变化较为简单。随着种子的不断吸水,种皮得以进一步软化,透性增强,细胞间隙变大,因此6 h以后增加的水分主要存在于种皮和胚乳的间隙中,以T2c相态形式存在,并且吸水后期T2c峰面积一直不断增加,并于吸水24 h时达到最大值。整个吸胀过程,两种相态水的峰顶点时间右移,峰比例也在不断变化中,但最终还是向流动性增强的趋势发展。此结果与彭宇飞[19]在玉米(Zeamays)种子的吸水萌发、杨鹏等[20]在谷子(Setariaitalica)吸水过程中的研究结果一致。
营养物质种类不同,不仅会使峰数量不同,还会使各相态水的比例有较大差异,如宋平等[21]发现玉米结合水占比最高,而本次紫荆种子吸胀阶段则是自由水占比较高(超过90%)。
3.3 紫荆种子层积过程中水分相态及营养物质含量的变化
紫荆种子除了具有物理休眠,种皮和胚乳中的发芽抑制物也是导致其休眠的重要因素[11]。低温层积处理可以有效解除该种子的生理休眠,促进种子萌发,但不同层积阶段种子中水分含量、营养物质的变化幅度并不相同:层积前期(S0—S30)种胚呼吸作用加快,种子中各种水解酶活性开始增强,营养物质代谢加快,使淀粉含量急剧下降,S30时较S0时下降了31.59%。而可溶性糖、可溶性蛋白等物质的含量则迅速增加,较S0时分别上升了84.46%、120.61%。层积前期这些旺盛的代谢活动均需消耗大量水分,NMR技术也监测到S30时水分的总峰面积较S0显著下降了8.52%。但此过程中,T2b和T2c的变化趋势并不相同,S30时T2b含量大幅下降,较S0显著下降了10.08%,玉米种子萌发早期自由水的含量同样反映为降低的态势[21]。潘瑞炽[22]认为种子旺盛的生理代谢活动与水分,特别是自由水密切相关。T2c虽然不参与种子中的代谢活动,但种子内各相态水分之间可以相互转换,因此S15时T2c水分含量也是大幅下降以及时补充自由水的减少。层积后期(S30—S60)种子的代谢速度变缓,S60时淀粉、可溶性糖、可溶性蛋白含量较S30时差异均不显著,S60时淀粉含量较S30时仅下降9.63%,远小于层积前期,种子的代谢活动对自由水的需求也不再像层积前期那么大。有了充分的营养物质积累,层积后期种子萌发速度加快,发芽率明显升高。层积后期T总峰面积即水分含量持续增加,S60时较S30增加20.23%,T2b和T2c水分含量也总体呈增加趋势,S60较S30时分别增加了18.42%、41.64%。整个过程各相态水分含量在S60时首次高于S0,可能是因为胚根突破种皮,大量水分进入到胚根区域,使水分含量增加,流动性增强。总的来说,整个层积过程紫荆种子T2b峰面积的变化与物质代谢状态紧密相关,且T2b的峰面积比例一直保持较高,因T2b作为主要相态水分参与种子内各种代谢活动,故T2b的各种变化可能与紫荆种子的萌发活动密切相关。
4 结 论
1)保持80 ℃热水浸种5 min可以有效解除紫荆种子的硬实性。0~9 h是紫荆种子的快速吸水期,9 h时吸水率达到76.42%,随后进入缓慢吸水期,至24 h时紫荆种子吸水趋于饱和状态,吸水率高达96.42%。
2)吸胀是种子萌发的起始阶段,通过核磁共振T2弛豫谱的变化,发现紫荆种子吸胀过程中,T2a的峰面积和峰比例逐渐下降最后消失,T2b和T2c的峰面积和峰比例呈上升趋势;层积过程中,T2b的峰面积先减少后增加,而T2c呈波动增加趋势;整个吸胀层积过程中,各波峰的峰顶点总体向右偏移,水分的流动性在不断增强。
3)层积前期(S0—S30),淀粉、可溶性糖、可溶性蛋白等营养物质在各种酶的催化作用下,消耗大量自由水,使T2b峰面积从120 811.17大幅下降至108 633.39;层积后期(S30—S60),营养物质的代谢活动减慢,对自由水的需求减少,不同相态水分之间还存在相互转化的趋势,因此T2b峰面积呈增加趋势。整个层积过程T2b峰比例一直保持在90%以上,这样高比例自由水的存在使紫荆种子内部维持旺盛的生理代谢活动。层积过程中,T2c水分含量呈波动增加趋势。
