反应结晶制备磷酸铵镁的研究
2023-11-29王玉琪张文燕柴澍靖张亚南王俐聪武海虹
王玉琪,张文燕,柴澍靖,张亚南,王 亮,王俐聪,武海虹
(自然资源部 天津海水淡化与综合利用研究所,天津 300192)
磷酸铵镁沉淀法(又称MAP法)可以去除含有较高浓度氨氮的各类废水,在适宜的工艺条件下氨氮的去除率为90%以上。李晓燕等[1]、刘大鹏等[2]开展了MAP法处理焦化废水中氨氮的研究,氨氮去除率均为96%以上;汤琪等[3]、于瑞莲等[4]开展了MAP法处理垃圾渗滤液中氨氮的研究,渗滤液中氨氮的去除率分别达到97.05%和98%;许延辉等[5]、王利平等[6]开展了MAP法处理稀土废液中氨氮的研究,氨氮的去除率达到90%;解磊等[7]利用MAP沉淀装置处理某制药厂废水、某垃圾填埋场渗滤液、某厂二氧化碳冷凝液,使这三种废水的氨氮去除率均达到90%;郭涛等[8]开展了MAP法处理含高浓度氨氮制药废水中氨氮的研究,氨氮的去除率达96.12%。刘桐等[9]以某化工厂草甘膦母液为研究对象,采用磷MAP法去除废水中的氨氮,氨氮的去除率达97%。目前磷酸铵镁沉淀法的相关研究集中在氨氮去除率的提升,对副产物磷酸铵镁的利用关注度不足。MAP法的反应产物磷酸铵镁,又称鸟粪石,化学式为MgNH4PO4·6H2O,为粉末状白色晶体,微溶于水。由于磷酸铵镁含有植物生长所需的营养元素N、P和Mg,并且其养分比其他可溶肥料的释放速率慢,肥料利用率高,可以作为缓释肥使用[10]。鉴于副产物磷酸铵镁沉淀具有较高的利用价值,研究重点关注MAP法去除废水中氨氮的过程、各项实验条件对磷酸铵镁纯度的影响,以期获得更高纯度的磷酸铵镁,提升副产物利用价值。
1 实验部分
1.1 主要仪器和试剂
电子天平(METTLER TOLEDO AL204-IC)、pH计(METTLER TOLEDO FE20)、磁力搅拌器(IKA S25)、X衍射仪(日本理学)。
氯化铵、氢氧化镁、磷酸二氢钠、盐酸、氢氧化钠(分析纯,天津市北方天医化学试剂厂)。
1.2 模拟氨氮废水
实验中所处理的废水均为使用氯化铵和蒸馏水配制的模拟氨氮废水。
1.3 实验原理
以氢氧化镁作为镁源沉淀剂,由于磷酸铵镁的溶度积常数(Ksp=2.5×10-13, 25 ℃)小于氢氧化镁的溶度积常数(Ksp=1.8×10-11,25 ℃),溶液存在如下反应:

如果使用可溶性镁盐(如硫酸镁、氯化镁)则存在如下反应:


采用可溶性镁盐需消耗大量的氢氧化钠,同时会增加处理后废水中可溶性盐的浓度。而使用氢氧化镁作为镁源沉淀剂,不仅可以减少氢氧化钠的使用量,降低水处理的成本,而且没有向废水中引入额外可溶性盐类,不会对后续处理产生影响。因此,此研究选择氢氧化镁作为镁源沉淀剂。
1.4 实验装置及方法
根据配比向废水中加入一定量的氢氧化镁和磷酸二氢钠,用体积比为1 ∶1的盐酸或氢氧化钠调节溶液的pH值,反应结束后,抽滤反应完成液,得到磷酸铵镁结晶洗涤干燥。实验装置见图1。

图1 实验装置示意图Fig.1 Schematic diagram of experimental device
1.5 分析方法
磷酸铵镁含量采用滴定法测定,所得沉淀使用X衍射仪确定组成。
2 结果与讨论
2.1 工艺条件对磷酸铵镁纯度的影响
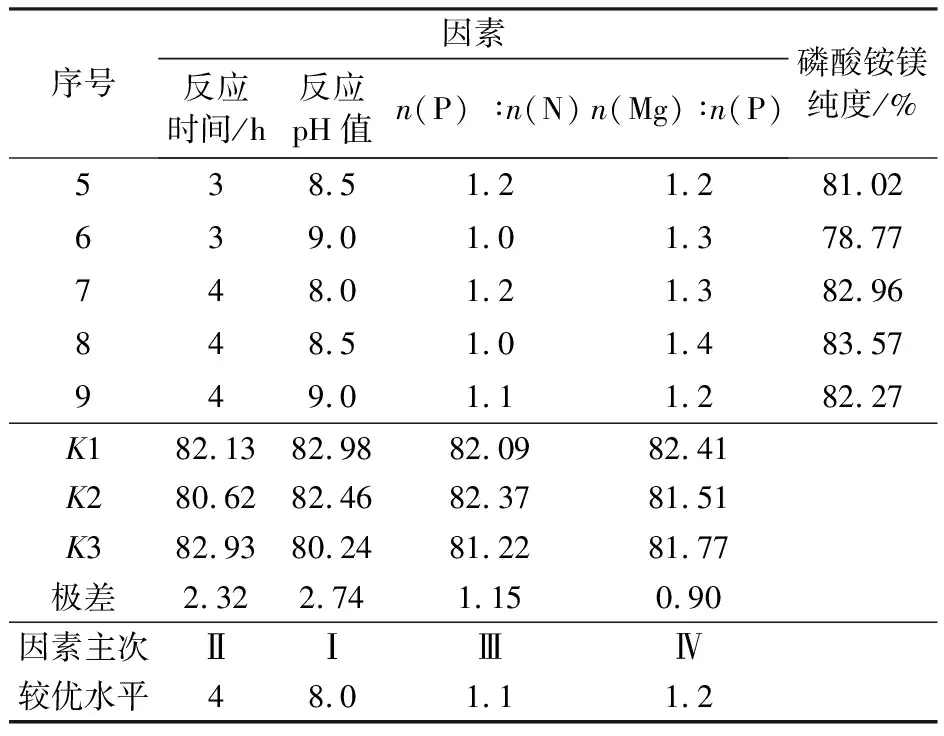
反应沉淀主产物为磷酸铵镁,杂质为未反应的氢氧化镁。此研究选取反应时间、反应pH值、n(P) ∶n(N)、n(Mg) ∶n(P)作为影响因素,将其各自的3种变化作为水平,见表1,采用正交表L9(34)。
将试验所得的各组沉淀在50 ℃干燥后,取一定质量的沉淀样品,测定其中的镁含量,即可通过公式计算得到磷酸铵镁的纯度。各组沉淀磷酸铵镁纯度以及极差分析数据见表2。

表1 因素水平表Tab.1 Factor levelTable

表2 磷酸铵镁纯度正交试验结果Tab.2 Orthogonal test results of purity of MAP
续表2 (Continue)
由极差分析可知各因素对磷酸铵镁纯度影响主次顺序为:反应pH值> 反应时间>n(P) ∶n(N)>n(Mg) ∶n(P)。上述试验所用正交表除各因素外,无空白作对照,所以误差分析取相对误差,将均方最小的因素所对应的方差归为误差。取显著性水平为0.05,方差分析结果见表3。
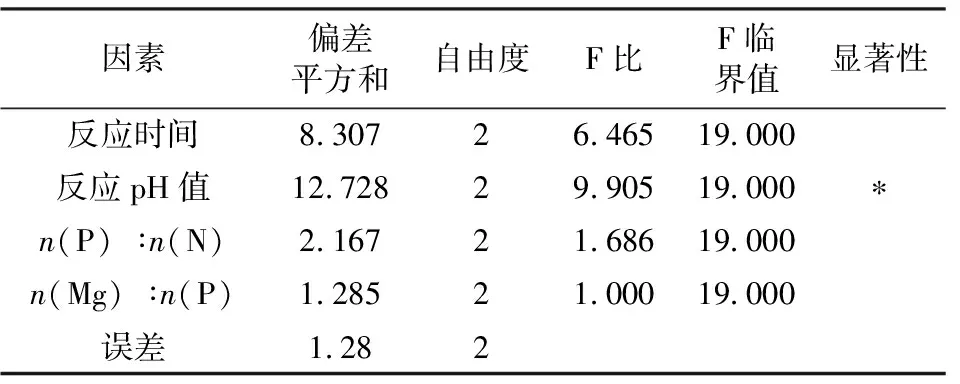
表3 显著性检验Tab.3 Significance test
表3表明,反应pH值对磷酸铵镁纯度的影响显著,应取该因素最好的水平,因为该因素的变化会造成磷酸铵镁纯度的显著不同。而其他三个因素则可根据其他影响条件,考虑其水平的选择。综合考虑极差分析和方差分析的结果,确定最优工艺条件:反应时间为4 h、反应pH值为8.0、n(P) ∶n(N)=1.1 ∶1、n(Mg) ∶n(P)=1.2 ∶1。在此工艺条件下,滴定法测定磷酸铵镁的含量为86.20%。
2.2 过饱和度、晶种浓度对磷酸铵镁结晶生长的影响
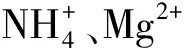
PS=MgT×NT×PT
式中:MgT为可溶性金属离子总浓度;NT、PT分别为N和P的总浓度。
定义PSeq为磷酸铵镁的平衡条件溶度积:
αMg2+=[Mg2+]/MgT
u=0.5∑CiZi2
式中:αi为离子的组分数;u为离子强度;γi为离子的活度系数;CiZi分别为离子的浓度和电荷数;A为Debye-Huckel常数(0.509,25 ℃)。
当PS>PSeq时水中的磷酸铵镁达到过饱和,当过饱和度达到一定数值时磷酸铵镁则沉淀出来。磷酸铵镁的形成是一种结晶的过程,要经过成核和晶体生长两个阶段。过饱和度同时影响着成核和晶体生长。过高的过饱和度不利于晶体生长、更利于晶体成核,因此溶液中会出现大量的磷酸铵镁微晶,这些晶粒很难长大。控制过饱和度使溶液体系处于均匀的亚稳定区,利于晶体的生长。
磷酸铵镁晶体的形成,不仅受溶液中浓度和传质的影响,晶种的存在也是重要影响因素之一。在反应时间为4 h、pH值为8.0、NaH2PO4·2H2O与废水中氨氮摩尔比[n(P) ∶n(N)]为1.1 ∶1、Mg(OH)2与NaH2PO4·2H2O摩尔比[n(Mg) ∶n(P)]为1.2 ∶1的条件下,向反应溶液中添加相对于氨氮物质的量分别为0%、5%、10%、15%、20%的磷酸铵镁晶种,其实验结果见图2。
图2表明,通过向溶液中添加晶种,可以提高反应的速率,促进磷酸铵镁晶体的形成。其效果随着晶种添加量的增加而提高,当晶种添加量达到10%时,不再提高。分析其原因,可能为晶种的存在降低了磷酸铵镁晶体形成的位势,同时晶种相对粗糙的表面具有较高的表面能,利于磷酸铵镁的生成,提高了反应速率。而当晶种添加量大于10%以后,晶种的数量不再是制约反应进行的主要因素,因而继续增加晶种添加量的效果不明显。
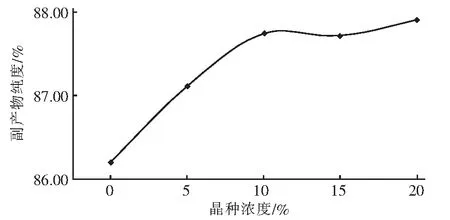
图2 晶种浓度影响实验结果Fig.2 Effect of seed concentration on experimental results
2.3 磷酸铵镁提纯技术研究
反应产物中主要为生成的磷酸铵镁和未反应的沉淀剂氢氧化镁,拟采用筛分等方法,但通过粒度分析发现,所得磷酸铵镁沉淀只有一个粒度峰,很难通过上述方法分离磷酸铵镁和氢氧化镁,见图3。
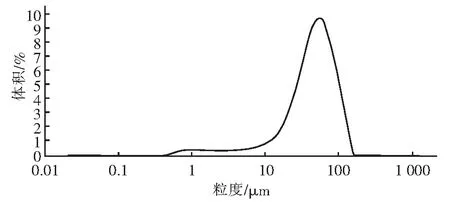
图3 磷酸铵镁粒度分析Fig.3 Particle size analysis of MAP
将反应得到的磷酸铵镁作为沉淀剂,进行二次反应来提高磷酸铵镁的纯度。在反应时间为4 h、pH值为8.0、NaH2PO4·2H2O与废水中氨氮摩尔比[n(P) ∶n(N)]为1.1 ∶1、Mg(OH)2与NaH2PO4·2H2O摩尔比[n(Mg) ∶n(P)]为1.2 ∶1条件下,利用反应器得到磷酸铵镁。滴定法测定磷酸铵镁含量为89.55%。在同样反应条件下,先将磷酸铵镁作为镁源沉淀剂加入溶液中,再向其中补足氢氧化镁,反应得到磷酸铵镁,利用滴定法测定磷酸铵镁含量为93.11%。对该沉淀进行X衍射分析,XRD图谱见图4。通过对照标准PDF卡片(15-0762和44-1482),发现沉淀中主要成分为磷酸铵镁,同时含有少量氢氧化镁,其中磷酸铵镁含量约93%。

图4 磷酸铵镁XRD图谱Fig.4 XRD spectrum of MAP
3 结论
1)以氢氧化镁为镁源沉淀剂,处理含氨氮废水,可以得到纯度较好的磷酸铵镁结晶。在反应时间为4 h、反应pH值为8.0、n(P) ∶n(N)=1.1 ∶1、n(Mg) ∶n(P)=1.2 ∶1的工艺条件下,滴定法测定磷酸铵镁的纯度为86.20%。
2)将一次磷酸铵镁结晶作为镁源沉淀剂加入溶液中,再向其中补足氢氧化镁,反应得到二次磷酸铵镁结晶,可以进一步提高磷酸铵镁结晶纯度,滴定法测定磷酸铵镁纯度为93.11%。
3)晶种的存在降低了磷酸铵镁晶体形成的位势,同时晶种相对粗糙的表面具有较高的表面能,有利于磷酸铵镁的生成,提高了反应速率。
