LINC01140在肝胆胰癌中的低表达及其靶向功能预测*
2023-11-29杜秀芳李建棣颜诗白李建军黄志广党裔武危丹明
杜秀芳 李建棣 颜诗白 李建军 黄志广 党裔武 陈 罡 危丹明
1 广西医科大学第一附属医院病理科,广西南宁市 530021; 2 广西医科大学第二附属医院普通外科
癌症是中国及世界范围内的主要公共卫生问题之一,中国癌症的发生率和死亡率一直上升,已成为头号死亡原因[1]。而肝胆胰恶性肿瘤占据主要位置,尽管医疗诊治水平逐渐提高,但其死亡率仍居前列,预后极差[2]。尽管肝细胞癌、胰腺导管腺癌、胆囊癌及胆管癌已经有相应的诊断相关标志物,但其敏感性和特异性相对较差。随着对肝胆胰恶性肿瘤的深入研究,越来越多的基因调控和信号通路等分子机制被揭示,寻找新的诊断、预后标志物及治疗靶点亟待进行。
随着转录组测序和全基因组技术的深入发展,越来越多的长链非编码RNA(lncRNA)被发现,并成为肿瘤研究的重要领域。lncRNA是长度从200个核苷酸到100个碱基的非编码RNA,不同的RNA之间存在相互作用,lncRNA 通过控制基因表达参与了一系列与癌症相关的生物学过程[3-5]。目前有部分文献报道了LINC01140在非小细胞肺癌、骨肉瘤、转移性肉瘤、脑胶质瘤及乳腺癌中的表达情况及作用机制。然而不同报道,LINC01140的调控作用尚有差异,如在非小细胞肺癌、骨肉瘤、转移性肉瘤及乳腺癌中发挥抑癌作用,在脑胶质瘤及肺癌中发挥癌基因的作用,促进癌症的发生发展。然而在消化系统恶性肿瘤中LINC01140的差异表达及其作用差异表达miRNAs的靶向mRNAs预测未见报道。而胆囊、肝外胆管系统、肝及胰均起自胚胎第4周出现的中肠肝憩室[6],具有一定的相关联系。本研究旨在研究分析肝胆胰恶性肿瘤(肝细胞癌、胰腺导管腺癌、胆囊癌、胆管癌)中LINC01140的表达及作用机制,为预后的生物标志物或有效的治疗靶点提供依据。
1 材料和方法
1.1 肝胆胰癌中基因微阵列及高通量测序数据获取及分析 从GEO、TCGA-GTEx、SRA、ArrayExpress数据库及PubMed、Web of Science、中国知网、维普、万方数据库中检索肝细胞癌、胰腺导管腺癌、胆囊癌、胆管癌转录组数据。纳入数据集满足以下条件:(1)人原发性肝细胞癌、胰腺导管腺癌、胆囊癌、胆管癌组织(若为miRNAs芯片也可纳入体液样本);(2)样本量≥6。剔除重复样本及缺乏对照的数据集。对纳入数据集进行平台合并、批次效应移除、数据标准化处理。所得矩阵即平台表达矩阵。
1.2 预后分析 为评估LINC01140在肝胆胰癌患者中的预后性能,从Kaplan-Meier Plotter中收集肝细胞癌、胰腺导管腺癌、胆囊癌及胆管癌队列研究预后资料(包含免疫治疗队列),分析LINC01140表达对患者总体生存期(Overall survival,OS)的影响。以LINC01140中位表达值为界,将患者分为LINC01140高表达组、LINC01140低表达组,利用Kaplan-Meier生存分析评估两组间预后差异。
1.3 差异表达分析 分别利用上述移除批次效应后平台表达矩阵进行基因差异表达分析。肝细胞癌、胰腺导管腺癌、胆囊癌及胆管癌差异表达mRNAs或差异表达miRNAs需满足以下条件:(1)标准化平均差(Standardized mean difference,SMD)绝对值>0;(2)P值<0.05。
1.4 LINC01140靶向miRNAs预测分析 根据RNA相互作用百科全书在线预测LINC01140作用miRNAs。通过绘制韦恩图对差异表达miRNAs及LINC01140靶向miRNAs进行交集。对LINC01140作用差异表达miRNAs的靶向mRNAs进行预测。
1.5 基因交集分析 鉴于miRNAs发挥功能得益于其基因调控作用,本研究通过绘制韦恩图对肝细胞癌、胰腺导管腺癌、胆囊癌及胆管癌高表达基因、LINC01140作用miRNAs的靶向mRNAs进行交集。对LINC01140、LINC01140作用差异表达miRNAs及其靶向mRNAs构建ceRNA调控网络。
1.6 基因功能注释 对“基因交集分析”中的交集基因进行基因本体(Gene Ontology,GO)—生物过程(Biological process,BP)、GO-细胞成分(Cellular component,CC)、GO-分子功能(Molecular function,MF)功能注释,同时利用京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集初步分析肝胆胰癌中LINC01140-miRNA-mRNA调控轴的潜在分子生物学机制。
1.7 统计学方法 在R、STATA统计软件中进行数据分析。从上述批次后平台表达矩阵提取LINC01140表达值,计算其例数、均数和标准差,用随机效应模型计算其合并的SMD值。利用Egger检验、漏斗图评估发表偏倚。通过进行亚组分析和敏感性分析探寻异质性来源。绘制受试者工作特征(Receiver operating characteristic,ROC)曲线及汇总受试者工作特征(summary ROC,sROC)曲线,计算其曲线下面积(Area under the curve,AUC)、评估LINC01140对肝胆胰癌的区别能力,<0.7、0.7~<0.9、≥0.9分别提示区别能力较弱、中等、较强。计算敏感度、特异度、阳性似然比及阴性似然比。以P<0.05为差异有统计学意义。
2 结果
2.1 LINC01140在肝胆胰癌组织中低表达 本研究基于平台数据集,整合分析2 215例肝胆胰癌及1 679例周围正常组织对照样本中的LINC01140表达量,可见LINC01140在肝胆胰癌中低表达(P<0.01),其标准化均数差(SMD)值为-0.47[-0.76,-0.18],差异具有统计学意义(见图1a)。经漏斗图分析未见明显发表偏倚(见图1b)。整合分析结果可靠,计算sROC曲线AUC为0.64[0.60,0.68](见图1c),似然比、阳性似然比、阴性似然比森林图结果提示LINC01140用于区分肝胆胰癌的准确性欠佳(见图1d、图2)。
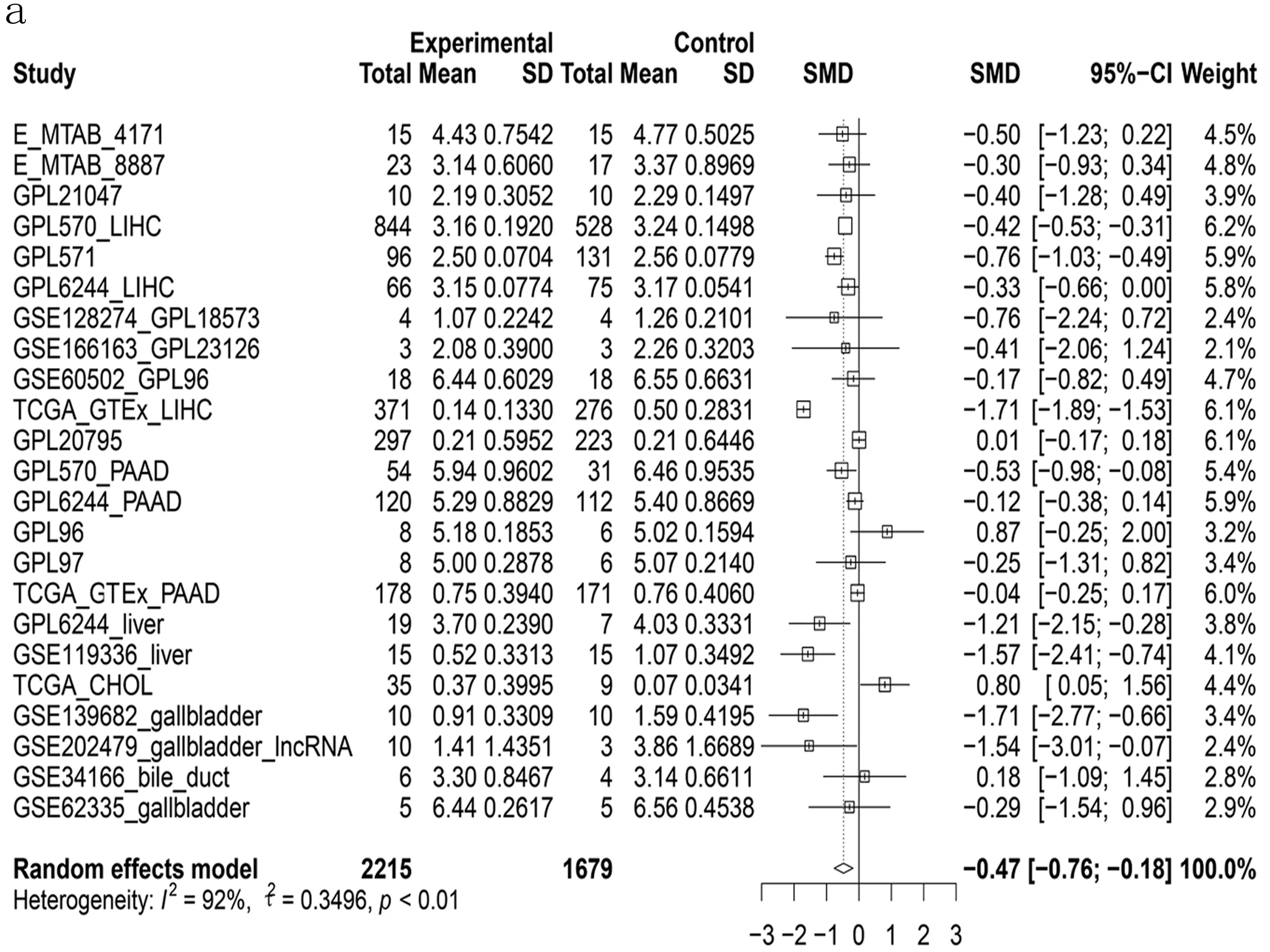
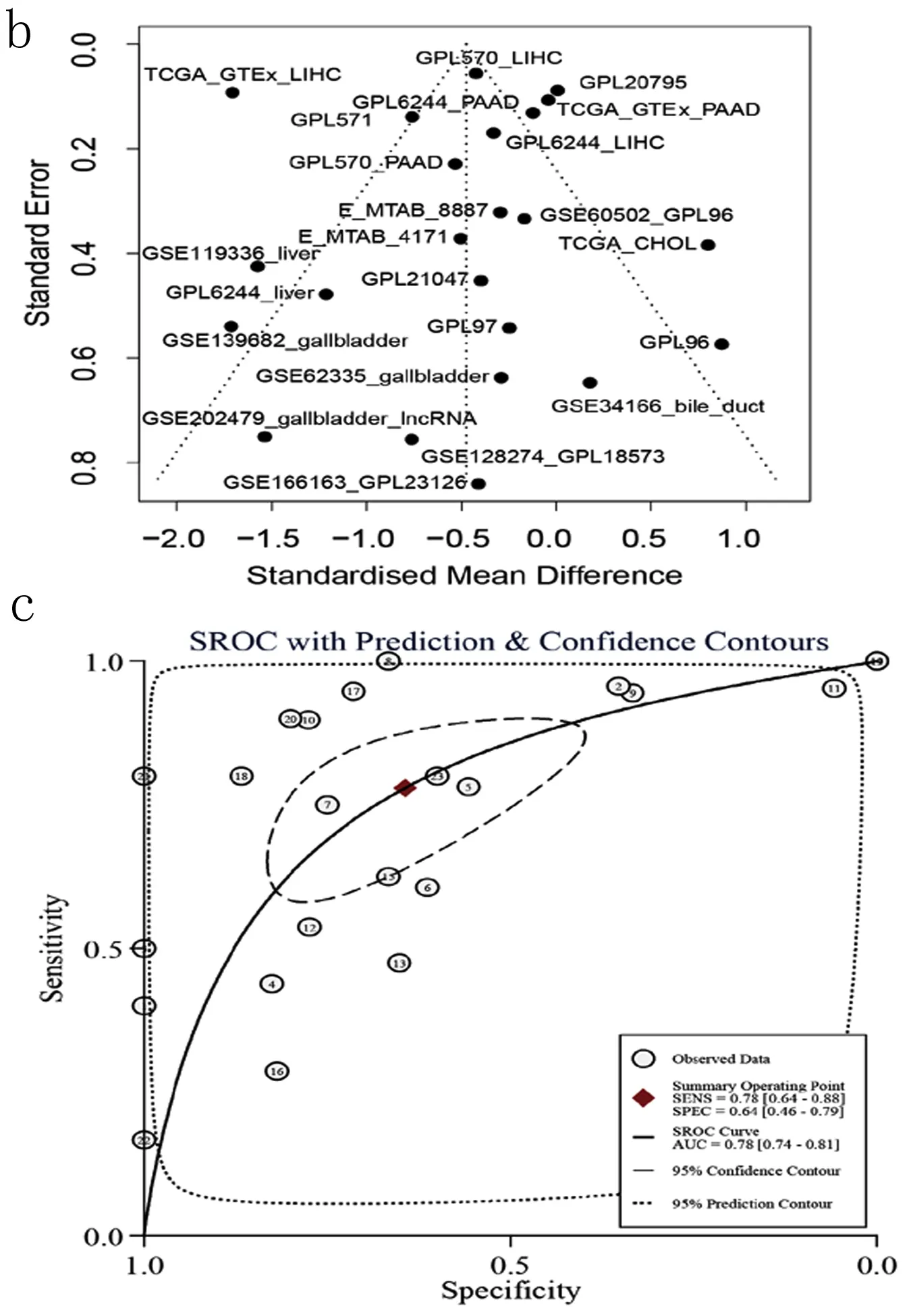
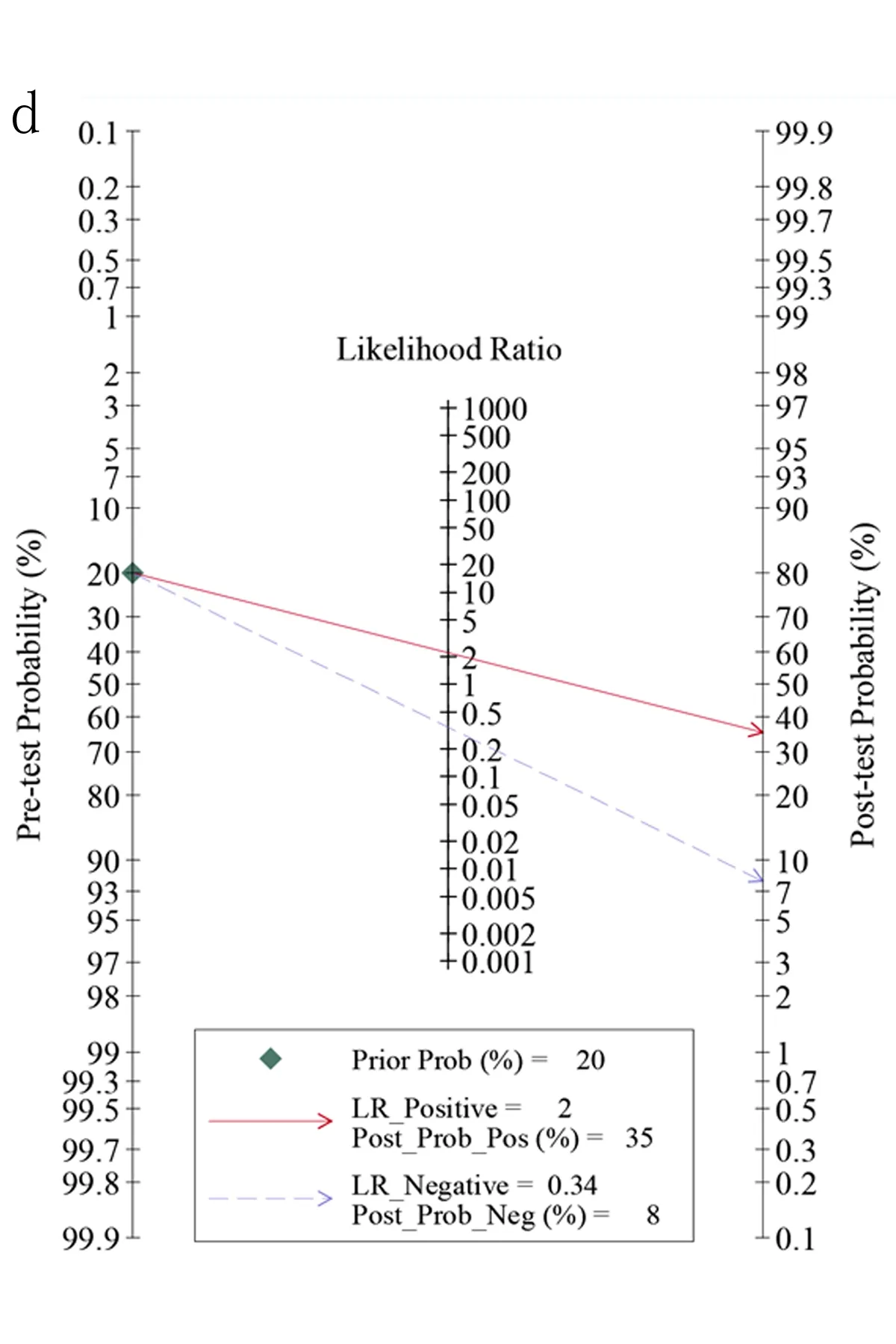
图1 LINC01140在肝胆胰癌组织中显著低表达
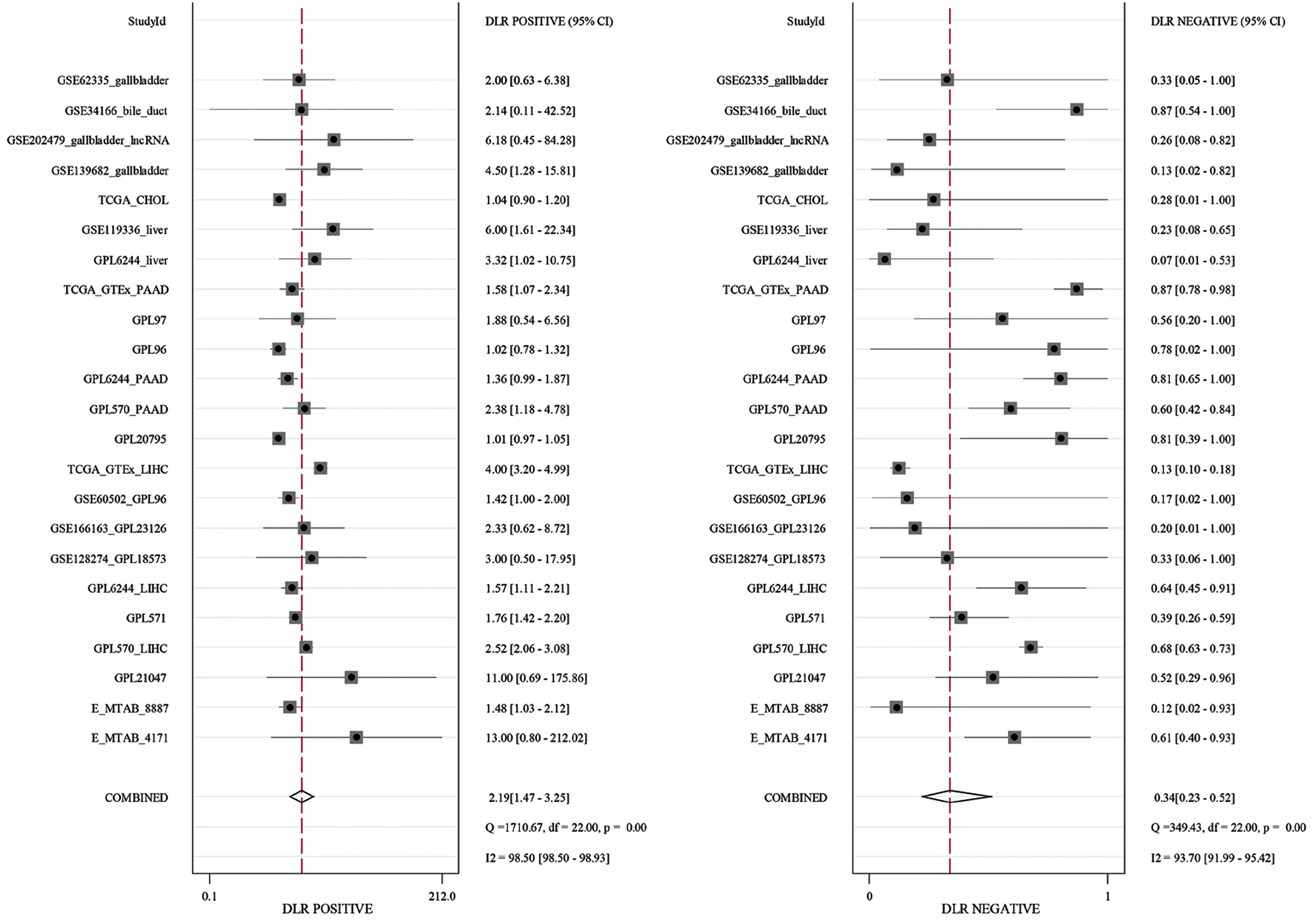
图2 LINC01140低表达对肝胆胰癌组织的区分能力
2.2 LINC01140低表达在肝胆胰癌组织中的亚组分析 LINC01140肝胆胰癌中低表达(P<0.01),对其进行亚组分析,分别肝细胞癌、胆囊癌及胆管癌、胰腺导管腺癌中低表达(见图3)。其中在肝细胞癌中低表达(P<0.01),其SMD值为-0.60 [-1.06,-0.14],差异具有统计学意义,计算sROC 曲线AUC 为 0.80 [0.76,0.83],见图4a;在胆囊癌及胆管癌中低表达(P<0.01),其SMD值为-0.75[-1.59,0.09],差异具有统计学意义, 计算sROC 曲线AUC 为 0.91 [0.88,0.93] ,见图4b;在胰腺导管腺癌中低表达(P=0.16),其SMD值为-0.08 [-0.25,0.08],具有低表达趋势, 计算sROC 曲线AUC 为 0.60[0.55,0.64],见图4c。
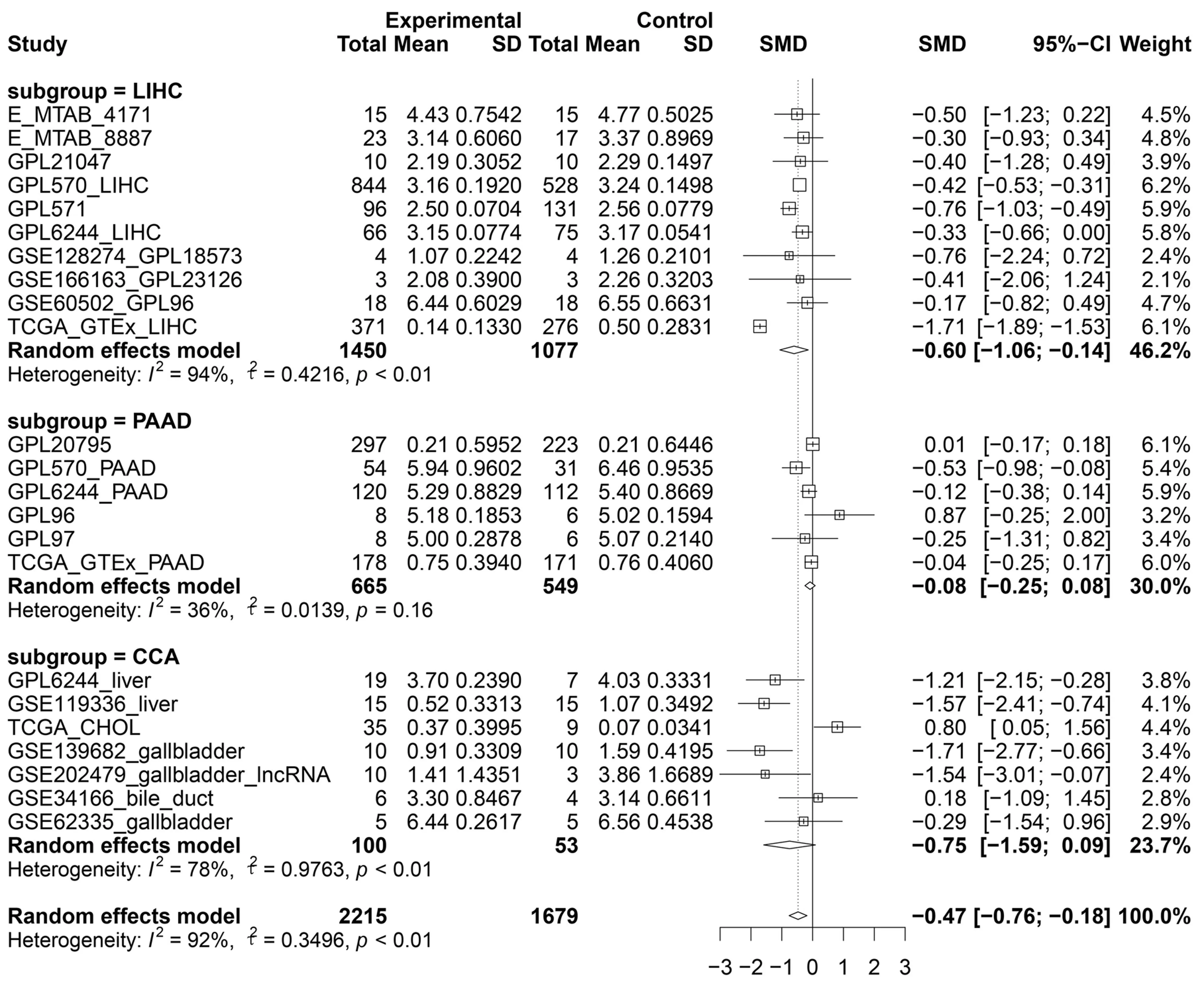
图3 LINC01140低表达在肝胆胰癌组织中的亚组分析
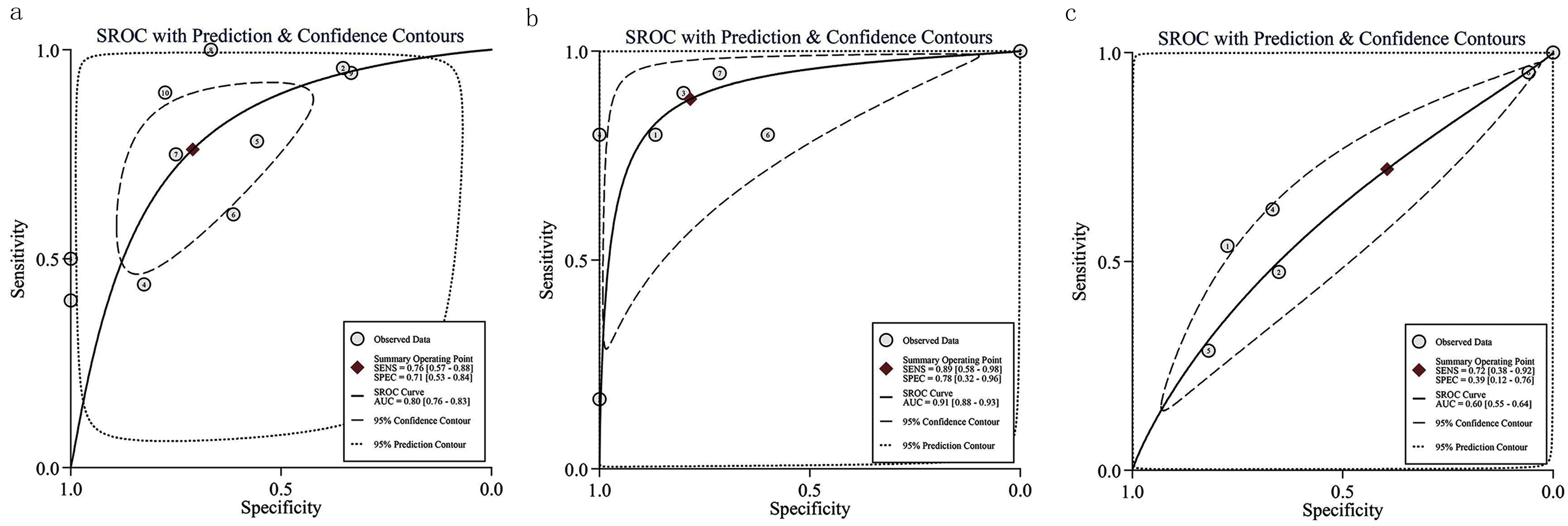
图4 INC01140低表达区分肝胆胰癌组织的sROC曲线a.肝细胞癌 b.胆管癌及胆囊癌 c.胰腺癌
2.3 LINC01140低表达在免疫治疗队列中的预后价值 基于LINC01140表达的肝胆胰癌患者Kaplan-Meier生存曲线,低表达患者总生存期明显低于高表达患者[HR=0.61(0.52~0.73),P<0.001,见图5a],无进展生存期明显低于高表达患者[HR=0.57(0.45~0.72),P<0.001,见图5b],LINC01140低表达提示预后较差。
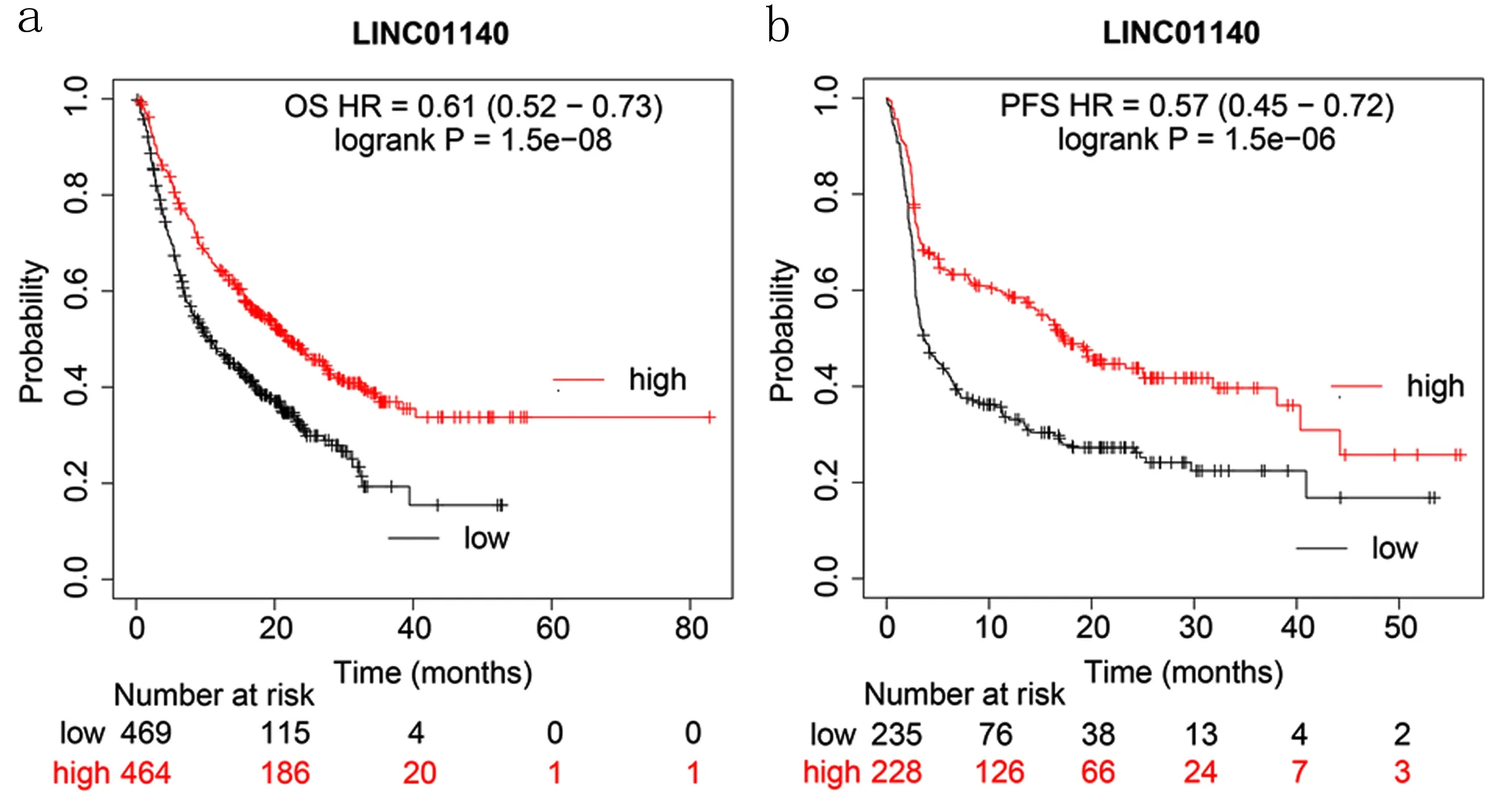
图5 LINC01140低表达在免疫治疗队列中的预后价值a.总体生存期 b.无进展生存期
2.4 探索肝胆胰癌LINC01140-miRNA-mRNA调控网络 经过基因表达差异分析发现LINC01140作用的差异表达miRNAs 54个,肝细胞癌中差异表达miRNAs 499个,胰腺癌中差异表达miRNAs 397个,其中hsa-miR-199a-3p、hsa-miR-382-3p、 hsa-miR-452-5p及hsa-miR-4677-3p参与肝胆胰癌中LINC01140调控网络(见图6a、b)。取肝胆胰癌高表达基因与LINC01140作用miRNAs的靶向mRNAs交集,预测LINC01140作用差异表达miRNAs的靶向mRNAs 273个(见图6c)。
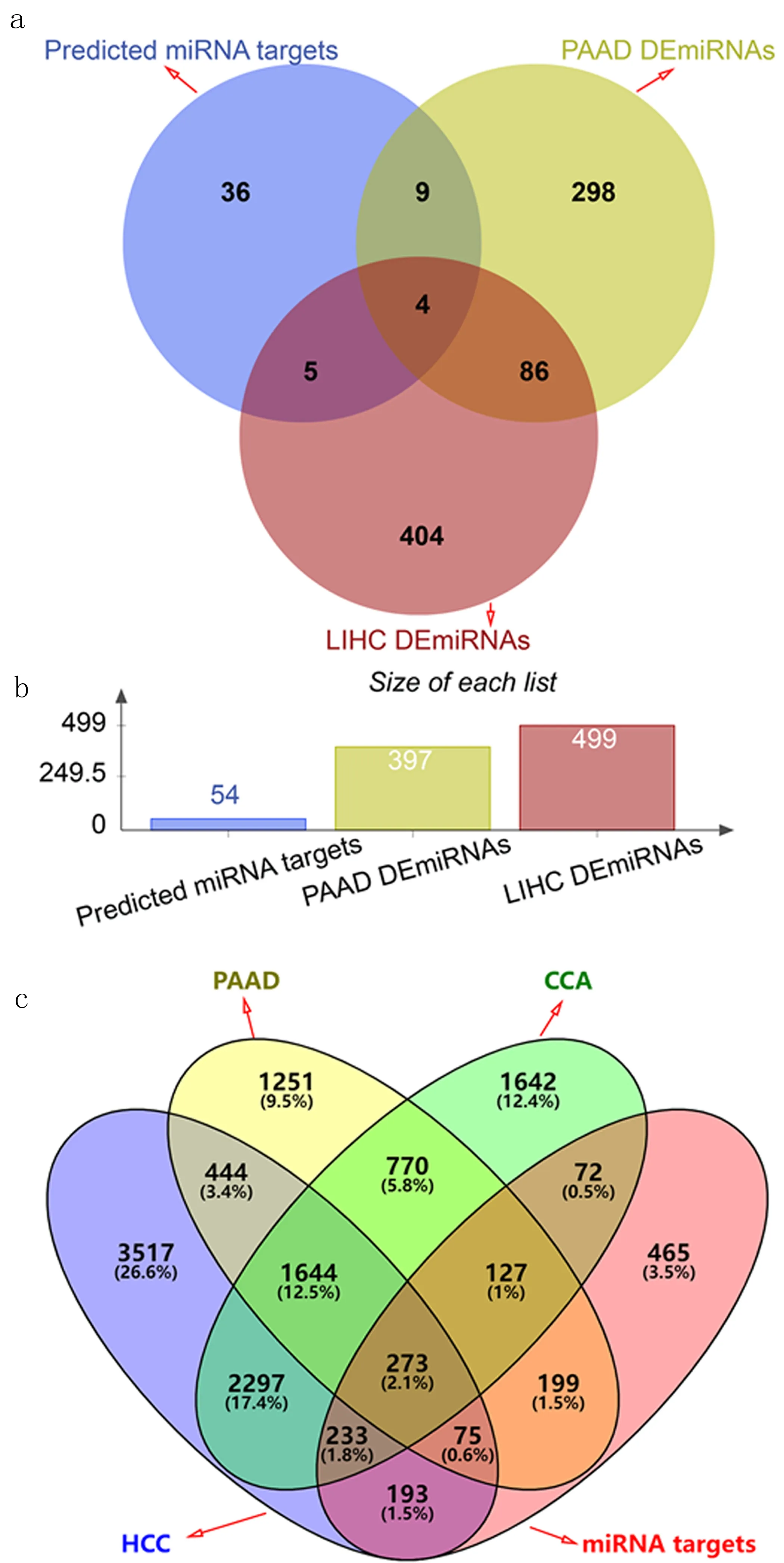
图6 LINC01140 ceRNA交集分析a.LINC01140作用的差异表达miRNAs b.LINC01140作用miRNAs统计 c.肝胆胰癌高表达基因、LINC01140作用miRNAs靶向mRNAs交集
2.5 LINC01140-miRNA-mRNA调控轴GO富集分析及KEGG富集分析 LINC01140参与的ceRNA GO功能富集分析结果(见图7a)显示主要参与的生物过程(Biological processes, BP)包括细胞器组织的正向调节、有丝分裂细胞周期及细胞成分生物发生的正向调节等,同时细胞成分(Cell component,CC)主要富集在黏着斑、细胞—基质连接及纺锤体等,而分子功能(Molecular function,MF)富集结果主要集中在泛素样蛋白连接酶结合、泛素蛋白连接酶结合及钙粘蛋白结合等。KEGG功能富集分析结果显示,根据富集程度排在前三位的信号通路分别为Salmonella infection、Focal adhesion及Hippo signaling pathway(见图7b)。
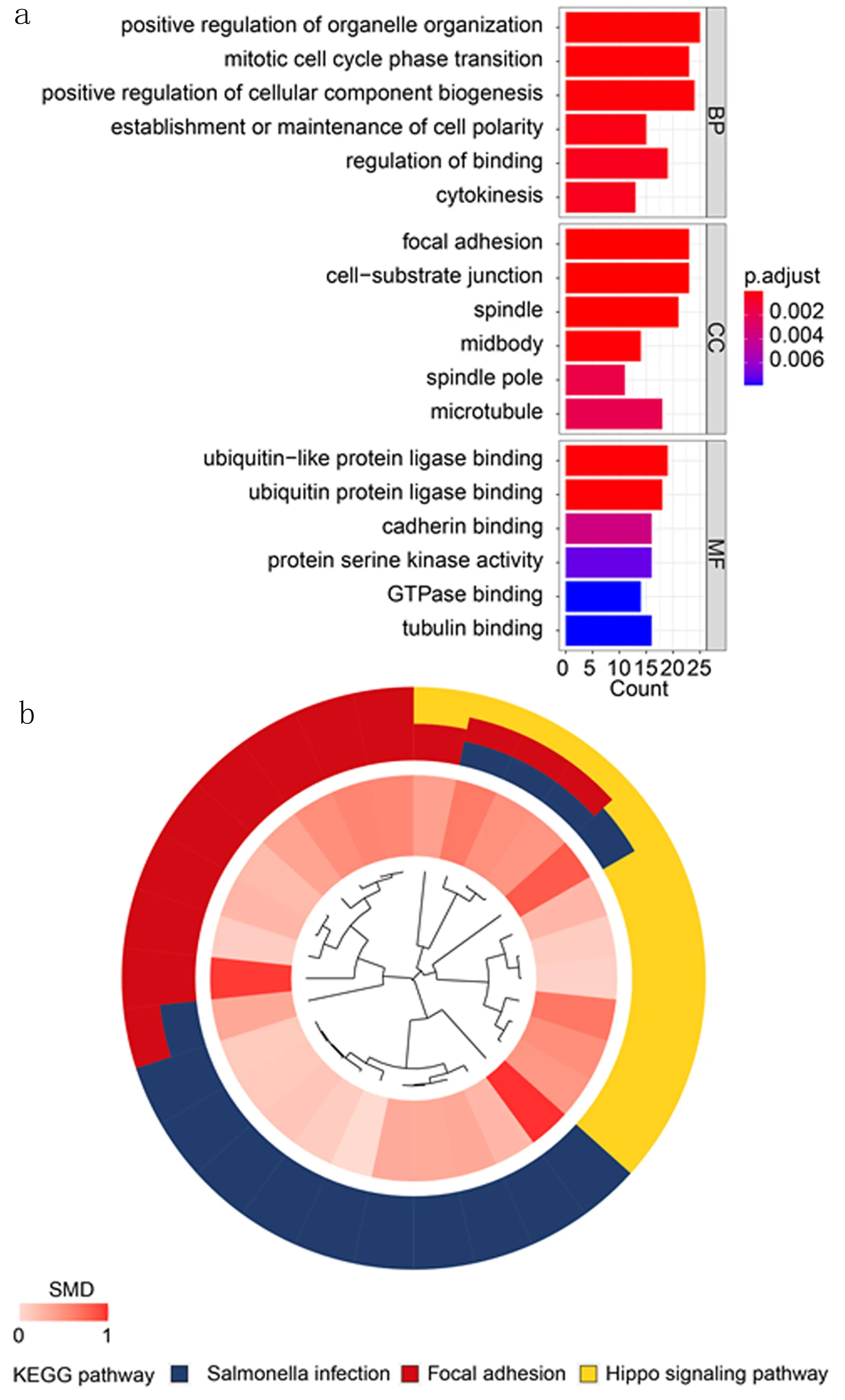
图7 LINC01140 ceRNA在肝胆胰癌中的潜在分子机制a.GO分类 b.KEGG通路
3 讨论
消化道恶性肿瘤肝细胞癌、胆囊癌及胆管癌、胰腺导管腺癌早期起病隐匿,不易被发现,病情进展快,以手术切除为主要治疗手段,然而通常晚期治疗效果不佳,患者预后差。尽管肝细胞癌的分子和免疫治疗已建立标准治疗方案,早期射频、中期肝动脉化疗栓塞术、晚期分子治疗占据主导位置,但其治疗效果仍然不佳[7]。晚期胆道癌一线治疗的标准参考方案仍为吉西他滨联合顺铂,然而免疫治疗也具有一定的局限性[8]。虽然辅助治疗可以为肝胆癌出现症状的晚期疾病患者提供较好的结果,但常规辅助化疗和放射治疗的作用机制尚不清楚[9]。胰腺导管腺癌以预后极差而著称,且难以早期发现,通常错过了最佳手术时期,然而即使当肿瘤被及早发现时,成功切除的患者,预后仍然严峻,估计中位总生存期(OS)不到23个月[10]。手术切除往往与化疗和(或)放射治疗相结合,然而这些方法能适度改善总体存活率,但它们对大多数人来说根本不是治愈的[11]。因此迫切需要探索治疗肝胆胰癌的治疗靶点及预后标志物。
近年来,有文献报道LINC01140在肿瘤组织中的调控作用及其机制。然而在尚未报道LINC01140在肝胆胰癌中的生物学作用及调控机制。本研究基于平台数据集,整合分析2 215例肝胆胰癌及1 679例周围正常组织对照样本中的LINC01140表达量,证实了LINC01140在肝胆胰癌中低表达,纳入的样本量更大、面更广,对研究LINC01140表达的临床意义有极大的补充。
相关研究发现LINC01140在转移性肉瘤中的表达较低,预示着肉瘤的总体生存率、无病生存率和疾病特异性生存率较低[12]。LINC01140在乳腺癌患者肿瘤组织中低表达,低表达患者预后不良[13]。这些研究表明LINC01140分别在转移性肉瘤及乳腺癌中可能发挥抑癌作用,且低表达还提示预后不良。本研究中,基于LINC01140表达的肝胆胰癌患者Kaplan-Meier生存曲线分析,低表达患者总生存期明显低于高表达患者,无进展生存期明显低于高表达患者,LINC01140低表达提示预后较差。同时推测LINC01140调控的hsa-miR-199a-3p、hsa-miR-382-3p、hsa-miR-452-5p及hsa-miR-4677-3p参与肝胆胰癌中LINC01140调控网络。hsa-miR-199a-3p是与肝癌相关的关键miRNAs,显著上调,且上调的核心调控通路与肝细胞癌通路相关[14-15]。相关研究表明,LINC01140调控网络在肿瘤的发生发展中发挥着重要的作用,如非小细胞肺癌中LINC01140表达下调,通过海绵作用miR-4742-5p正向调节TACC1的表达[16]。LINC01140下调通过靶向miR-139-5p/HOXA9轴,抑制骨肉瘤细胞的侵袭、增殖和EMT[17]。LINC01140、miR140-5p和FGF9形成了一个lncRNA-miRNA-mRNA轴,它调节膀胱癌的表型,通过肿瘤微环境影响巨噬细胞M2极化,进而影响膀胱癌细胞的侵袭性[18]。然而部分文献报道其他肿瘤中LINC01140的生物学作用有一定的差异,LINC01140在脑胶质瘤中表达增强,通过调节miR199a-3p/ZHX1轴来促进胶质瘤的发展[19]。LINC01140在肺癌组织和细胞系中高表达,LINC01140水平升高与肺癌患者的生存不良有关。LINC01140过表达可保护c-Myc和PD-L1mRNA免受miRNAs的抑制,促进肺癌细胞的增殖、迁移、侵袭和免疫逃逸[20]。结果提示LINC01140在不同肿瘤中可能发挥着不同的调控作用,然而其调控网络机制仍需进一步的探索及验证。
众所周知,细胞周期的异常调节会导致细胞无法控制的增殖,并发生各种癌症,包括肝胆胰癌。然而,以前从未研究过确切的调控机制。在本项研究中,构建LINC01140-miRNA-mRNA调控网络及富集分析,LINC01140参与有丝分裂细胞周期调节,下调的LINC01140可能诱导细胞周期的异常调节,在有丝分裂核分裂过程中,当染色质结构发生变化时,有丝分裂基因容易被激活,这为癌细胞的增殖创造了有利条件。当然还需要进一步的研究来验证这些结论。
综上所述,本研究发现LINC01140在肝胆胰癌中低表达,可能发挥抑癌作用,低表达具有较差的预后,预示其可能成为肝胆胰癌的预后生物标志物。在肝胆胰癌中LINC01140可能通过LINC01140-miRNA-mRNA来实现对靶基因的调控,为肝胆胰癌患者靶向治疗提供新思路。
