三七总皂苷对动脉粥样硬化小鼠M1型、M2型巨噬细胞极化的影响
2023-11-29魏玥付长庚李洪峥杨文文彭煜暄路爱梅龙霖梓曲华于子凯
魏玥 付长庚 李洪峥 杨文文 彭煜暄 路爱梅 龙霖梓 曲华 于子凯
动脉粥样硬化(atherosclerosis,AS)是一种常见的动脉内膜炎症性疾病,内膜炎症反应的严重程度决定着AS的进展和转归[1]。巨噬细胞是AS斑块中主要的炎性细胞,可在AS微环境因素的影响下极化为功能相反的两种表型,即M1型和M2型,二者极化失衡可促进AS的炎症持续状态,进而加重AS[2]。研究表明,M1型巨噬细胞可通过分泌促炎因子加剧炎症反应,加速AS的形成;而M2型巨噬细胞具有抗炎作用,可促进组织修复,延缓AS的进展,因此,调控二者极化平衡对防治AS具有重要意义[3-4]。
三七总皂苷(panax notoginseng saponins,PNS)是活血化瘀类中药三七的主要有效成分,PNS制剂被广泛用于心血管疾病的临床治疗[5]。既往研究显示,PNS具有降低血脂水平、抑制炎症反应、抑制心肌细胞凋亡等作用[6-7]。团队前期研究表明,PNS可通过降脂稳斑、抗炎等起到抗AS作用,但其是否能够通过调控巨噬细胞极化抗AS值得进一步研究[8-9]。基于此,本研究拟选用ApoE-/-小鼠构建AS模型,探讨PNS通过调控巨噬细胞极化防治AS的潜在机制。
1 材料与方法
1.1 动物与饲料
SPF级雄性ApoE-/-小鼠53只,同品系雄性C57BL/6J小鼠13只,6周龄,体质量20~24 g,购自北京维通利华实验动物技术有限公司,合格证号:SCXK(京)2021-0006。实验所需基础饲料和高脂饲料均购自小黍有泰(北京)生物科技有限公司,许可证号为SCXK(京)2018-0006。高脂饲料由83.5%基础饲料+15%猪油+1.5%胆固醇构成。本实验通过中国中医科学院西苑医院动物伦理委员会批准(批件号:2022XLC047-2)。
1.2 实验药物
三七总皂苷购自昆药集团股份有限公司(主要含三七皂苷 R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1及人参皂苷Rd等成分;标准品化学纯度:86%),批号JK12022029;辛伐他汀片,购自华润双鹤利民药业(济南)有限公司,批号2104439。
1.3 主要实验试剂
肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素-6(interleukin-6,IL-6)酶联免疫吸附剂测定法(enzyme linked immunosorbent assay,ELISA)检测试剂盒(联科生物,货号分别为A282H20841、A206H20131);油红染液、苏木精-伊红(hematoxylin-eosin staining,HE)染液、多聚甲醛固定液(武汉赛维尔生物科技有限公司,货号分别为:G1015、G1003、G1101);RNA提取液、2×SYBR Green qPCR Master Mix (None ROX)(武汉赛维尔生物科技有限公司,货号分别为G3013、G3320);引物序列由武汉赛维尔生物科技有限公司合成。诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)抗体、精氨酸酶(Ariginase-1, Arg-1)抗体、CY3标记山羊抗兔IgG(武汉赛维尔生物科技有限公司,货号分别为:GB11119-100、GB11285-100、GB21303),PBS缓冲液、DAPI染色试剂、抗荧光淬灭封片剂(武汉赛维尔生物科技有限公司,货号分别为:G0002、G1012、G1401)。
1.4 主要实验仪器
Chemray 800型全自动生化分析仪(深圳雷杜生命科技公司),Epoch型酶标检测仪(美国Bio Tek公司),D3024R型台式高速冷冻型微量离心机(北京大龙兴创实验仪器股份公司),Donatello型脱水机(意大利DIAPATH公司),JB-P5型包埋机(武汉俊杰电子有限公司),RM2016型病理切片机(上海徕卡仪器有限公司),CFX Connect型荧光定量PCR仪(美国Bio-rad公司),ETC811型PCR仪(北京东胜创新生物科技有限公司),KZ-5F-3D型三维冷冻研磨仪、MV-100型涡旋混匀仪、MC-700掌上离心机(武汉赛维尔生物科技有限公司),Nikon Eclipse E100型正置光学显微镜、Nikon DS-U3型成像系统(日本尼康公司),D70型照相机(日本佳能公司)。
1.5 动物分组、模型建立及给药
适应性喂养1周后,予ApoE-/-小鼠高脂饲料以造模,予C57BL/6J小鼠基础饲料,自由采食及进水8周[10]。随机处死ApoE-/-小鼠3只、C57BL/6J小鼠3只,取胸主动脉,制作冰冻切片行油红O染色以确认造模成功[11]。其余ApoE-/-小鼠按随机数字表法分为5组,即模型组、PNS低剂量组、PNS中剂量组、PNS高剂量组、辛伐他汀组,每组10只。ApoE-/-小鼠继续喂食高脂饲料,C57BL/6J小鼠继续喂食基础饲料,同时分别予PNS低剂量组、PNS中剂量组、PNS高剂量组组小鼠PNS 30 mg/(kg·d)、60 mg/(kg·d)、120 mg/(kg·d)灌胃[8,12],予辛伐他汀组小鼠辛伐他汀混悬液3.52 mg/(kg·d)灌胃[12],予模型组及空白组等体积生理盐水灌胃,持续8周。
1.6 血清及组织标本采集
给药8周后取材,取材前12小时禁食不禁水,1%戊巴比妥钠(50 mL/kg)腹腔注射麻醉后摘眼球取血,室温静置2小时后,于4℃下4 000 r/min离心15分钟,分离上清液后于-80℃冰箱内冻存,每组随机选取6只用于检测血脂及炎症因子水平。打开胸腹腔,暴露心脏,分离主动脉,每组取3根完整主动脉置于4%多聚甲醛固定液中固定,用于大体油红O染色;取3根连有心脏的胸主动脉置于4%多聚甲醛固定液中固定,用于HE染色及免疫荧光染色;取3根主动脉用于实时荧光定量聚合酶链式反应(Real-time PCR,RT-PCR)分析,剩余主动脉组织置于冻存管后迅速于-80℃保存备用。
1.7 检测指标及方法
1.7.1 血脂检测 全自动生化分析仪检测血清中甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)和高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)的含量。
1.7.2 ELISA法检测血清中IL-6、TNF-α因子水平 严格按照ELISA试剂盒说明书操作,经包被、封闭、洗涤后依次按说明加入待检样品、抗体、酶结合物、显色底物,并最终加入硫酸终止反应。用酶标仪在450 nm波长处依次测得各孔吸光度值,根据标准品浓度和吸光度值做出标准曲线,最后根据标准曲线方程计算出血清中IL-6、TNF-α的浓度。
1.7.3 主动脉大体油红O染色 将固定好的主动脉剖开,先浸入60%的异丙醇3秒再于油红O染液中37℃避光染色60分钟后取出,浸入60%异丙醇分化至管腔内脂肪斑块呈红色、其他部位近无色,取出血管,滤纸吸除多余水分后镜下观察主动脉整体斑块形成情况并采集图像。Image-Pro Plus 6.0用于各组小鼠主动脉相对斑块面积图像分析。
1.7.4 主动脉窦部HE染色 将固定好的主动脉清洗、脱水后进行石蜡包埋,在主动脉窦处连续切取5 μm厚的组织切片,依次入环保型脱蜡液、无水乙醇、75%酒精后水洗,入苏木素染液染色后水洗、分化、水洗、反蓝、冲洗,再依次入85%、95%梯度酒精脱水后入伊红染液染色,再依次入无水乙醇脱水,二甲苯透明,中性树胶封片。镜下观察主动脉窦处AS病变情况并采集图像。
1.7.5 免疫荧光标记检测主动脉窦斑块内巨噬细胞标志物iNOS和Arg-1的相对表达 将主动脉窦处的石蜡切片脱蜡处理,并进行抗原修复。PBS冲洗后用10%BSA封闭30分钟,分别加入iNOS抗体(1∶500)和Arg-1抗体(1∶500),4°C孵育过夜,PBS洗涤后加入荧光二抗工作液(1∶300),室温孵育50分钟。DAPI染液染细胞核,避光室温孵育10分钟。滴加抗荧光淬灭剂封片后于荧光显微镜下观察并采集图像。
1.7.6 RT-PCR检测主动脉中巨噬细胞标志物iNOS和Arg-1 mRNA表达 用RNA提取液分别提取各组主动脉组织中的总RNA,并检测RNA浓度及纯度。按照试剂盒说明书进行反转录,然后进行PCR扩增,反应条件为95℃预变性30秒;95℃变性15秒,60℃退火30秒,40个循环,每升温0.5℃,采集一次荧光信号。选用β-actin作为内参基因,以2-△△CT法计算iNOS及Arg-1 mRNA的相对表达量。引物序列见表1。

表1 引物序列
1.8 统计学方法

2 结果
2.1 PNS对ApoE-/-小鼠血脂的影响
与空白组相比,模型组TG、TC、LDL水平均明显升高(P<0.01),HDL水平明显降低(P<0.01);与模型组相比,中、高剂量的PNS及辛伐他汀可显著降低血清TG水平(P<0.01),此外,低、中、高剂量的PNS及辛伐他汀均能显著降低血清TC、LDL水平(P<0.01),同时中、高剂量的PNS可显著升高血清HDL水平(P<0.01)。见表2。
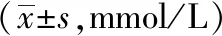
表2 PNS对ApoE-/-小鼠血脂水平的影响
2.2 PNS对ApoE-/-小鼠血清炎症因子的影响
与空白组相比,模型组血清IL-6、TNF-α水平显著升高(P<0.01)。与模型组相比,PNS低、中、高剂量组及辛伐他汀组均能降低血清中IL-6、TNF-α水平,差异具有统计学意义(P<0.01)。见表3。
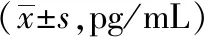
表3 PNS对ApoE-/-小鼠血清炎症因子的影响
2.3 PNS对ApoE-/-小鼠主动脉大体油红O染色的影响
主动脉大体油红O染色显示,空白组小鼠主动脉无明显红染,未见明显斑块形成。模型组小鼠主动脉弓处可见大面积红染斑块,胸、腹主动脉处可见大量散在的点、片状红染斑块。与模型组小鼠相比,PNS各剂量组的红染斑块面积随剂量的增加而逐渐减少。辛伐他汀亦能减少小鼠主动脉的斑块面积。斑块面积占主动脉总面积的定量分析表明,与空白组相比,模型组的相对斑块面积显著增加(P<0.05);与模型组相比,PNS中、高剂量组及辛伐他汀组均能显著降低主动脉相对斑块面积(P<0.05),PNS低剂量组亦能降低主动脉斑块面积(P>0.05)。见图1,表4。
图1 PNS对ApoE-/-小鼠主动脉大体油红O染色的影响

表4 PNS对ApoE-/-小鼠主动脉相对斑块面积的影响
2.4 PNS对ApoE-/-小鼠主动脉HE染色的影响
主动脉窦HE染色显示,空白组小鼠主动脉内膜结构完整、连续且表面光滑,未见AS斑块形成;模型组小鼠主动脉内膜结构紊乱,可见凸向管腔的大面积AS斑块,其内有大量泡沫细胞聚集,同时伴有胆固醇结晶沉积。各剂量PNS及辛伐他汀干预后,主动脉内膜结构较模型组均有所改善,AS斑块明显减少,病变程度明显减轻。见图2。
图2 PNS对ApoE-/-小鼠主动脉窦HE染色的影响(HE染色,×100)
2.5 PNS对ApoE-/-小鼠主动脉窦处斑块内M1型、M2型巨噬细胞标志物荧光强度的影响
图像中,蓝色为细胞核,红色为iNOS阳性表达,绿色为Arg-1阳性表达。与空白组相比,模型组的iNOS荧光强度增强;与模型组相比,经PNS各剂量组及辛伐他汀干预后M1型巨噬细胞标志物iNOS荧光强度降低,且PNS降低主动脉窦斑块内iNOS效果较辛伐他汀明显。与空白组相比,模型组Arg-1荧光强度变化不明显;与模型组相比,PNS干预后主动脉窦斑块内M2型巨噬细胞标志物Arg-1荧光强度增强,辛伐他汀组Arg-1荧光强度较模型组有所增强,但强度不及PNS各剂量组。见图3。
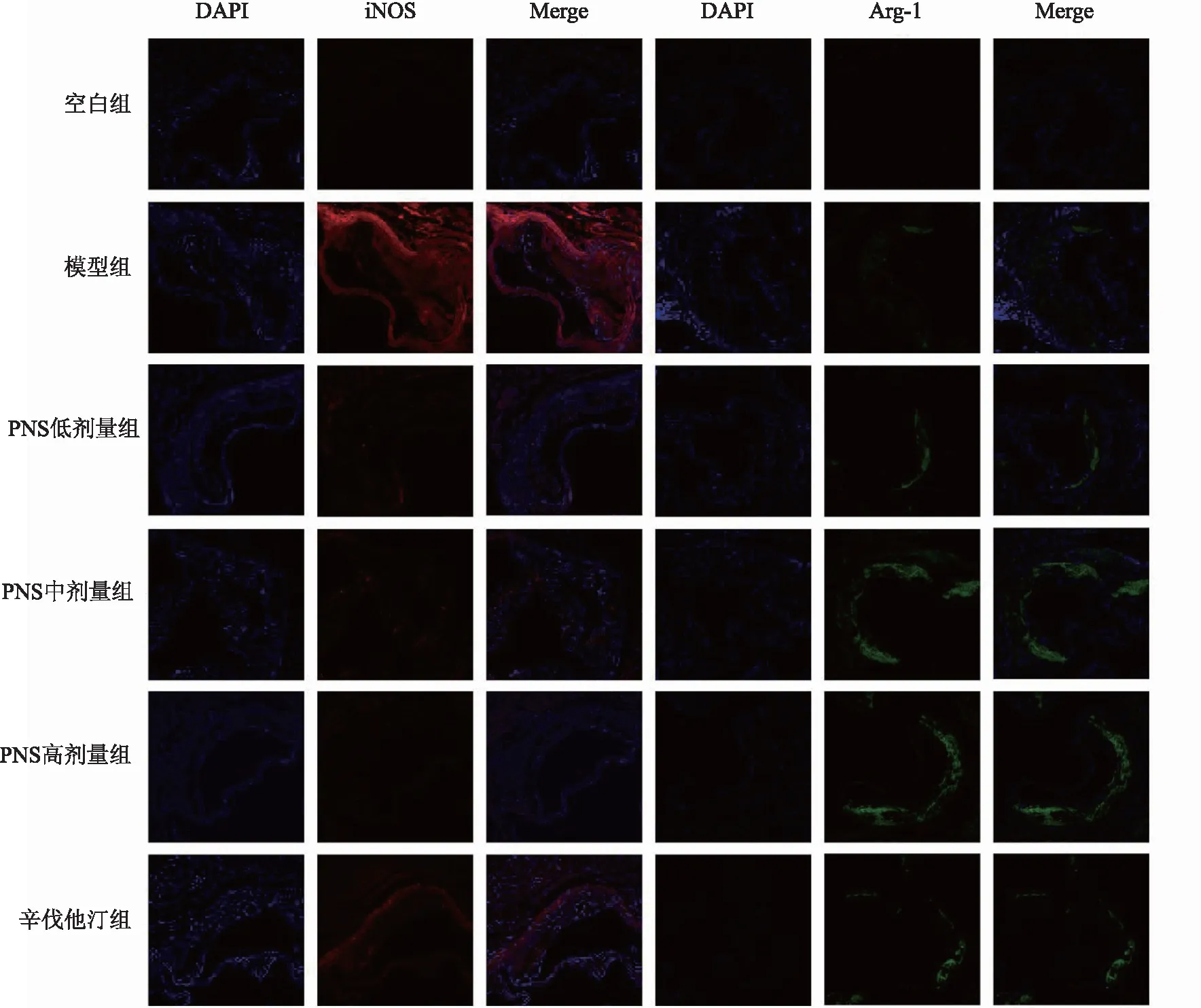
图3 PNS对ApoE-/-小鼠主动脉窦处斑块内M1型、M2型巨噬细胞标志物荧光强度的影响(×200,50μm)
2.6 PNS对ApoE-/-小鼠主动脉中M1型、M2型巨噬细胞标志物表达的影响
与空白组相比,模型组主动脉的M1型巨噬细胞标志物iNOS mRNA的相对表达显著升高(P<0.01),M2型巨噬细胞标志物Arg-1 mRNA的相对表达显著降低(P<0.01)。与模型组相比,PNS低、中、高剂量组及辛伐他汀组均能够显著降低主动脉iNOS mRNA的相对表达(P<0.01),PNS低、中、高剂量组还可显著增加主动脉Arg-1 mRNA的相对表达(P<0.01)。见表5。
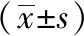
表5 PNS对ApoE-/-小鼠主动脉中M1型、M2型巨噬细胞标志物mRNA表达的影响
3 讨论
《中国心血管健康与疾病报告2021》[13]显示,我国目前心血管病(cardiovascular disease,CVD)患病人数已达到3.3亿,且CVD患病率仍处于上升阶段,CVD已成为我国重大公共卫生问题。AS是CVD的病理基础,防治AS刻不容缓。
血脂异常是导致AS发生和发展的主要危险因素之一。脂蛋白,特别是LDL-C通过受损的内皮细胞在血管内膜处过度沉积,并经过氧化修饰成为氧化型低密度脂蛋白(oxidizedlowdensitylipoprotein,ox-LDL),进一步损害内皮细胞,触发单核细胞的募集、激活并分化为巨噬细胞,巨噬细胞通过清道夫受体吞噬ox-LDL,转换为泡沫细胞,形成AS的早期病变即脂质条纹,随后平滑肌细胞增殖、迁移,胶原纤维增多,进一步发展为AS斑块[14]。大量研究证实,血脂水平与AS病变程度关系密切,血清LDL-C水平的升高可促进主动脉根部脂质的沉积,而当特定基因的敲除导致血浆脂质水平显著降低时,AS病变面积及斑块厚度显著减少,同时伴随着巨噬细胞的浸润减少[15-16]。与既往研究结果一致,本研究结果表明PNS可显著降低血脂水平,减少AS斑块面积,对AS有较好的干预作用。
血管炎症是动脉粥样硬化进展和斑块破裂的关键驱动因素,抑制炎症反应对于AS的防治具有重要意义。其中,炎性细胞因子是抗炎治疗的重要干预靶点[17-18]。IL-6及TNF-α是与AS发生密切相关的炎性因子[19-21]。一项针对有高AS风险但无任何临床炎症表现人群的RESCUE研究指出,IL-6抑制剂能够显着降低与AS相关的炎症反应,且效果呈剂量依赖性[21-22];Nallasamy等[23]的体内外研究亦表明,降低TNF-α水平可减少单核细胞对血管内皮细胞的粘附,进而减轻血管内皮炎症反应,起到心肌保护作用。本研究中PNS干预8周可以显著降低AS模型小鼠血清中IL-6及TNF-α水平,减轻AS炎症反应的程度。
巨噬细胞极化在AS的形成中扮演重要角色,能够影响AS斑块内的炎症反应及斑块稳定性[24]。研究发现调控巨噬细胞极化过程中抗炎与促炎表型之间的平衡,是治疗AS的重要作用靶点。Song等[25]的体内外研究证实过表达miR-30a-5p可降低M1型/M2型巨噬细胞的比率,进而降低血浆中IL-6、TNF-α等促炎因子水平,增加抗炎因子水平,同时明显减少主动脉根部病变面积。Laura等[26]研究发现,通过特异性敲除白细胞分化抗原40上调M2型巨噬细胞标志物相关基因的表达后,炎症相关基因的表达显著降低,AS斑块的病变程度和斑块稳定性亦随之改善。本研究发现,PNS干预AS模型小鼠8周后,M2型巨噬细胞标志物Arg-1的表达显著升高,M1型巨噬细胞标志物iNOS的表达显著降低,表明PNS可通过调控巨噬细胞极化,即促进M1型巨噬细胞极化、抑制M2型巨噬细胞极化,进而改善炎症反应,起到AS治疗效果。
综上,PNS干预能够降低AS模型小鼠的血脂水平,抑制炎症因子IL-6及TNF-α的分泌,减少AS斑块面积,这可能与PNS可减少M1型促炎巨噬细胞的极化,增加M2型抗炎巨噬细胞极化,进而减轻炎症反应有关。本研究为临床进一步探究PNS抗AS的效应机制提供了新的理论依据,但其干预巨噬细胞极化的具体途径仍有待进一步研究。
