干旱及病原菌胁迫对兴安落叶松菌根苗光合生理的影响
2023-11-28汤杰张岩张敏王非
汤杰 张岩 张敏 王非




摘 要:為探究外生菌根真菌(ectomycorrhizal fungi,ECMF)在兴安落叶松(Larix gmelini)应对生物及非生物共同胁迫逆境中的作用,以兴安落叶松为供试材料,通过对兴安落叶松接种常见且易于分离的2种ECMF血红铆钉菇(Gomphidius rutulus,Gr)、美味牛肝菌(Boletus edulis,Be)及病原菌中的尖孢镰刀菌(Fusarium oxysporium,Fu)后,进行控水试验,分析干旱及镰刀菌胁迫下ECMF对兴安落叶松幼苗光合生理的影响。结果表明,接种ECMF在不同胁迫处理下均能提高兴安落叶松幼苗各光合指标,有效促进幼苗光合作用,其中混合接种Gr+Be组合处理对幼苗光合作用的促进作用优于单独接种Gr和单独接种Be。随着干旱处理程度加剧,幼苗的净光合速率、胞间二氧化碳浓度、气孔导度、蒸腾速率、PSII最大光化学量子产量、PSII实际光化学量子产率和光化学猝灭系数均呈逐渐下降趋势;接种尖孢镰刀菌处理的幼苗与CK处理相比,各指标均降低,且干旱尖孢镰刀菌处理有交互作用,复合胁迫对植物光合作用造成的伤害大于单一胁迫。接种ECMF能有效缓解单一胁迫及复合胁迫逆境对植株光合作用的抑制,对提高兴安落叶松抗性及大兴安岭造林有一定作用。
关键词:兴安落叶松;外生菌根真菌;干旱;病原菌;光合
中图分类号:S791.222 文献标识码:A 文章编号:1006-8023(2023)06-0026-10
Effects of Drought and Pathogenic Stress on Photosynthetic Physiology
of Larix gmelinii Mycorrhizal Seedlings
TANG Jie, ZHANG Yan, ZHANG Min, WANG Fei
(College of Landscape Architecture, Northeast Forestry University, Harbin 150040)
Abstract:To investigate the role of ectomycorrhizal fungi (ECMF) in coping with biotic and abiotic stress adversity in Hingan larch (Larix gmelini), we took Larix gmelini as experimental materials. After inoculation of two common and easily isolated ECMFs, Gomphidius rutulus (Gr), Boletus edulis (Be) and pathogenic fungus Fusarium oxysporium (Fu) in Larix gmelini, by water control experiments, the effects of ECMF on photosynthetic physiology of Larix gmelini seedlings under drought and Fusarium stress were analyzed. The results showed that ECMF inoculation improved photosynthetic indexes and effectively promoted photosynthesis of seedlings under different stress treatments, among which the combined inoculation of Gr+Be was better than that of Gr alone and Be alone. The net photosynthetic rate, intercellular CO concentration, stomatal conductance, transpiration rate, PSII maximum photochemical quantum yield, PSII actual quantum yield, and photochemical burst coefficient all showed a gradual decrease; seedlings inoculated with Fusarium acuminatum treatment showed a decrease in all indexes compared with CK treatment, and there was an interactive effect of drought Fusarium acuminatum treatment, and the compound stress caused more damage to plant photosynthesis than single stress. Inoculation with ECMF can effectively alleviate the inhibition of plant photosynthesis by single and compound stress adversities, and has a role in improving the resistance of Larix gmelini and Daxing'anling afforestation.
Keywords:Larix gmelini; ECMF; drought; pathogens; photosynthesis
收稿日期:2023-02-11
基金项目:黑龙江省重点研发计划(GA21B010-02)。
第一作者简介:汤杰,硕士研究生。研究方向为园林植物应用。E-mail: 1781612724@qq.com
*通信作者:王非,博士,副教授。研究方向为园林植物种质资源、园林植物应用。E-mail: shuijing7539@163.com
引文格式:汤杰,张岩,张敏,等.干旱及病原菌胁迫对兴安落叶松菌根苗光合生理的影响[J].森林工程,2023,39(6):26-35.
TANG J, ZAHNG Y, ZHANG M, et al. Effects of drought and pathogenic stress on photosynthetic physiology of Larix gmelinii mycorrhizal seedlings [J]. Forest Engineering, 2023, 39(6):26-35.
0 引言
自工业革命以来,温室气体排放量逐年增加,随着全球气候变暖,干旱频发,其严重程度、持续时间明显增强,范围也越来越广。东北地区属气候敏感区,年降水量正逐年减少,整体呈暖干化趋势。这种非生物逆境严重影响了植物的生长,使植物关闭气孔,降低光合色素合成,影响光合电子传递过程,光合速率降低。同时在自然环境下,植物经常受到病原菌的侵害。其中致病性镰刀菌分布范围广,致病性强,能够引起植物的根腐病、猝倒病和枯萎病等多种病害,拥有100多种寄主植物;尖孢镰刀菌(Fusarium oxysporum, Fu)是其中一类重要的致病性镰刀菌,可以侵染所有植物种类,包括害松科的多种苗木,如落叶松(Larix gmelinii)、油松(Pinus tabuliformis)、赤松(Pinus densiflora)和马尾松(Pinus massoniana)等,致使植物腐烂、枯萎、猝倒,严重影响植物生长成活及作物产量。目前,这种非生物因素及生物因素共同作用的逆境亟待解决。在双重胁迫下,植株往往会表现出与受到单一胁迫不同的特征,有研究发现干旱与镉(Cd)复合胁迫并未使植物产生比单一胁迫更严重的负面效应,也有研究者发现,干旱和高温的复合胁迫较单一胁迫对植物造成了更严重的伤害。研究发现干旱或病原菌单一胁迫均能影响植物光合作用,抑制植物生长,但目前少有对干旱和病害复合胁迫对植物光合生理影响的研究。
目前对于病害的防治可以采用农业、化学和生物等多种手段,其中化学防治污染大、农业防治存在局限性,而生物防治效果佳成本低。外生菌根是能够直接联系植物与土壤的微生物类群之一,对维持土壤微生态系统稳定具有重要作用,其在针叶林中扮演着非常重要的角色,绝大多数针叶树通过与外生菌根共生来获取更多土壤养分。经研究表明,一些优良的外生菌根真菌(ectomycorrhizal fungi,ECMF)能增加根面积对土壤养分的吸收利用、促进宿主植物生长、提高其应对生物胁迫及非生物胁迫的抗逆性和改善土壤环境微生物群落结构,同时能够通过提高植物的光合作用,提高抗氧化酶活性,调节植物体内激素和矿质营养的平衡,在植物根际创造出适宜的微生物环境等途径来提高植物对干旱和病害条件的耐受作用,促进植物生长。研究发现ECMF能有效缓解植物在单一胁迫中受到的伤害,但有关ECMF在干旱、病原菌、干旱-病原菌复合胁迫下对植物的影响研究很少。干旱-病原菌复合胁迫机制还有待探寻。因此本研究对其进行初步探索。
兴安落叶松(Larix gmelini)为松科落叶松属的落叶乔木,是东北地区主要三大针叶林树种之一,不仅有很高的经济价值,在维持生态系统平衡、涵养水源等方面也具有极大的作用,具有极高的生态修复价值。研究表明,大兴安岭显著受气候变化影响,未来气候总体上仍将呈现暖干化趋势,且近年来自然灾害频发,森林植被受到严重破坏,水土流失严重,生态恢复困难。兴安落叶松作为林区的优势树种,其恢复对大兴安岭林区森林恢复与更新有关键性作用。选用兴安落叶松为研究对象,以期为兴安落叶松苗的园林应用及大兴安岭森林恢复提供技术支持。
前人研究发现,1年生落叶松幼苗造林生长速度更快,苗木品质和成活率更高,其研究和培育更有利于为造林提供理论基础。因此,本研究以1年生兴安落叶松幼苗为研究对象,通过接种ECMF,对兴安落叶松进行水分控制及接种导致猝倒病主要病原菌之一的尖孢镰刀菌处理,从而探讨ECMF对干旱、病原菌单一胁迫和干旱-病原菌复合胁迫逆境下兴安落叶松幼苗光合特性的调控作用,对缓解兴安落叶松在逆境中受到的伤害、兴安落叶松造林和园林绿化应用,以及大兴安岭等地森林恢复提供理论依据。同时干旱和病原菌的复合胁迫也能从一定程度上代表非生物和生物的共同胁迫,为今后复合胁迫的研究提供理论依据。
1 材料与方法
1.1 试验材料
试验材料为1年生兴安落叶松幼苗,种子由内蒙古大兴安岭重点国有林管理局提供,所用基质为沙子、蛭石、草炭土按体积比2∶2∶1混合。供试菌种血红铆钉菇(Gomphidius rutulus,Gr)、美味牛肝菌(Boletus edulis,Be)、尖孢镰刀菌(Fusarium oxysporium,Fu),菌種保存于东北林业大学园林学院试验室。
1.2 试验设计
试验设计为4个外生菌根菌种处理,分别为Be、Gr、Gr+Be和Ck(对照处理,不接种ECMF);5个水分处理,分别为正常水分处理对照组(CK)、轻度干旱(Little Drought, LD)、中度干旱(Middle Drought,MD)、重度干旱(Severe Drought ,SD)和特重干旱(The Driest,TD),田间持水量分别为 100%、80%、70%、60%、40%和 20%;2个病原菌处理,分别为尖孢镰刀菌处理(Fu)、不施加尖孢镰刀菌的对照处理CK;共40个处理,每个处理设取3个重复。
1.3 试验方法
试验于2020年10月在东北林业大学温室进行,挑选饱满健壮的兴安落叶松种子,将种子置于铺设2层湿润滤纸的培养皿中,用黑布遮光处理,放于4 ℃冰箱10 d进行低温打破休眠,每日喷水。10 d后将种子用体积分数为2%的次氯酸钠溶液搅拌、消毒10 min,用去离子水冲洗干净,点播于已灭菌的育苗秧盘基质内,放于25 ℃、16 h光照培养室内培养,2个月后将幼苗接种外生菌根真菌并移入花盆。
接菌前将真菌菌种采用马铃薯葡萄糖琼脂培养基(Potato Dextrose Agar,PDA)培养,置于25 ℃条件下7 d,菌丝长满后用打孔器取边缘菌块直径大约8 mm,置于PDA液体培养基培养,并放入摇床内培养10 d,摇床温度25 ℃,转速120 r/min。病原菌菌种培养方法同真菌菌种,液体培养时间为8 d。
接真菌Gr、Be时选取长势相似的幼苗小心挖出,将其放置于盛有蒸馏水的容器内使幼苗根部土壤自由散落,并用蒸馏水清洗根部,将液体培养后的真菌溶液磨碎,制成菌液,并将幼苗根部浸泡到菌液中42 h,后将幼苗移栽到盆中,每个花盆一株幼苗,固定幼苗后压实,在土壤表面覆盖一层经灭菌处理过的蛭石以防止水分蒸发。将移栽后幼苗置于25 ℃恒温、每日光照时长16 h的光照培养室内进行培养。
8个月后进行病原菌接种及水分处理。病原菌接种是用注射器将调配好的悬浮液从苗的根部相近位置前后左右4个方向注入,每盆5 mL。将处理完的幼苗放于温度为25 ℃,时间为16 h光照培养室内进行培养,为减少位置不同带来的差异,每月进行1次组间位置调换,每周进行1次组内位置调换;水分控制采用称重法,计算每盆土壤应该达到的土壤含水量,第一次补充土壤含水量到要保持的值并称重,每隔3 d进行称重补水补充到重量与第一次相同。于2个月后结束胁迫试验,开始指标测定。
1.4 指标测定
使用LI-6400XT便携式光合仪于每天9:00—11:00测定净光合速率(Net photosynthetic rate,P)、气孔导度(StomatalConductance ,C)、胞间二氧化碳浓度(Intercellular CO concentration,C)、蒸腾速率(Transpiration rate ,T);使用便携式叶绿素荧光仪测定PSII最大光化学量子产量、PSII实际光化学量子产率、光化学猝灭系数。每个处理选取3~5片生长位置与生长状态一致的叶片进行测定,测定结果取平均值。
1.5 数据分析
采用SPSSv26.0软件对数据进行数据分析,采用Mircrosoft Excel 2019进行数据整理及图表制做。
2 结果与分析
2.1 对幼苗净光合速率的影响
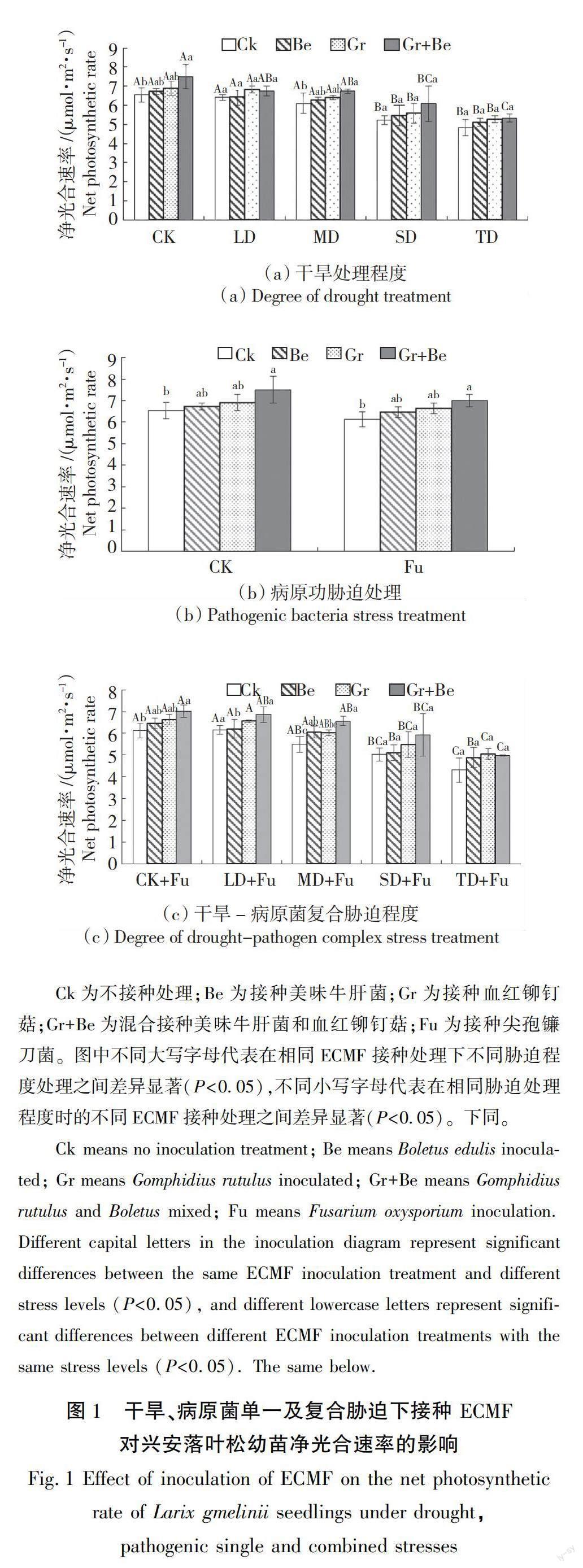
由图1可知,不同胁迫及接种处理都会影响兴安落叶松幼苗的净光合速率。在干旱单一胁迫时,4个ECMF接种处理幼苗净光合速率随干旱程度加重而逐渐下降,TD处理时,Ck、Be、Gr、Gr+Be接种处理幼苗的净光合速率比未进行胁迫时分别下降了26.11%、24.07%、23.49%、28.93%。幼苗的净光合速率在病原菌单一胁迫处理时低于未胁迫处理的幼苗,4个ECMF接种处理分别比未胁迫处理低6.25%、3.90%、3.97%、6.64%。在干旱-病原菌复合胁迫处理时,幼苗净光合速率随胁迫处理程度加重而逐渐降低,TD+FU处理时,Ck、Be、Gr、Gr+Be接种处理幼苗的净光合速率比未进行胁迫时分别下降了29.68%、24.28%、23.95%、29.02%。结果表明,干旱、病原菌单一及复合胁迫处理均会使幼苗净光合速率降低,而复合胁迫下的幼苗净光合速率也明显低于单一胁迫,且各处理间有显著差异(P<0.05)。
接种不同ECMF菌种对兴安落叶松幼苗净光合速率影响不同。同种胁迫条件下,与Ck相比其余各ECMF接种处理均显著提高了幼苗的净光合速率,但除CK和MD处理下Gr+Be菌剂与CK相比有显著差异(P<0.05)外,其余各处理中各ECMF处理并无显著差异。未进行胁迫时,施加Be、Gr、Gr+Be的植株净光合速率分别比Ck增加了2.8%、5.62%、14.79%。干旱单一胁迫处理时,施加Be、Gr、Gr+Be的植株净光合速率分别比Ck提高了0.62%~5.64%、5.62%~9.37%、5.36%~16.66%;病原菌单一胁迫处理时,施加Be、Gr、Gr+Be菌剂的植株净光合速率分别比Ck增加了5.38%、8.19%、14.31%。干旱-病原菌复合胁迫处理下,施加Be、Gr、Gr+Be的植株净光合速率分别比Ck提高了0.90%~13.46%、6.63%~17%、11.51%~19.41%。
2.2 对幼苗胞间二氧化碳浓度的影响
不同的接种处理和胁迫处理对兴安落叶松幼苗胞间二氧化碳浓度有不同影响,如图2所示。在干旱单一胁迫和干旱-病原菌复合胁迫时时,4个接种处理的幼苗随胁迫程度加重幼苗胞间二氧化碳浓度逐渐降低,在TD和TD+Fu处理时最低,分别比CK处理降低了4%、6.45%、8.57%、7.55%和7.27%、6.15%、3.9%、2.93%。病原菌单一胁迫处理时,各ECMF接种处理幼苗的胞間二氧化碳逆浓度均低于对照,分别降低了1.17%、2.31%、0.73%、0.96%。
在未进行胁迫处理时,接种ECMF显著增加了幼苗的胞间二氧化碳浓度(P<0.05),接种Be、Gr、Gr+Be的幼苗胞间二氧化碳浓度分别比Ck增加了1.53%、3.89%、5.26%。在干旱单一胁迫及干旱-病原菌复合胁迫处理下,接种ECMF也提高了幼苗胞间二氧化碳浓度,接种Be、Gr、Gr+Be的幼苗胞间二氧化碳浓度分别是Ck幼苗的0.99~1.05、0.99~1.05、1.01~1.07倍。而在病原菌单一胁迫处理下,接种Be、Gr、Gr+Be的幼苗胞间二氧化碳浓度分别是Ck幼苗的1.0、1.04、1.05倍。
2.3 对幼苗气孔导度的影响
在干旱单一胁迫处理及干旱-病原菌复合胁迫处理下,兴安落叶松幼苗的气孔导度随胁迫程度加重而逐渐下降,如图3所示。在TD和TD+Fu处理时,4个ECMF接种处理幼苗气孔导度分别比CK和CK+Fu处理下降了21.34%和14.95%、9.97%和11.35%、11.73%和8.46%、10.86%和12.66%。病原菌单一胁迫处理时,4个ECMF接种处理下的幼苗气孔导度比CK处理幼苗低12.15%、11.13%、9.65%、7%。结果表明干旱、病原菌单一及复合胁迫会使幼苗气孔导度下降。
接种ECMF显著提升了幼苗的气孔导度(P<0.05),提高效果表现为混合接种Gr+Be优于单独接种Be或Gr。未进行胁迫时,接种Be、Gr、Gr+Be的幼苗气孔导度比Ck增加了4.5%、4.95%、19.61%。干旱单一胁迫和病原菌单一胁迫处理时,接种Be、Gr、Gr+Be的幼苗气孔导度分别是Ck的1.03~1.2倍和1.06倍、1.05~1.78倍和1.08倍、1.2~1.36倍和1.27倍。复合胁迫时,接种Be、Gr、Gr+Be的幼苗气孔导度分别是CK的1.06~1.14、1.08~1.94、1.27~1.38倍。结果表明,在胁迫条件下接种ECMF能够显著提高植株的气孔导度(P<0.05)。
2.4 对幼苗蒸腾速率的影响
由图4可以看出,干旱、病原菌单一及复合胁均能降低植株的蒸腾速率。在干旱胁迫和干旱-病原菌复合胁迫处理下,幼苗蒸腾速率随胁迫程度加重而逐渐下降;在TD、TD+Fu条件下,4个ECMF接种处理的幼苗蒸腾速率分别比CK、CK+Fu处理下降了20.91%、85.56%;20.44%、53.58%;31.16%、50.76%;17.4%、71.89%。Fu处理时,4个ECMF接种处理的幼苗蒸腾速率分别比CK处理下降了19.42%、5.07%、26.23%、8.08%。
接种ECMF可以提高幼苗的蒸腾速率,表现效果为混合接种Gr+Be优于单独接种Be或Gr,且接种Gr+Be与其他处理有显著差异(P<0.05)。未进行胁迫时,接种Be、Gr、Gr+Be的幼苗蒸腾速率是Ck的1.02、1.2、1.39倍。干旱、病原菌单一及复合胁迫处理时,接种Be、Gr、Gr+Be的幼苗蒸腾速率分别比Ck提高了1.02%~60.32%、4.1%~45%、25.39%~111.54%。
2.5 对幼苗净叶绿素荧光参数的影响
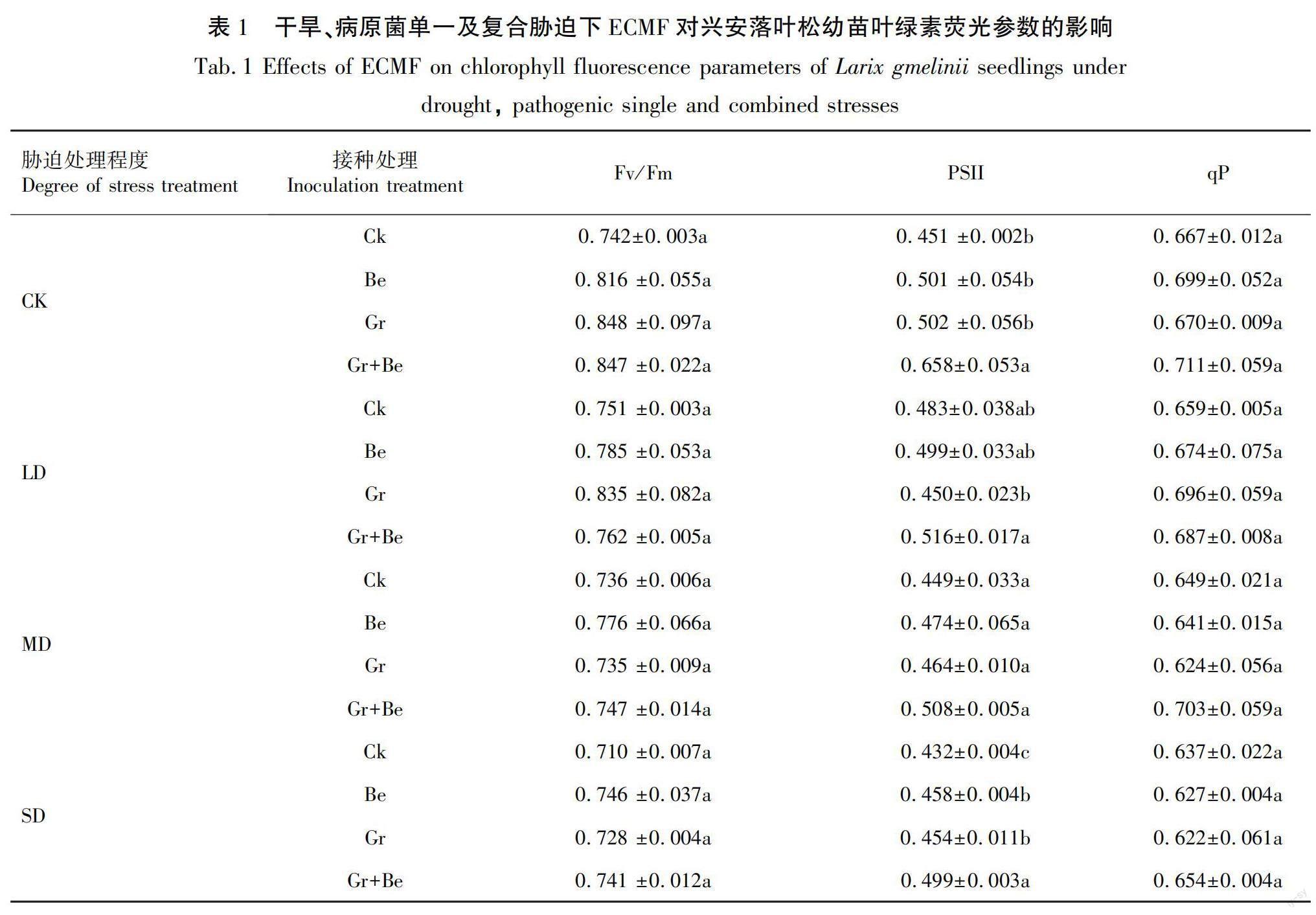
由表1可知,各ECMF处理均提高了幼苗的PSII最大光化学量子产量(Fv/Fm)、PSII实际光化学量子产率(PSII)、光化学猝灭系数(qP),效果表现为混合接种优于单独接种,但各处理间无显著差异(P<0.05)。未进行胁迫处理时,接种Be、Gr、Gr+Be的Fv/Fm分别比CK处理提高了9.97%、14.29%、14.15%;PSII分别比CK处理提高了11.09%、11.31%、45.9%;qP分别比CK处理提高了4.8%、0.45%、6.6%。在干旱、病原菌单一及复合胁迫处理下,接种Be、Gr、Gr+Be的Fv/Fm分别比Ck处理提高了0.14%~9.97%、0.27%~14.29%、1.37%~14.15%;PSII分别比Ck处理提高了0.89%~11.09%、2.23%~11.31%、6.83%~45.9%;qP分别比Ck处理提高了0.32%~4.8%、0.45%~5.61%、1.76%~8.32%。
随着干旱程度加剧,Fv/Fm、PSII和qP均呈现逐渐降低的趋势。复合胁迫下植株的Fv/Fm、PSII和qP均低于单一胁迫,说明干旱、病原菌单一胁迫会降低兴安落叶松幼苗的各叶绿素荧光参数,复合胁迫会加剧降低效果,而施加ECMF会缓解各胁迫对植株叶绿素荧光参数的降低效应。
4 讨论与结论
光合作用是地球上非常重要的化学反应,是植物与环境进行物质转换、能量交换的基础和关键。而光合作用在很大程度上受环境影响,植物的光合作用对水分胁迫尤为敏感。净光合速率是指植物进行光合作用吸收CO的速率减去呼吸作用产生CO的速率,是判定植物光合作用大小的直接指标。气孔是植物表皮特有的结构,通常存在于植物的地上部分,是植物叶片与外界进行气体交换的通道,氧气和二氧化碳等气体都是通过气孔进行扩散。干旱胁迫会降低植物叶片含水量,导致叶片保卫细胞失水,细胞膨压降低,因此植物会关闭气孔以减少失水,而气孔的部分关闭导致植物正常进行光合作用所需的二氧化碳不能被保证,使植物光合速率降低。病原菌可以通过植物叶片上的气孔或者是皮孔侵入以及侵染植物组织,严重时会影响植物营养供应,导致植物缺乏参与复杂生化反应过程的必要养分,次生代谢产物的产生量无法满足植物自身需求,植物免疫力将会下降;若导致局部细胞死亡,则会阻碍导管水分运输,最终使植株死亡。植物在阳光下进行光合作用,通过气孔吸收二氧化碳,所以气孔必须打开,而气孔张开就会发生蒸腾作用,气孔根据环境条件的变化来调节自身张开的大小,从而保证在亏损较少量水分的情况下获得较多的二氧化碳,气孔导度与植物的蒸腾作用有密切的关联。蒸腾速率表示在一定时间内植物单位叶面积蒸腾的水量,是反映植物蒸腾作用的一个重要指标。遗传生物学特征、土壤水分和环境都是植物蒸腾速率的影响因子,土壤相对含水量降低容易引起叶片气孔导度下降,降低蒸腾速率。胁迫导致植物光合作用降低的机制包括气孔限制和非气孔限制2个方面。氣孔因素即是由于气孔关闭引起 CO供应受阻,非气孔因素为叶肉细胞光合活性下降,除此之外,也有研究认为光合作用水平下降是气孔与非气孔限制共同作用的结果。Zhang等研究表明,花叶鹅掌柴、龙船花等6种园林灌木叶片细胞的胞间 CO浓度、净光合速率和气孔导度均随着干旱胁迫的加剧而下降;谢奎忠等发现尖孢镰刀菌侵染马铃薯后,净光合速率显著下降。本研究表明,干旱、镰刀菌单一胁迫及复合胁迫均能引起植物P、C、C、T的下降,且干旱镰刀菌存在互作效应,会加剧这种下降趋势,说明胁迫严重限制了兴安落叶松幼苗的光合作用,而C与C变化趋势一致,说明气孔限制是主要因素。施加ECMF后,显著提高了各胁迫处理幼苗的P、C、C、T,从而缓解了逆境中对植株光合作用的抑制;且ECMF在组合中,Gr+Be效果最佳,与其他处理有显著差异。
叶绿素荧光参数可以直接反映植物遭遇胁迫时植物的光合作用特性,近些年已经成为筛选抗性强高光效品种的常用指标。跟传统的光合气体交换参数比较,叶绿素荧光参数可以更直观反映植物光合的内在特性,最大光化学量子产量Fv/Fm可以反映植物潜在的最大光合作用效率;植物在适宜的环境条件下Fv/Fm变化幅度并不大,但在胁迫条件下这个比值会呈现出下降趋势,是反映胁迫程度简单而又快捷的途径,一定程度上Fv/Fm的下降幅度与植物受伤害程度成正比。实际光化学量子产率PSII可以反映植物的实际光化学效率;朱成刚等研究发现,胁迫程度越严重,胡杨的实际光化学效率下降越显著。光化学淬灭系数qP表示PSII反应中心的开放程度,是植物中色素吸收的光能应用于光化学反应中电子传递的部分所占的比例,能反映植物光合活性的高低;qP值的大小与光系统Ⅱ反应的活性有关,活性越大,qP越大,也表示电子传递活性越大。路秉翰等研究表明,干旱胁迫下,红玉姜黄的Fv/Fm、PSII、qP以及ETR均有一定程度的下降,說明胁迫对其PSII反应中心造成了损伤。谢奎忠等的研究也表明尖孢镰刀菌侵染马铃薯后,Fv/Fm、PSII、 qP均显著下降。本研究发现,干旱、镰刀菌单一胁迫均能破坏幼苗光反应中心,引起幼苗叶绿素荧光参数的下降,且随干旱程度加重,各指标逐渐下降;干旱镰刀菌存在互作效应,复合胁迫使幼苗光系统受到更严重的伤害。这与陈雪妮等的结论一致。而施加ECMF能有效缓解各指标的下降,缓解逆境对光合原初反应的抑制。研究认为,ECMF可以通过调节植物的光合作用等生理过程及其他代谢过程,从而促进生长,增强植物的抗病性、抗旱性及在复合胁迫中的抗性。接种ECMF后,真菌与兴安落叶松根系形成庞大的菌丝共生网络结构,这种结构会帮助植物吸收土壤中的水分和氮、钾等营养元素的吸收,减少根系水分丧失,加叶绿素含量,从而提高叶绿素荧光参数,同时菌根分泌物对根际环境的调控作用也会帮助植株生长,促进光合作用等,进而在一定程度上提高兴安落叶松幼苗的抗旱性、抗病性及在复合胁迫中的抗性。
【参 考 文 献】
[1] 杨柳.干旱对兴安落叶松水分参数的影响[D].哈尔滨:东北林业大学,2015.
YANG L. The influence of drought on water parameters of Larix gmelinii[D]. Harbin: Northeast Forestry University, 2015.
[2]王谦.中国干旱、半干旱地区的分布及其主要气候特征[J].干旱地区农业研究,1983,1:11-24.
WANG Q. Distribution of the arid and semiarid areas in China and their major climatic characteristics[J]. Agricultural Research in the Arid Areas, 1983, 1: 11-24.
[3]刘守杰,汤玉玲.半干旱地区水资源平衡与节水策略研究[J].森林工程,2003,19(5):12-13.
LIU S J, TANG Y L. Water resources balance and water-saving policies in half-arid regions[J]. Forest Engineering, 2003, 19(5): 12-13.
[4]WU F Z, BAO W K, LI F L, et al. Effects of water stress and nitrogen supply on leaf gas exchange and fluorescence parameters of Sophora davidii seedlings[J]. Photosynthetica, 2008, 46(1): 40-48.
[5]范晓龙.油松抗猝倒病外生菌根菌种的筛选[J].山西林业科技,2013,42(4):1-4,39.
FAN X L. Ectomycorrhiza strain select on resistance to damping-off of Pinus tabulaeformis[J]. Shanxi Forestry Science and Technology, 2013, 42(4): 1-4, 39.
[6]王献慧,魏林,梁志怀,等.镰刀菌属遗传多样性的ISSR分析[J].长江蔬菜,2012(16):12-15.
WANG X H, WEI L, LIANG Z H, et al. ISSR analysis on genetic diversity of Fusarium[J]. Journal of Changjiang Vegetables, 2012(16): 12-15.
[7]刘选茹,陈良华,张健,等.干旱及镉污染对巨菌草生理和镉富集特征的影响[J].西北植物学报,2019,39(2):277-284.
LIU X R, CHEN L H, ZHANG J, et al. Effects of drought and cadmium pollution on the physiology and cadmium enrichment of Pennisetum sinese[J]. Acta Botanica Boreali-Occidentalia Sinica, 2019, 39(2): 277-284.
[8]谢鹏飞,倪锋,褚荣浩,等.高温干旱复合胁迫下夏玉米冠层日光诱导叶绿素荧光与光合参数的关联机制[J].江苏农业科学,2022,50(16):65-72,78.
XIE P F, NI F, CHU R H, et al. Correlation mechanism between canopy solar-induced chlorophyll fluorescence and photosynthetic parameters of summer maize under compound stress of heat and drought[J]. Jiangsu Agricultural Sciences, 2022, 50(16): 65-72, 78.
[9]彭思利,王晓燕,李剑,等.外生菌根真菌接种对干旱胁迫下构树幼苗生长及光合特性的影响[J].生态学杂志,2021,40(9):2719-2726.
PENG S L, WANG X Y, LI J, et al. Effects of ectomycorrhizal fungi inoculation on growth and photosynthetic characteristics of Broussonetia papyrifera seedlings under drought stress[J]. Chinese Journal of Ecology, 2021, 40(9): 2719-2726.
[10]李敏.外生菌根菌增強马尾松苗木抗旱性的生理和分子机理研究[D].贵阳:贵州大学,2021.
LI M. Physiological and molecular mechanism of ectomycorrhizal fungi enhancing drought resistance of Pinus massoniana seedlings[D]. Guiyang: Guizhou University, 2021.
[11]陆兴杨.外生菌根真菌提高马尾松幼苗的抗旱性研究进展[J].安徽农学通报,2019,25(8):25-28,30.
LU X Y. Research of ectomycorrhizae to drought resistance of Pinus massoniana seedlings[J]. Anhui Agricultural Science Bulletin, 2019, 25(8): 25-28, 30.
[12]AMIRI R, NIKBAKHT A, ETEMADI N. Alleviation of drought stress on rose geranium [Pelargonium graveolens (L.) Herit.] in terms of antioxidant activity and secondary metabolites by mycorrhizal inoculation[J]. Scientia Horticulturae, 2015, 197: 373-380.
[13]盛后财.大兴安岭北部兴安落叶松林生态水文特征研究[D].哈尔滨:东北林业大学,2021.
SHENG H C. Ecohydrological characteristics of Larix gmelinii forest in the north of daxing'an mountains[D]. Harbin: Northeast Forestry University, 2021.
[14]CHO E J, LEE D J, DO WEE C, et al. Effects of AMF inoculation on growth of Panax ginseng C.A. Meyer seedlings and on soil structures in mycorrhizosphere[J]. Scientia Horticulturae, 2009, 122(4): 633-637.
[15]孙玉军,张俊,韩爱惠,等.兴安落叶松(Larix gmelini)幼中龄林的生物量与碳汇功能[J].生态学报,2007,27(5):1756-1762.
SUN Y J, ZHANG J, HAN A H, et al. Biomass and carbon pool of Larix gmelini young and middle age forest in Xing'an Mountains Inner Mongolia[J]. Acta Ecologica Sinica, 2007, 27(5): 1756-1762.
[16]刘道锟,孙海龙,甘秋妹,等.大兴安岭干旱阳坡不同植被退化阶段土壤理化性质与物种多样性研究[J].森林工程,2016,32(2):1-6.
LIU D K, SUN H L, GAN Q M, et al. Soil physicochemical properties and plant species diversity of different vegetation degradation stages in arid sunny-slope of great Xing'an Mountains[J]. Forest Engineering, 2016, 32(2): 1-6.
[17]亦连肇,刘秀琴,丁维纲,等.不同苗龄落叶松造林效果分析[J].吉林林业科技,1993,22(2):49-51.
YI L Z, LIU X Q, DING W G, et al. Analysis on afforestation effect of larch with different seedling ages[J]. Forestry Science and Technology, 1993, 22(2): 49-51.
[18]邱鈺明.兴安落叶松真菌育苗成效及其高光谱响应研究[D].北京:北京林业大学,2020.
QIU Y M. Research on Larix gmelinii fungal seedling efficacy and its hyperspectral response[D]. Beijing: Beijing Forestry University, 2020.
[19]牟静.干旱和盐胁迫对四个绿化物种光合特性影响的研究[D].兰州:兰州大学,2020.
MU J. Effects of drought and salt stresses on photosynthetic characteristics of the four greening species[D]. Lanzhou: Lanzhou University, 2020.
[20]高文蕊,胡银松,王瑞芳,等.干旱条件下叶黄素循环抑制剂对欧李光合指标的影响[J].森林工程,2015,31(2):71-74.
GAO W R, HU Y S, WANG R F, et al. Impact of xanthophyll cycle inhibitors on Cerasus humilis photosynthesis indices under drought stress[J]. Forest Engineering, 2015, 31(2): 71-74.
[21]付佳琳.北方草原植物叶片光合色素对干旱的响应[D].沈阳:沈阳大学,2021.
FU J L. Response of photosynthetic pigments in northern grassland plant leaves to drought[D]. Shenyang: Shenyang University, 2021.
[22]谢田玲,沈禹颖,邵新庆,等.黄土高原4种豆科牧草的净光合速率和蒸腾速率日动态及水分利用效率[J].生态学报,2004,24(8):1679-1686.
XIE T L, SHEN Y Y, SHAO X Q, et al. Differences in photosynthetic rate, transpiration rate and water use efficiency between four legume species on the Loess Plateau[J]. Acta Ecologica Sinica, 2004, 24(8): 1679-1686.
[23]张静懿.生长素调控气孔发育的功能和作用分子机理的研究[D].上海:上海交通大学,2015.
ZHANG J Y. The function and molecular mechanism of auxin in regulating stomatal development[D]. Shanghai: Shanghai Jiao Tong University, 2015.
[24]纪莎莎.基于作物叶片尺度水分高效利用的气孔最优调控机理研究与应用[D].北京:中国农业大学,2017.
JI S S. Research and application of the optimal stomatal regulation mechanism based on the crop efficient water use at leaf scale[D]. Beijing: China Agricultural University, 2017.
[25]赵文赛.玉米叶片气孔发育对干旱的响应以及重复干旱对玉米光合作用和抗旱性的影响[D].杨凌:西北农林科技大学,2016.
ZHAO W S. Responses of leaf stomatal development to drought and effects of repeated drought on photosynthesis and drought resistance of maize[D]. Yangling: Northwest A & F University, 2016.
[26]ENGINEER C B, HASHIMOTO-SUGIMOTO M, NEGI J, et al. CO sensing and CO regulation of stomatal conductance: advances and open questions[J]. Trends in Plant Science, 2016, 21(1): 16-30.
[27]韩阳瑞,单炜,许大为,等.干旱区3种典型灌木光合特性及其对环境因子的响应[J].西部林业科学,2021,50(1):64-70.
HAN Y R, SHAN W, XU D W, et al. Photosynthetic characteristics of three typical shrubs in arid region and their response to environmental factors[J]. Journal of West China Forestry Science, 2021, 50(1): 64-70.
[28]WEHR R, COMMANE R, MUNGER J W, et al. Dynamics of canopy stomatal conductance, transpiration, and evaporation in a temperate deciduous forest, validated by carbonyl sulfide uptake[J]. Biogeosciences, 2017, 14(2): 389-401.
[29]EVANS J R, LORETO F. Acquisition and diffusion of CO in higher plant leaves[M]//Photosynthesis: Physiology & Metabolism. The Netherlands: Kluwer Academic Publishers, 2000:321-351.
[30]QUICK W P, CHAVES M M, WENDLER R, et al. The effect of water stress on photosynthetic carbon metabolism in four species grown under field conditions[J]. Plant, Cell & Environment, 1992, 15(1): 25-35.
[31]TESKEY R O, FITES J A, SAMUELSON L J, et al. Stomatal and nonstomatal limitations to net photosynthesis in Pinus taeda L. under different environmental conditions[J]. Tree Physiology, 1986, 2(1/2/3): 131-142.
[32]刘孟雨,陈培元.水分胁迫条件下气孔与非气孔因素对小麦光合的限制[J].植物生理学通讯,1990,26(4):24-27.
LIU M Y, CHEN P Y. Effects of stomatal and nonstomatal factors on wheat photosynthesis under water stress[J]. Plant Physiology Communications, 1990, 26(4): 24-27.
[33]ZHANG S Y, ZHANG G C, GU S Y, et al. Critical responses of photosynthetic efficiency of goldspur apple tree to soil water variation in semiarid loess hilly area[J]. Photosynthetica, 2010, 48(4): 589-595.
[34]謝奎忠,邱慧珍,岳云,等.尖孢镰刀菌侵染对马铃薯光合效率和叶绿素荧光参数影响[J].植物保护学报,2022,49(3):927-937.
XIE K Z, QIU H Z, YUE Y, et al. Effects of Fusarium oxysporum infection on photosynthetic efficiency and chlorophyll fluorescence parameters of potato plants[J]. Journal of Plant Protection, 2022, 49(3): 927-937.
[35]ZAI X M, ZHU S N, QIN P, et al. Effect of Glomus mosseae on chlorophyll content, chlorophyll fluorescence parameters, and chloroplast ultrastructure of beach plum (Prunus maritima) under NaCl stress[J]. Photosynthetica, 2012, 50(3):323-328.
[36]朱成刚,陈亚宁,李卫红,等.干旱胁迫对胡杨PSII光化学效率和激能耗散的影响[J].植物学报,2011,46(4):413-424.
ZHU C G, CHEN Y N, LI W H, et al. Effect of drought stress on photochemical efficiency and dissipation of excited energy in photosystem II of Populus euphraticap[J]. Chinese Bulletin of Botany, 2011, 46(4):413-424.
[37]路秉翰,卓定龙,刘晓洲,等.干旱胁迫对红玉姜黄光合和叶绿素荧光参数的影响[J].热带农业科学,2022,42(6):11-16.
LU B H, ZHUO D L, LIU X Z, et al. Effect of drought stress on photosynthetic and chlorophyll fluorescence parameters of Curcuma'Hongyu'[J]. Chinese Journal of Tropical Agriculture, 2022, 42(6): 11-16.
[38]陈雪妮,李建挥,吴毅,等.水分胁迫对2个蓝莓品种叶绿素荧光特性的影响[J].中南林业科技大学学报,2019,39(8):109-114,138.
CHEN X N, LI J H, WU Y, et al. Effects of soil water stress on chlorophyll fluorescence characteristic of two blueberry varieties[J]. Journal of Central South University of Forestry & Technology, 2019, 39(8): 109-114, 138.
[39]王園园.兴安落叶松幼苗外生菌根真菌促生与提高抗病性研究[D].哈尔滨:东北林业大学,2020.
WANG Y Y. Research on growth promotion and disease resistance of exogenous mycorrhizal fungi in larch seedlings of Larix gmelini[D]. Harbin: Northeast Forestry University, 2020.
[40]KUMAR J, ATRI N S. Studies on ectomycorrhiza: an appraisal[J]. The Botanical Review, 2018, 84(2): 108-155.
[41]高悦,吴小芹.6种外生菌根菌对3种松苗叶绿素含量及叶绿素荧光参数的影响[J].南京林业大学学报(自然科学版),2010,34(6):9-12.
GAO Y, WU X Q. Effects of several ectomycorrhizal fungi on the chlorophyll content and chlorophyll fluorescence parameters in different pine seedlings[J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2010, 34(6): 9-12.
[42]EKBLAD A, WALLANDER H, GODBOLD D L, et al. The production and turnover of extramatrical mycelium of ectomycorrhizal fungi in forest soils: role in carbon cycling[J]. Plant and Soil, 2013, 366(1): 1-27.
