WRKY 转录因子调控植物养分吸收利用及重金属解毒的研究进展
2023-11-28邓雅茹吴丽霞李方剑李铁梅王金祥
邓雅茹,柳 燕,吴丽霞,李方剑,2,李铁梅,王金祥,2*
(1 华南农业大学资源环境学院 / 根系生物学研究中心,广东广州 510642;2 广东省农业农村污染治理与环境安全重点实验室,广东广州 510642;3 华南农业大学图书馆,广东广州 510642)
植物主要从土壤中获取营养物质来保证其生长发育。在整个生命进程中,植物会遇到各类不利于自身生长发育的环境条件,比如因土壤养分亏缺或有毒元素过量无法维持其正常生理活动。为了适应这类非生物胁迫的影响,植物进化出了精细复杂的生理和分子机制来调节自身对外界环境变化的响应[1]。转录因子(transcription factor,TF)是植物信号通路的重要组分,它是一类能与DNA 序列特异性结合的蛋白,可以在细胞核激活或抑制下游基因的转录,在植物各个生长发育阶段协调应对不同环境和内部信号[2]。根据TF 与DNA 结合区域的不同,可以将它们划分为不同的基因家族,植物中比较典型的有WRKY、MYB、bZIP、bHLH、NAC 等TF 家族[3],它们都在植物的生长发育阶段和响应胁迫、抗病抗虫等方面发挥着重要的生物学功能。
植物基因组编码转录因子的基因较多,目前发现拟南芥和水稻基因组分别编码约2100 和2300 个转录因子[4]。WRKY 转录因子是植物所特有的,是调控植物适应生物和非生物逆境的最大基因家族之一。1994 年,科学家们首次在甘薯(Impoeabatatas)的块根发现植物中第一个编码WRKY 蛋白的基因SPF1(SWEETPOTATOFACTOR1)的cDNA,并将其分离出来[5]。自那以后,越来越多的WRKY 家族成员陆续从其他植物中被鉴定出来。到目前为止,拟南芥(Arabidopsisthaliana)、大豆(Glycinemax)和水稻(Oryzasativa)基因组中分别有74、182 和109个WRKY 家族成员被鉴定出来[6-8]。大量的研究证明,WRKY 家族的转录因子在调节植物生长发育、应对各种环境胁迫方面具有举足轻重的作用。WRKY参与调控植物在不同发育阶段遇到的各种生物胁迫与非生物胁迫响应,如干旱[9]、盐害[10]、寒冷[9]、高温[11]、养分匮乏、病原体感染[12]等。例如AtWRKY33 和GmWRKY144 等转录因子被证明参与调控拟南芥和大豆应对盐胁迫[13-14],拟南芥WRKY45和WRKY75 调控应答低磷养分胁迫[15-16],拟南芥WRKY53、WRKY54 和WRKY70 通过参与同一个调控网络来调节叶片的衰老过程[17],水稻的WRKY45参与调节水稻对稻瘟病的抗性免疫反应[18-19]。
显然,深入解码WRKY 是如何调控植物应答养分胁迫以及重金属毒害的生理和分子机制具有重要的理论意义,对于环境友好型和资源节约型低碳农业的发展,以及保障粮食和食品安全方面具有重要的实践意义。鉴于有关WRKY 在拟南芥、大豆、水稻等植物氮、磷、钾、硫、硼等养分吸收利用以及响应镉毒铝毒等方面的研究较多,因此本文将主要聚焦综述近年来WRKY 转录因子在调控植物吸收利用氮、磷、钾、硫、硼等养分以及应对镉毒铝毒等方面的研究进展。
1 WRKY 转录因子的结构特征
1.1 WRKY 的结构
转录因子能够通过与基因5'端上游启动子内某些特定结构(如上游的调控元件)特异性结合,抑制或诱导目的基因的表达,最终促使植物对外界信号做出反应。WRKY 转录因子一般含1 个由约60 个氨基酸组成的WRKY 结构域[19]。其N 端是一个由绝对保守的七肽WRKYGQK 组成的氨基酸基序,其中前4 个氨基酸“WRKY”为保守结构域中的最高保守区域(图1),故将这类蛋白质家族简称为WRKY 家族[20]。肽链中氨基酸残基的特征基团通过与Zn2+结合,形成指状的多肽空间构型,称为“锌指结构”,具有此类结构的蛋白一般与调控基因表达相关。WRKY转录因子的C 端有一个为C2H2型(C-X4-5-C-X22-23-HX1-H)或者C2-HC 型(C-X7-C-X23-H-X1-C)的锌指蛋白结构(图2)[21]。

图1 WRKY 的保守结构域Fig.1 Conservative domains of WRKY

图2 植物中常见的锌指结构Fig.2 Zinc finger structure of commonly found in plants
1.2 WRKY 下游基因启动子区的W-box 顺式元件
研究揭示,WRKY 蛋白通过靶基因启动子中的顺式作用元件W-box (5'-[T]TGAC[C/T]-3')与DNA进行特异性结合,诱导或抑制下游基因的表达,发挥转录调控功能,其中“TGAC”被称为不变的核心序列[21]。研究揭示,WRKY 转录因子主要通过与Wbox 的特异性结合,调控相关基因的表达而影响植物的生长发育,因此W-box 可以用于预测WRKY 的靶基因。有研究表明,若WRKY 结构域中的保守序列WRKYGQK 突变或W-box 中的任一核苷酸发生改变,WRKY 与DNA 的结合活性就会很大程度地降低甚至消失,而C 端的锌指结构中保守的半胱氨酸(cysteine, Cys)和组氨酸(histidine, His)残基被取代则会消除它们的DNA 结合活性[22]。不同的WRKY转录因子,结合的W-box 附近的序列也存在差异,这会在一定程度上影响WRKY 转录因子结合的选择性和强度[23]。
1.3 WRKY 的分类
尽管WRKY 转录因子中的各种结构都是高度保守的,但是根据其所结合的结构域数量以及锌指结构类型的不同,其与DNA 的结合都会发生变化。可以将WRKY 转录因子分为3 大类,其中最大的类群是第II 类[14]。第I 类的WRKY 转录因子含有两个WRKY 结构域和C2H2型的锌指结构,此类WRKY转录因子主要是通过C 端的WRKY 结构域与W-box进行特异性结合[24],比如SPF1、AtWRKY45 等转录因子。第II 类的WRKY 转录因子含有一个WRKY结构域和C2H2型的锌指结构,比如AtWRKY42、GmWRKY75 等转录因子。此外,根据不同的氨基酸序列,可以将第II 类WRKY 转录因子进一步划分为IIa、IIb、IIc、IId、IIe 等5 个亚组[25]。第III 类的WRKY 转录因子含有1 个WRKY 结构域和C2-HC型的锌指结构[26],比如AtWRKY46、GmWRKY58、OsWRKY74 等转录因子。在拟南芥WRKY 蛋白中,32 个WRKY 属于第I 类,26 个属于第II 类,14个属于第III 类[27]。32 个大豆WRKY 属于第I 类,130 个属于第II 类,26 个属于第III 类[28]。WRKY 家族中3 个亚类的WRKY 均能通过与靶基因启动子区域中的顺式元件W-box 特异性结合来调控下游基因的表达。
2 WRKY 在调控植物养分吸收利用过程中的作用
近年研究发现,GmWRKY31 与GmHDL56 的互作会增强大豆对疫霉根腐病的抗性[29]。GmWRKY54转入拟南芥后,可以通过对DREB2A和STZ/Zat10等基因进行调控,提高拟南芥对盐胁迫和干旱的抗性[30]。StWRKY45 参与调控柱花草(Stybsanthesguianensis)响应低磷胁迫[31]。鉴于有关WRKY 在调节植物生长发育和生物逆境方面的研究较多,本文主要介绍拟南芥、大豆和水稻的WRKY 转录因子在植物吸收利用氮、磷、钾、硫等养分以及响应镉毒、铝毒等胁迫的重要调控作用。
2.1 WRKY 调控氮营养
氮(N)是植物生长发育过程中最重要的大量营养元素之一,是植物体内蛋白质、叶绿素、核酸和各种生物酶等许多重要有机化合物的组成成分,在各个方面影响着植物的代谢和生长发育过程。植物主要通过根系来获取土壤中以硝态氮(NO3-)和铵态氮(NH4+)形式存在的无机氮养分。而土壤中能被植物直接利用的无机氮仅占总量的1%~2%,且无机氮容易淋失和挥发,还会被土壤中的粘土矿物和有机质固定,所以土壤中的有效氮对植物来说是远远不够的。因此,了解WRKY 在植物吸收氮素过程中的调控作用具有实际意义。
调控植物应对养分胁迫和镉毒铝毒的WRKY 家族成员见表1。拟南芥WRKY1的表达受到有机氮处理的抑制而被氮饥饿激活[32-33],低氮处理1、3 h 会使AtWRKY31的表达量显著下降[34],AtWRKY72在低氮处理3 h 后表达量显著下调且Atwrky72突变体在低氮处理下主根延伸长度显著变短,且AtWRKY72蛋白不仅能与自身互作,还可以与AtWRKY36、AtWRKY61 等多个转录因子相互作用,共同参与调控在低氮胁迫下拟南芥的响应过程[35]。在低氮处理24 h 后,GmWRKY6和GmWRKY75的表达量会达到最高[36];低氮处理下,GmWRKY7、GmWRKY8、GmWRKY15在叶部均受上调表达,GmWRKY7和GmWRKY15在根部均受上调表达,而GmWRKY8则受下调表达[37];GmWRKY58 通过诱导自身启动子区域中的TC-rich repeats (-ATTTTCTCCA-)顺式元件,激活下游与低氮胁迫有关的基因表达,其中低氮处理24 h 的大豆植物根部中,GmWRKY58的表达量最高[38]。
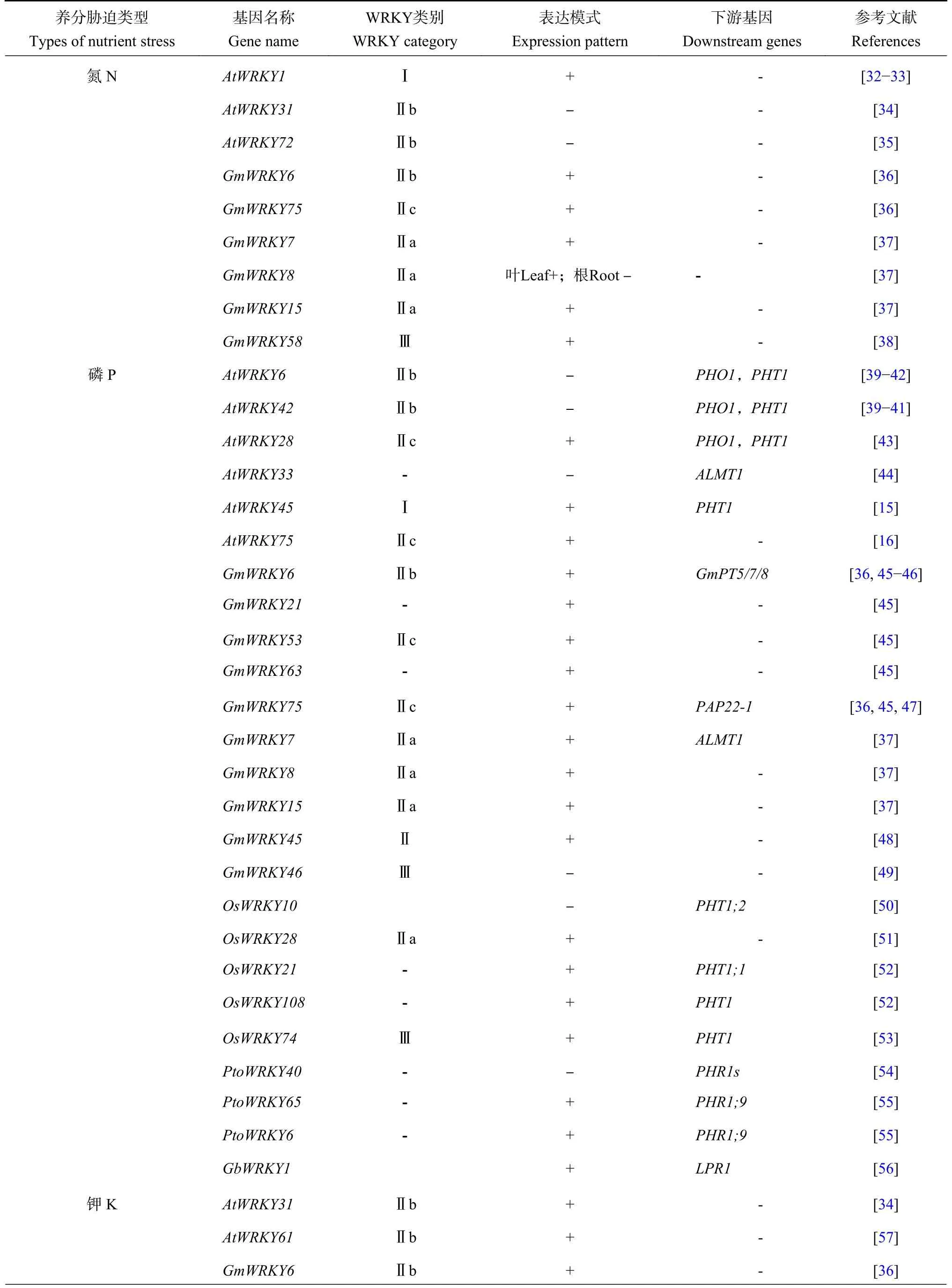
表1 调控植物应对养分胁迫和镉毒铝毒的WRKY 家族成员Table 1 WRKY family members that regulating plan responses to nutrient stresses, and cadmium and aluminum toxicities
2.2 WRKY 调控磷营养
磷(P)是植物生长发育所必需的大量营养元素。它不仅是植物体内核酸和腺苷三磷酸 (adenosine triphosphate, ATP)、氨基转移酶等重要磷化合物的组分,同时还参与植物体内光合作用、呼吸代谢、能量转化、信号转导等各种生理过程,是植物完成整个生命周期所不可缺少的元素。土壤是植物获取磷营养的主要来源,但是施入土壤的很大一部分磷会被紧密地固定在土壤颗粒表面或以有机磷的形式被固定,因此土壤中无机磷的有效性和移动性很差,植物难以吸收利用[75]。
在拟南芥中,AtWRKY6 和AtWRKY42 协同互作,通过与拟南芥中磷酸根转运子基因PHOSPHATE1(AtPHO1)启动子中的W-box 元件结合来抑制AtPHO1表达,从而调节拟南芥响应低磷胁迫[39-40]。缺磷会促进26S 蛋白酶体对AtWRKY6 和AtWRKY42 的降解作用,因此AtWRKY6 与AtWRKY42 在负调控AtPHO1的表达时存在功能冗余,但二者对AtPHT1;1的调控机制又存在差异[41]。E3 泛素连接酶PRU1(phosphate response ubiquitin E3 ligase1)促进AtWRKY6降解,介导低磷条件下磷从植物地下部到地上部的转移[42]。AtWRKY28 在低磷胁迫下通过正向调控AtPHO1和AtPHT1;4的表达参与磷的转运和吸收,在正常供磷条件下通过正向调控AtPHT1;1参与磷的吸收[43]。AtWRKY33 在缺磷条件下通过控制ALMT1的转录来负调控根结构的重塑,以调节磷缺乏反应[44]。过表达AtWRKY45会增加磷的含量,且AtWRKY45 通过直接上调AtPHT1;1的转录来调节拟南芥对磷饥饿的响应[15]。AtWRKY75 能影响拟南芥根系构型的改变,AtWRKY75受低磷上调表达,其表达被干扰后植株对磷的吸收速率明显下降[16],但AtWRKY45 会负调控AtWRKY75的表达。
最近,一些大豆WRKY 调控磷营养的作用被初步揭示。大豆GmWRKY6、GmWRKY21、GmWRKY53、GmWRKY63、GmWRKY75等参与大豆响应低磷胁迫[45]。在拟南芥异源超表达GmWRKY6和GmWRKY75提高其对磷的吸收,增强对低磷胁迫的耐受性[36]。GmERF1编码一个乙烯响应转录因子,主要在大豆根中表达,且受低磷诱导,GmWRKY6 也受低磷诱导。GmPT5、GmPT7、GmPT8的启动子区域存在W-box 元件,GmWRKY6 通过结合GmPT5、GmPT7、GmPT8的启动子抑制其转录,而GmERF1 与GmWRKY6 发生互作而促进GmWRKY6 抑制GmPT5、GmPT7、GmPT8等磷响应下游靶基因的转录,抑制大豆对磷的吸收利用,因此GmWRKY6 是一个负调控因子[46]。GmWRKY75 会与GmPAP22-1 互作,超表达GmWRKY75会降低GmPAP22-1的表达水平[47]。低磷胁迫下,GmWRKY7、GmWRKY8、GmWRKY15在叶部和根部的表达量均被上调,其中GmWRKY7通过与GmALMT1的启动子结合可以减少磷缺乏条件下转基因拟南芥对花青素的积累[37]。低磷处理下,GmWRKY45的表达随胁迫时间的延长而显著增加,且在根中的表达水平高于叶,在拟南芥中过量表达GmWRKY45会增强其对低磷胁迫的耐受性,生长状况明显优于野生型。这可能是通过促进植物侧根发育和改变磷响应基因的表达来实现的[48]。GmWRKY46主要在大豆根中表达,并受到低磷的强烈诱导,RNA干涉GmWRKY46提高毛状根的增殖、伸长和磷吸收效率,提高大豆耐低磷能力[49]。
当水稻处于磷养分充足的条件下,OsWRKY10会通过负向调节OsPHT1;2的表达来减少自身对磷的吸收,而在外界供给磷匮乏时,OsWRKY10 蛋白会被26S 蛋白酶体降解[50]。OsWRKY28通过调节茉莉酸介导的根系结构来增加对磷的积累[51]。OsWRKY21和OsWRKY108 在核内互作,与OsPHT1;1 中的Wbox 元件结合,通过磷依赖方式维持OsPHT1;1的组成型表达,调控水稻的磷稳态[52]。OsWRKY74受磷饥饿的正向调控,低磷条件下超表达OsWRKY74会使植物形成更大的根系结构以增强对缺磷的耐受,还会通过调节一些磷饥饿诱导基因,例如PHT1来调节水稻的磷稳态[53]。
在低磷胁迫下,毛白杨(Populustomentosa)PtoWRKY40的表达水平显著下调,PtoWRKY40 蛋白被降解。PtoWRKY40 通过与PtoPHL3 相互作用抑制杨树磷转运蛋白PtoPHR1s 的表达,进而负调控杨树对磷缺乏的耐受能力[54]。杨树(Populustremula)WRKY65和WRKY6通过与PHR1;9 中的W-box 特异性结合来调控基因表达,而PHR1;9 能增加磷从根到顶芽的运输,过量表达杨树WRKY65和WRKY6能增强杨树对低磷胁迫的耐受性[55]。在拟南芥中过表达棉花(AnemonevitifoliaBuch)的GbWRKY1,其依赖LPR1(low phosphate response 1)响应低磷信号,通过增加拟南芥对生长素的敏感性来提高对磷饥饿的耐受性[56]。
PHT1 家族的磷酸转运蛋白被认为可能是植物唯一吸收磷的流入转运蛋白,其成员的表达在植物获取磷营养的过程中至关重要[76]。目前,在拟南芥和水稻中分别发现9 和13 个PHT1基因[52]。在拟南芥中,AtPHT1;1和AtPHT1;4是负责在高低磷条件下吸收磷的两个主要成员[77];在水稻中,OsPHT1;1、OsPHT1;2、OsPHT1;4、OsPHT1;8等4 个PHT1基因被证明在磷充足的条件下会参与植物对磷的吸收与积累[78]。目前已有不少WRKY 转录因子被证实会参与调控PHT1基因的表达,说明PHT家族成员作为WRKY 转录因子影响植物磷养分的吸收与利用,是作用的下游靶基因。但还有很多细节和机理仍不清楚。
2.3 WRKY 调控钾营养
钾(K)以阳离子的状态累积在植物细胞中,不是任何有机化合物的组成成分。但是钾能够通过促进光合作用、叶绿素和蛋白质的合成等多种方式参与植物的生长过程。钾还是多种重要酶的活化剂,与酶促反应关系密切,参与对植物细胞渗透压的调节并能够提高植物对外界恶劣环境的抵御能力。
低钾处理1 h 会使AtWRKY31的表达量显著下降[34]。在低钾处理12 h 后,AtWRKY61基因的表达量显著上升,AtWRKY61 既可以与AtWRKY9、AtWRKY72 互作,又可自我聚合形成同源二聚体[57]。在低钾处理36 h 后,GmWRKY6和GmWRKY75的表达量会达到顶峰[36]。GmWRKY7和GmWRKY8在叶和根部均受低钾胁迫上调表达。低钾条件下,GmWRKY15在新叶和根部的表达量增加,在老叶表达量减少[37],而GmWRKY50的表达量会增加,推测它通过调节下游靶基因的方式参与调控大豆对钾的吸收与转运[58]。
2.4 WRKY 在植物其他养分吸收利用过程中的调控作用
硫(S)对植物生长发育非常重要,影响含硫蛋白质的合成和谷物品质,能够促进植物对其他营养元素的吸收并提高作物的产量与品质。在低硫胁迫下,GmWRKY7、GmWRKY8在叶中的表达上调,而在根被抑制,GmWRKY15在叶部的表达量增加[37],推测这3 个WRKY 转录因子可能参与响应大豆生长过程中的硫养分匮乏。
硼是植物细胞壁的一种组成成分,可以增强植物光合作用并促进叶绿素的合成。在缺硼条件下,AtWRKY6 可能同时通过调节拟南芥根尖附近的基因表达,并诱导NIP5;1(nodulin26-likeintrinsicprotein 5;1)的转录来提高拟南芥对低硼胁迫的耐受性[59]。
铁是植物有氧呼吸酶的重要组成物质并有利于叶绿素的合成。AtWRKY4 通过参与拟南芥根冠的铁运转和调控NAS2(NicotianamineSynthase2)、VITL1(VacuolarIronTransporter1-like1)等铁转运相关基因的转录来响应低铁胁迫[60]。OsWRKY80在高铁胁迫时表达下调,说明其在水稻响应高铁胁迫时发挥调控作用[61]。
2.5 WRKY 对植物应对镉毒胁迫的调控作用
镉(Cd)不是植物生长所必需的金属元素,其在植物体内过量积累时会对植物产生毒害,如抑制光合作用、呼吸和蒸腾作用,降低植物体内的酶活性,阻碍根系的发育,抑制植物对其他必需养分的吸收,导致植物体内代谢紊乱等[79]。到目前为止,已发现多个WRKY 转录因子参与植物响应重金属镉胁迫的过程。
在拟南芥中,AtWRKY12 负调控植物对镉胁迫的耐受性,其表达会受到镉胁迫的抑制,WRKY12蛋白会抑制PCs 合成相关基因的表达,它通过依赖GSH 的PC 合成途径降低拟南芥对镉的耐受性[62]。AtWRKY13 通过在镉反应信号通路中的AtPDR8上游起作用正向调节拟南芥对镉的耐受性[63]。AtWRKY33通过直接激活ATL31的转录来响应镉毒,正向调控拟南芥对镉毒胁迫的耐受性[64]。AtWRKY18、AtWRKY40和AtWRKY60 通过抑制编码硫化氢(H2S)合成酶基因的转录来增强拟南芥对镉的耐受性[65]。AtWRKY47通过调控GSH 合成相关酶基因转录而促进GSH 合成,减少对外界镉的吸收和区隔化,提高拟南芥对镉毒的耐受能力[66]。
在大豆中,GmWRKY142受镉诱导快速差异表达,正调控拟南芥对镉的耐受性,它是通过与启动子区域中的W-box 元件结合来激活镉耐受相关基因ATCDT1、GmCDT1-1和GmCDT1-2的转录起作用[67]。
水稻WRKY15受镉快速诱导表达,通过一氧化氮(NO)和脱落酸(ABA)介导的信号途径抑制镉从植物根部向上运输,调节水稻对镉胁迫的响应[68]。在杨树中,过表达PyWRKY75通过增加杨树的叶绿素含量,保护超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)等抗氧化酶的活性,促进还原型谷胱甘肽(GSH)和植物螯合物(PCs)的合成以钝化镉,增强杨树对镉的耐受性[69]。
2.6 WRKY 对植物应对铝毒胁迫的调控作用
铝(Al)是自然界含量最多的金属元素,土壤中的铝大多以铝硅酸盐的形式存在,在酸性土壤(pH<5.0)中,铝会被解离成Al3+释放到土壤中,对植物的生长发育造成直接伤害。铝毒快速抑制植物根尖细胞伸长和分裂。已有研究证明,WRKY 转录因子参与帮助植物耐受铝毒,这一发现对南方酸性土壤上生长的作物有重大意义。
在铝毒胁迫下,AtWRKY46 通过与ALMT1(aluminum-activatedmalatetransporter1)基因启动子中的W-box 结合,抑制其转录,促使拟南芥分泌更多的苹果酸,增强其对铝的抗性[70]。AtWRKY47 可能通过介导ELP(Extensin-LikeProtein)、XTH17(xyloglucanendotransglucosylasehydrolases17)等细胞壁修饰基因的表达在拟南芥耐铝方面起积极作用[71](表1)。GmWRKY21 上调AtALMT1、AtALS3、AtMATE、AtSTOP1等胁迫响应基因的表达,提高转基因拟南芥对铝毒的耐受性。GmWRKY21 促进GmCOR47、GmDREB2A、GmMYB84、GmKIN1、GmGST1、GmLEA等基因的表达,增强大豆对铝胁迫的耐受性[72]。15 个大豆基因启动子含有W-box 元件,可能是GmWRKY81 的靶基因,如低铁诱导的bHLH 转录因子(Glyma.03G130600)、铁还原酶(Glyma.07G067700)、NRAMP 转运子(Glyma.06G115800)、NAS (Glyma.08G175400)、POD (Glyma.18G211000)、有机酸转运子(Glyma.19G173800)等基因,GmWRKY81可能通过激活抗氧化基因的表达,清除ROS (reactive oxygen species),增加有机酸的分泌,提高大豆的耐铝性[73]。OsFRDL4编码水稻柠檬酸转运子,而转录因子ART1 (resistance transcription factor 1) 直接调控OsFRDL4的转录,有趣的是,OsWRKY22 是一个转录激活因子,它通过结合在OsFRDL4启动子的Wbox 元件促进OsFRDL4的转录,促进水稻根系柠檬酸的分泌而增强耐铝毒能力。与此一致的是,TDNA 插入突变体oswrky22对铝胁迫更敏感,art1 oswrky22双突变体中OsFRDL4的表达水平以及柠檬酸分泌明显比单突变体少,因此OsWRKY22 与ART1 (resistance transcription factor 1)协同激活受铝诱导的柠檬酸盐转运基因OsFRDL4的表达,维持水稻耐铝毒能力[74]。
3 总结与展望
作为植物特有的一大类重要转录因子,WRKY基因在植物的整个生命周期中起关键作用。在过去的几十年中,随着基因工程、生物信息学、基因编辑等技术的不断发展,已经有许多科学家通过对不同类植物中的WRKY 家族成员进行功能验证,发现并证明了WRKY 基因在植物生长发育、养分逆境响应等过程中起关键作用。WRKY 家族成员虽然具有相似的结构,但是它们在作用的下游靶基因、调控的信号通路等方面仍存在差异,导致其表现出的功能以及作用机制不相同。基于WRKY 基因在不同植物基因组的数量很多,存在如此众多WRKY 基因的生物学意义何在?揭示不同WRKY 基因在调控植物营养方面的功能就显得尤为迫切。重要的是,在养分逆境条件下调控WRKY基因转录的转录因子有哪些?在氮磷钾硫等养分亏缺以及铝毒和镉毒条件下WRKY 在翻译和翻译后层面是如何被调控的?在氮磷钾硫等养分亏缺以及铝毒和镉毒条件下WRKY基因的转录在表观遗传层面受到哪些调控?回答这些科学问题将是今后研究的重点和方向。
