circ_0000337靶向miR-578对皮肤鳞状细胞癌A431细胞生物学行为的影响
2023-11-27邵文秀卢淑娇韩丽林
邵文秀 卢淑娇 韩丽林
(丽水市人民医院皮肤科,浙江 丽水 323000)
皮肤鳞状细胞癌(CSCC)是一种高发病率的皮肤恶性肿瘤,尽管手术、放疗和光动力等治疗方案不断进展,但肿瘤的复发和转移仍是CSCC患者死亡的重要原因〔1〕。了解CSCC进展的分子机制对开发有效的治疗策略至关重要。环状RNA(circRNA)是丰富、稳定、进化保守的非编码RNA,其通过与微小RNA(miRNA)或其他分子结合,抑制其功能,在转录或转录后水平介导基因表达,circRNA在CSCC等多种类型的癌症异常表达,参与调控癌细胞多种功能,可能作为肿瘤诊断的潜在标志物或治疗靶点〔2,3〕。circ_0000337在食管鳞癌组织中表达明显上调,敲减circ_0000337通过上调致癌因子miR-670-5p表达显著抑制食管鳞癌细胞增殖和迁移〔4〕。miR-578是一种抑癌因子,过表达miR-578可诱导胶质瘤细胞凋亡,抑制克隆形成〔5〕。circ_001621通过减弱miR-578对细胞周期蛋白依赖性激酶(CDK)4和基质金属蛋白酶(MMP)-9抑制作用,促进骨肉瘤的增殖和迁移〔6〕。生物信息学软件预测到miR-578与circ_0000337存在潜在结合位点,但circ_0000337能否靶向miR-578调控CSCC进展未见报道。本研究探讨circ_0000337靶向miR-578对CSCC细胞A431细胞生物学行为的影响。
1 材料与方法
1.1CSCC组织来源 CSCC组织及癌旁组织(邻近非肿瘤标本)取自丽水市人民医院41例CSCC患者。男28例,女13例,年龄32~60岁,中位年龄45岁。组织立体后立即置于液氮冷冻,后保存在-80 ℃。本研究符合《赫尔辛基宣言》指导原则,患者均签署书面知情同意书。
1.2细胞和试剂 CSCC细胞A431购自美国ATCC;ReverTra Ace qPCR逆转录试剂盒、荧光染料(SYBR) qPCR混合物(Mix)购自日本TOYOBO公司;Lipofectamine 2000购自美国Invitrogen公司;si-NC、si-circ_0000337、miR-NC、miR-578 mimics、pcDNA、pcDNA-circ_0000337、anti-miR-NC、anti-miR-578购自广州锐博生物公司;Trizol试剂、细胞计数试剂盒(CCK-8)购自南京凯基生物公司;Transwell小室购自美国BD公司;MMP-2兔多抗(ab97779)、磷酸甘油醛脱氢酶(GAPDH,ab9485)、羊抗兔IgG(ab205718)、MMP-9兔多抗(ab38898)购自上海艾博抗贸易公司。
1.3实时荧光定量聚合酶链反应(RT-qPCR)检测circ_0000337、miR-578表达 Trizol法提取CSCC组织、癌旁组织的总RNA,用ReverTra Ace qPCR逆转录试剂盒将200 ng RNA逆转录成cDNA,然后用SYBR qPCR Mix进行RT-qPCR。以GAPDH和U6分别作为circ_0000337、miR-578的内参基因,2-ΔΔCt法计算其表达量。circ_0000337引物(上游5′-TCAGGATGCCTTGGGACT-3′,下游5′-TGTGCAGCCGGTCTAACC-3′);GAPDH引物(上游5′-CGCTCT-CTGCTCCTCCTGTTC-3′,5′-ATCCGTTGAC-TCCGACCTTCAC-3′);miR-578引物(上游5′-GTGCAGGGTGTTAGGA-3′,下游5′-GAAGAACACGTCTGGT-3′);U6引物(上游5′-CGAGCACAGAATCGCTTCA-3′,下游5′-CTCGCTTCGGCAGCACATAT-3′)。
1.4A431细胞培养和分组 A431细胞采用添加10%胎牛血清DMEM培养基在37 ℃、含5% CO2培养箱孵育。将对数期A431细胞(2×104个)接种于24孔板,当细胞40%时用Lipofectamine2000将40 nmol/L的寡核苷酸或2 μg质粒分别转染A431细胞,共分为si-NC组、si-circ_0000337组、miR-NC组、miR-578组、pcDNA组、pcDNA-circ_0000337组、si-circ_0000337+anti-miR-NC组、si-circ_0000337+anti-miR-578组。转染48 h后收集细胞,RT-qPCR检测转染效果后进行功能分析。
1.5CCK-8法检测A431细胞活力 将转染的A431细胞(5×103个)接种在96孔板中,37 ℃培养箱孵育至细胞贴壁后将10 μl CCK-8 溶液加入每个孔中。孵育2 h后,酶标仪在450 nm处测量吸光度(OD)值。
1.6克隆形成实验检测A431细胞克隆能力 将转染的A431细胞(5×102个)接种在6孔板中,37 ℃培养箱孵育12~14 d直至出现细胞集落。弃去培养液,用4%甲醛固定细胞集落,用1%结晶紫染色30 min,光学显微镜拍照,计数大于50个细胞的集落数。
1.7划痕愈合实验检测A431细胞迁移能力 将转染的A431细胞(5×104个)接种于6孔板并在37 ℃培养箱孵育,当细胞融合为一层时,用200 μl吸管尖端划伤细胞,磷酸盐缓冲液(PBS)漂洗2次去除非黏附细胞,加入新鲜培养基置于37℃培养箱孵育。培养初始时、培养24 h时分别将6孔板置于显微镜下拍照,记录划痕宽度。划痕愈合率(%)=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.8Transwell实验检测A431细胞侵袭能力 用无血清培养基重悬转染的A431细胞,取200 μl接种到Transwell装置上腔室,下室加入500 μl含10%胎牛血清的培养基。在37 ℃培养箱孵育24 h后,用4%多聚甲醛固定膜下表面附着的细胞20 min,并用0.1%结晶紫溶液染色。在显微镜下对随机选取的5个视野细胞数量进行计数,取均值表示侵袭数。
1.9双荧光素酶报告实验 将含有miR-578结合位点的circ_0000337野生序列或不含该结合位点的突变序列分别克隆到psiCHECK-2荧光素酶载体中,构成重组载体野生型(WT)-circ_0000337、突变型(MUT)-circ_0000337,该步骤由广州锐博生物公司完成。将WT-circ_0000337+miR-578 mimics、WT-circ_0000337+ miR-NC、MUT-circ_0000337+ miR-578 mimics、MUT-circ_0000337 +miR-NC分别转染A431细胞。共转染48 h后,用双荧光素酶报告基因检测系统分析检测相对荧光素酶活性。
1.10Western印迹检测A431细胞MMP-2和MMP-9蛋白表达 RIPA裂解液提取总蛋白,取30 μg蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),然后通过电印迹转移到硝化纤维素膜上。膜封闭后,4 ℃下孵育MMP-2抗体(1∶2 500稀释)、MMP-9抗体(1∶2 500稀释)和内参GAPDH抗体(1∶2 500稀释)12 h。25 ℃下孵育酶标二抗(1∶3 000稀释)2 h。化学发光法显色反应,Quantity One软件分析目的蛋白相对表达水平。
1.11统计学方法 采用GraphPad7.0软件进行单因素方差分析、One-Way ANOVA和LSD-t检验。
2 结 果
2.1circ_0000337和miR-578在CSCC组织中的表达 CSCC组织中circ_0000337表达(4.37±0.33)显著高于癌旁组织(1.00±0.07;t=63.966,P=0.000),CSCC组织中miR-578表达(0.29±0.04)显著低于癌旁组织(1.00±0.08;t=50.828,P=0.000)。
2.2抑制circ_0000337表达对A431细胞增殖、迁移和侵袭的影响 si-circ_0000337组细胞中circ_0000337表达水平显著低于si-NC组(P<0.05)。与si-NC组比较,si-circ_0000337组细胞OD值、克隆形成数、划痕愈合率、侵袭数及MMP-2、MMP-9蛋白表达显著降低(P<0.05),见表1、图1。
2.3miR-578过表达对A431细胞增殖、迁移和侵袭的影响 miR-578组细胞中miR-578表达水平显著高于miR-NC组(P<0.05);与miR-NC组比较,miR-578组细胞OD值、克隆形成数、划痕愈合率、侵袭数及MMP-2、MMP-9蛋白表达显著降低(P<0.05),见图1、表2。
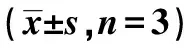
表1 抑制circ_0000337表达对A431细胞增殖、迁移和侵袭的影响
2.4干扰miR-578表达逆转了抑制circ_0000337表达对A431细胞增殖、迁移和侵袭的作用 与si-circ_0000337+anti-miR-NC组比较,si-circ_0000337+anti-miR-578组A431细胞miR-578表达水平显著降低,细胞OD值、克隆形成数、划痕愈合率、侵袭数及MMP-2、MMP-9蛋白表达显著升高(P<0.05),见图1、表3。
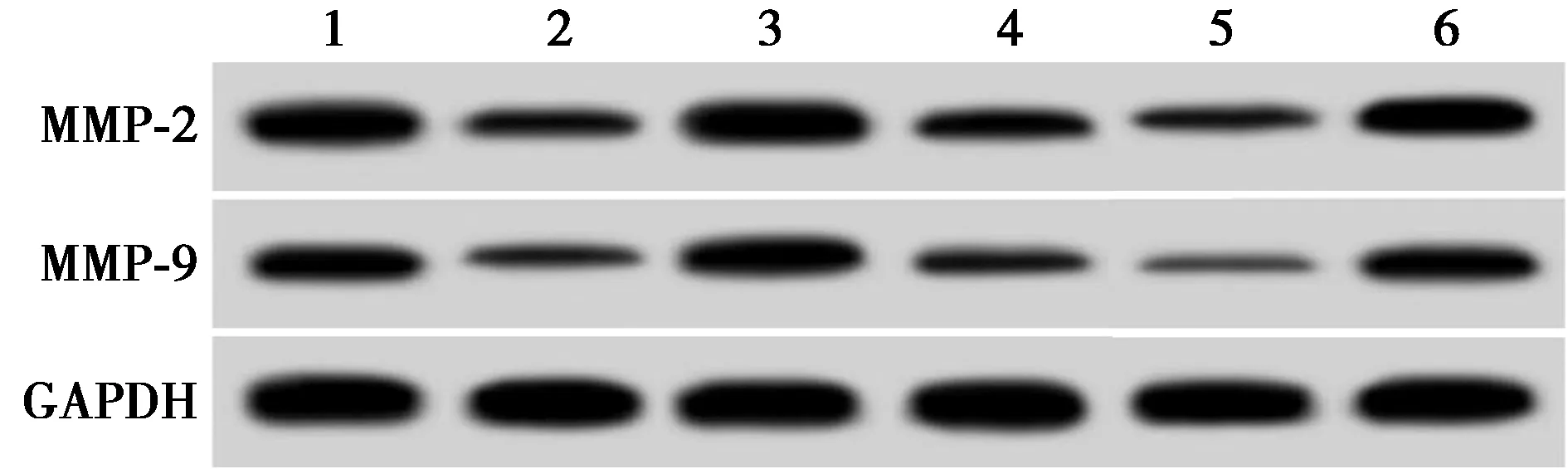
1~6:si-NC组、si-circ_0000337组、miR-NC组、miR-578组、si-circ_0000337+anti-miR-NC组、si-circ_0000337+anti-miR-578组图1 各组MMP-2、MMP-9蛋白表达
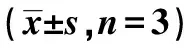
表2 miR-578过表达对A431细胞增殖、迁移和侵袭的影响及双荧光素酶报告结果比较
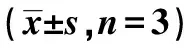
表3 干扰miR-578表达逆转了抑制circ_0000337表达对A431细胞增殖、迁移和侵袭的作用
2.5circ_0000337靶向调控miR-578的表达 生物信息学预测软件显示circ_0000337可能与miR-578存在结合位点,见图2。

图2 circ_0000337的序列中含有与miR-578互补的核苷酸序列
双荧光素酶报告实验表明,与WT-circ_0000337和miR-NC共转染比较,共转染WT-circ_0000337和miR-578 mimics的细胞相对荧光素酶活性显著降低(P<0.05),见表2。RT-qPCR检测显示,与pcDNA组(1.00±0.00)比较,pcDNA-circ_0000337组细胞中miR-578表达水平(0.43±0.03)显著降低(P<0.05);与si-NC组(0.98±0.06)比较,si-circ_0000337组细胞中miR-578表达水平(2.66±0.23)显著升高(P<0.05)。表明circ_0000337通过直接与miR-578结合来调控miR-578表达。
3 讨 论
circRNA表达失调被认为与CSCC发生和发展有关,研究表明,circ_0067772、circ_0070934、circ_001937等circRNA在CSCC中表达上调,参与CSCC细胞过度增殖、凋亡抵抗及迁移侵袭,而敲减其表达则抑制CSCC细胞恶性表型〔7~9〕。本研究检测到CSCC组织中circ_0000337表达显著升高,但circ_0000337在CSCC进展中的作用并未阐明。研究显示,circ_0000337高表达与胶质瘤患者不良预后相关,circ_0000337通过靶向miR-942-5p可上调MAT2A表达,从而诱导胶质瘤细胞恶性表型〔10〕。circ_0000337在骨肉瘤细胞系表达上调,沉默circ_0000337显著抑制骨肉瘤细胞增殖和迁移能力〔11〕。为探讨circ_0000337在CSCC中作用,本研究结果显示,抑制circ_0000337表达通过降低A431细胞活力,抑制其迁移、侵袭以克隆形成能力,这与研究〔11〕报道的抗癌作用类似,表明抑制circ_0000337表达通过抑制CSCC细胞恶性生物学行为来阻碍CSCC进展。MMP-2和MMP-9可破坏血管基底膜、降解细胞外基质,在肿瘤转移扩散中起重要作用,其表达水平与肿瘤细胞迁移和侵袭能力存在显著相关性,是常用的肿瘤细胞侵袭转移标志物〔12,13〕。本研究进一步证实抑制circ_0000337表达的抗迁移、抗侵袭作用。
circRNA含有miRNA结合位点,circRNA通过吸附miRNA能够减弱其对靶mRNA的抑制作用,参与肿瘤细胞增殖和转移过程,研究报道,circ_0000337在骨肉瘤中的致癌作用与调控miR-4458/BTB-CNC异体同源体(BACH)1通路相关〔11〕。本研究证实,miR-578为circ_0000337的直接靶点。已有研究显示,miR-578在多种肿瘤中充当抑癌因子,如miR-578通过靶向血管内皮生长因子(VEGF)和低氧诱导因子(HIF)-1信号通路的关键调控因子抑制乳腺癌易感基因(BRCA)1/2相关乳腺癌血管生成〔14〕。沉默环状RNA锌指RNA结合蛋白(circZFR)通过miR-578显著抑制乳腺癌细胞的恶性行为,抑制体内肿瘤的生长〔15〕。沉默circ_0005785可抑制肝癌细胞的增殖和转移,导致细胞凋亡和细胞周期阻滞,其机制与靶向上调miR-578表达有关〔16〕。miR-578还可作为circ-CNST、circ_0006677的下游靶miRNA参与调控骨肉瘤、非小细胞肺癌进展〔17,18〕。本研究结果证实,miR-578在CSCC中的抑癌功能。RT-qPCR检测到miR-578表达受到circ_0000337负性调控,且在CSCC中抑制circ_0000337表达和过表达miR-578的抗肿瘤作用一致,提示CSCC中存在circ_0000337/miR-578通路。本研究表明,干扰miR-578表达显著削弱抑制circ_0000337表达对A431细胞活力及迁移、侵袭、克隆形成能力的影响,进一步证实circ_0000337靶向调控miR-578表达参与调控CSCC进展。然而,本研究仍存在不足之处,circ_0000337下游是否存在其他miRNA,miR-578下游靶点仍需探讨。此外,未来仍需开展动物实验进一步验证circ_0000337/ miR-578通路在CSCC中的作用。
综上,circ_0000337在CSCC中表达上调,miR-578表达下调。抑制circ_0000337通过靶向上调miR-578表达可抑制CSCC细胞A431增殖、迁移和侵袭。
