基于实时肿瘤运动状态的四维剂量重建方法在肺癌SBRT 中的应用
2023-11-27陈维军邱礼凤邵凯南贾勇士詹文明李强邱凌云丁洁妮林白桦梁晓东李玉成
陈维军 邱礼凤 邵凯南 贾勇士 詹文明 李强 邱凌云 丁洁妮 林白桦 梁晓东 李玉成
立体定向放疗(stereotactic body radiation therapy,SBRT)目前已经成为不可手术的早期非小细胞肺癌(non-small cell lung cancer,NSCLC)的标准治疗方法[1]。与手术相比,SBRT 具有可门诊治疗、无创、无严重并发症等优点[2-4]。由于SBRT 技术的靶区剂量高和靶区周边正常组织剂量迅速跌落的剂量学特征,因此对SBRT 技术无论在计划评估还是治疗实施时的剂量学精度和摆位精度都要求非常高。由于肺部肿瘤一般会受到呼吸运动或心性搏动的影响,若SBRT 治疗时依旧采取传统的放疗技术,则在治疗过程中,随着呼吸运动的发生,肿瘤便会受到周围组织器官的运动牵拉变形脱离靶区,造成照射野内肿瘤所处位置发生变化。此时照射野内人体组织的电子密度和剂量分布也将发生变化,进而引起靶区内剂量学的改变,主要体现在治疗过程中运动靶区及危及器官所引起的相互运动效应和照射野边缘剂量钝化的剂量梯度效应[5]。肿瘤运动将会导致其接受的治疗剂量不足,正常组织接受的剂量增加,从而出现肿瘤细胞杀灭不完全而正常组织并发症发生率增加的现象[6]。有学者建议,采用呼吸门控技术或者腹部加压术可以较好地控制肿瘤运动,进而减少实际治疗时的剂量偏差[7-9]。此外,一些学者提出采用四维CT-ITV 法[10-11],定位时对患者行四维CT 扫描,观察肿瘤的运动度,确定相应的靶区外放边界(setup margin,SM),将肿瘤的活动区域都纳入计划靶区(planning target volume,PTV),确保在每个呼吸时相,运动肿瘤都可以被照射到,此种方法在一定程度上可以减少边缘梯度效应但并不能消除。现阶段国际上主流的治疗计划系统对于运动器官和靶区的剂量学评估还停留在三维剂量学阶段,而且对于运动器官和靶区的四维剂量学评估,大多还停留在模拟的水平[12-14]。本团队提出了一种新的四维剂量重建方法,拟将肿瘤运动周期内不同时相下不同的解剖结构与实际照射剂量相结合,以解决治疗中因肿瘤运动引起的剂量学误差问题,并将此方法应用于10例行SBRT 治疗的早期NSCLC 患者的四维剂量学重建和统计分析,现报道如下。
1 对象和方法
1.1 一般资料 序贯选取2022 年1 月至2023 年1月在浙江省人民医院接受放疗的NSCLC 患者10 例,其中男9 例,女1 例;年龄64~82 岁,中位年龄为71岁。纳入标准:无放疗禁忌证,卡氏评分(Karnofsky performance scale,KPS)>70 分。排除标准:放疗禁忌证,合并其他基础疾病影响本次研究结果观察,合并其他肿瘤。本研究经本院医学伦理委员会审查通过(批准文号:QT2023296),所有患者均知情同意,并按照《赫尔辛基宣言》的伦理标准进行。
1.2 CT 模拟定位、靶区勾画及三维计划设计 患者模拟定位时均采用平躺式仰卧位,双手置于托架上,且均选择颈胸一体热塑膜对患者进行体位固定,并沿肋骨下缘对热塑膜进行裁剪,以保证由呼吸运动引起的体表信号不受热塑膜的覆盖,便于监测患者肿瘤运动信号。打开SentinelTM(V 5.4.2 SP3,C-RAD Positioning AB,Uppsala,Sweden)光学体表追踪系统,将监测门控点放置于肋骨下缘(图1,见插页),用于采集肿瘤运动状态波形曲线。观察患者呼吸情况,采集呼吸频率并设置合理的呼吸基线与频率范围,待呼吸频率均匀重复几个周期后使用CT 模拟机(version discovery CT590,GE,Wisconsin USA)对患者行四维CT 扫描,扫描时患者均采用自由呼吸方式,层厚为2.5 mm。将所有四维CT 图像序列传至MonacoTM(V5.11,Elekta AB,Stockhoim,Sweden)放疗计划系统,由高年资放疗医师根据ICRU62 和83 号报告对接受SBRT 的患者靶区和危及器官进行勾画[15-16];由高年资物理师采用容积调强技术,按照传统的方法在平均密度投影(average intensity projection,AIP)CT 图像上进行SBRT 计划设计,所使用的射线为能量6 MV 的X 射线,剂量计算网格为0.2 cm/voxel,得到的靶区和危及器官得到的剂量命名为三维剂量,剂量评估标准参考AAPM101 号报告要求(表1)[17]。

表1 SBRT 放疗计划剂量评估标准

图1 患者治疗状态下的肿瘤运动波形曲线的获取(左侧红点为门控点位置)
1.3 四维剂量重建方法
1.3.1 时间-剂量权重的获取 采用Catalyst SystemsTM(V5.4.2 SP3,C-RAD Positioning AB,Uppsala,Sweden)进行光学体表配准下的辅助摆位,并在治疗时使用该系统自动获得患者的肿瘤运动状态波形曲线,待患者治疗完毕后,将采集到的肿瘤运动曲线文件导出,使用Python 语言对治疗时肿瘤运动波形曲线按振幅从波谷至波峰均分为5 等份(图2),并求出一次完整治疗中每个CT时相所占的时间-剂量权重(图3)。见公式1:
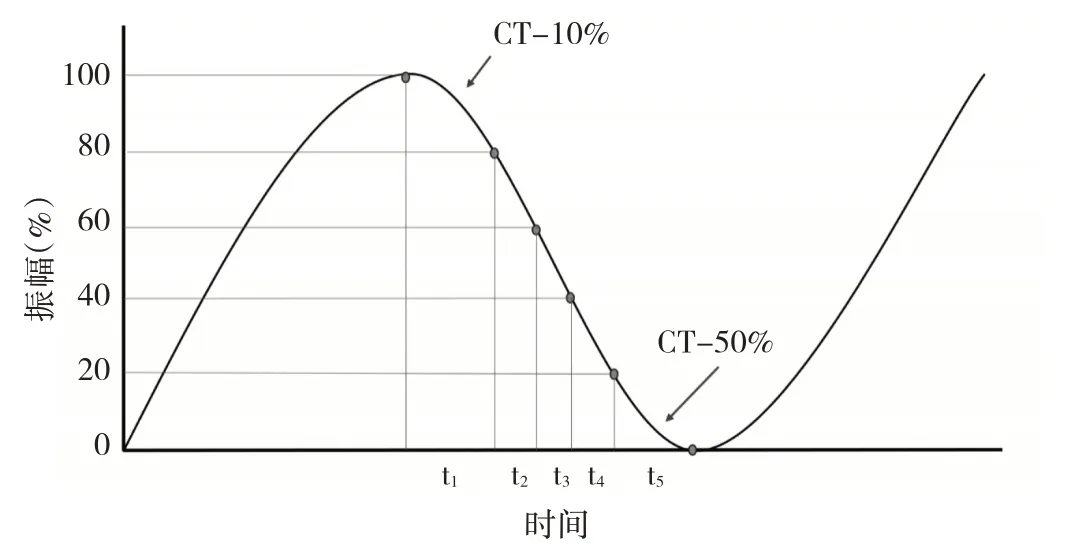
图2 治疗中肿瘤各时相CT上驻留时间-剂量权重计算示意图

图3 10 例患者各时相CT 上治疗驻留时间占总周期的权重
注:公式中w 为呼吸持续时间-剂量权重,t 为某一呼吸时相的持续时间。分为5 等份的原因为肺部肿瘤的运动在体表信号上表现为规则性的往返运动波形,5 等份即可代表患者体内肿瘤的一次往返运动
1.3.2 四维剂量重建 将原放疗计划分别投射到CT-10%至CT-50%的5 组CT 图像序列上,处方剂量分别按照上述获得的时间-剂量权重进行加权后正向重算,获得经加权的剂量分布信息,分别为Dose1、Dose2、Dose3、Dose4 和Dose5。 使用MIM software(V7.2.7,Mim Software,Cleveland,USA)将Dose1 至Dose5 的5 组剂量分布信息形变映射并叠加至AIP-CT 图像中,获得经时间-剂量加权的四维剂量分布信息(图4),得到的靶区和危及器官得到的剂量,命名为四维剂量。

图4 四维剂量重建流程图
1.4 统计学处理 所有数据均采用SPSS 20.0 统计软件处理。分别统计三维剂量与四维重建剂量信息,包括PTV 的最小剂量DMin和最大剂量DMax,;剂量梯度指数R50(PTV 处方剂量50%等剂量线包绕的体积度与PTV体积的比值)、D2cm(表示PTV 外任意方向2 cm 处的最大剂量)、适形指数(conformity index,CI);全肺的平均剂量(DMean)、V10、V20、V12.5、V13.5;心脏的最大剂量(DMax)和平均剂量(DMean);脊髓的最大剂量(DMax);肋骨的最大剂量(DMax)和肋骨超过3 cm3体积对应的剂量(D3)。
所有数据采用Shapiro-Wilk 正态检验,发现心脏的平均剂量和最大剂量、R50和D2cm不符合正态分布,其余数据符合正态分布。符合正态分布的数据采用表示,用配对t检验;不符合正态分布的数据采用M(P25,P75)表示,用Wilcoxon 两样本秩和检验。P<0.05 为差异有统计学意义。采用GraphPad Prism 5 作图。
利用公式2、3 对CI 以及R50进行计算。
利用公式4 对三维、四维剂量进行剂量学评估的参数偏差值计算,并使用GraphPad Prism 5 作图。
注:CI 指治疗体积与PTV 的比值,式中VT,ref表示PTV 的体积与100%处方剂量线所围成的体积的交集;VT表示PTV 的体积;Vref表示100%处方剂量线所围成的体积。CI 数值越接近1,其适形度越好
注:R50为PTV 处方剂量50%等剂量线的体积与PTV 体积的比值,公式中VIDC50%表示50%处方剂量线所围成的体积
注:3D 表示传统三维剂量计算方式下靶区和正常组织所接受到的剂量学评估参数,4D 表示对四维剂量重建后靶区和正常组织所接受到的剂量学评估参数。Dif 表示偏差值,其数值越小,说明三维剂量与四维剂量的差异越小
2 结果
2.1 靶区及危及器官的三维剂量与四维重建剂量的剂量学参数比较 PTV 的CI 及R50、全肺的DMean及V10、肋骨的D3两者比较差异均有统计学意义(均P<0.05),其余靶区以及危及器官的三维、四维剂量学参数比较差异均无统计学意义(均P>0.05),见表2。
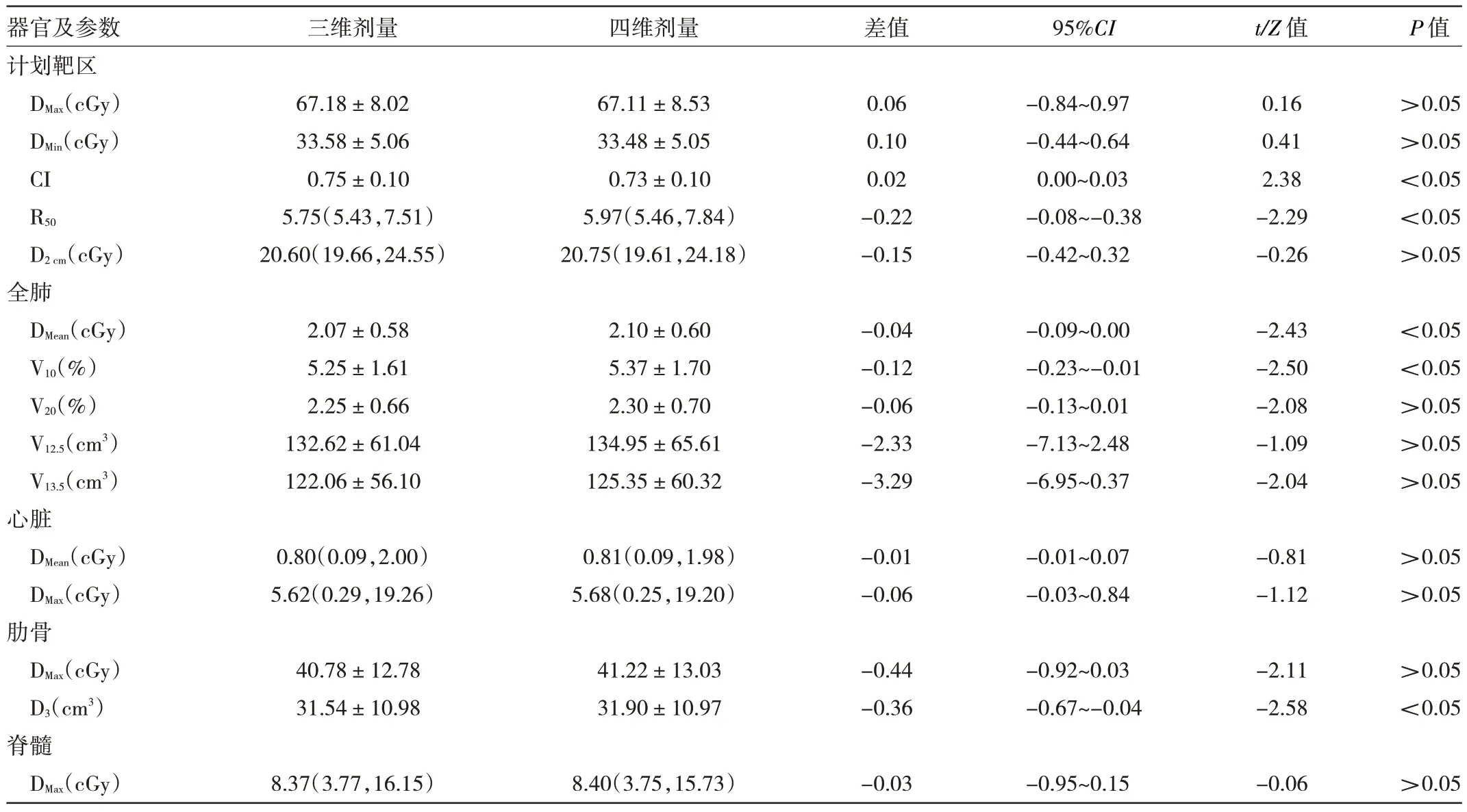
表2 患者靶区和危及器官三维剂量与四维重建剂量的参数比较
2.2 靶区及危及器官三维剂量与四维的剂量偏差比较 危及器官和靶区的三维剂量与四维剂量偏差的横向比较显示,所有参数的平均剂量偏差都在5%以内,见表3。对危及器官和靶区的三维剂量与四维剂量偏差的纵向比较如图5 至图9 所示,除第5 例患者的肺和心脏以及第9 例患者肺和CI 的剂量偏差>5%以外,其余患者的相关参数的剂量偏差均在5%以内。

表3 患者靶区和危及器官三维剂量与四维重建剂量的偏差比较(%)
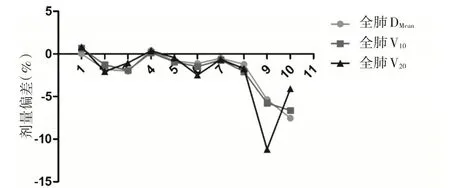
图6 全肺的DMean、V10、V20偏差

图7 全肺V12.5、V13.5以及PTV 的R50剂偏差
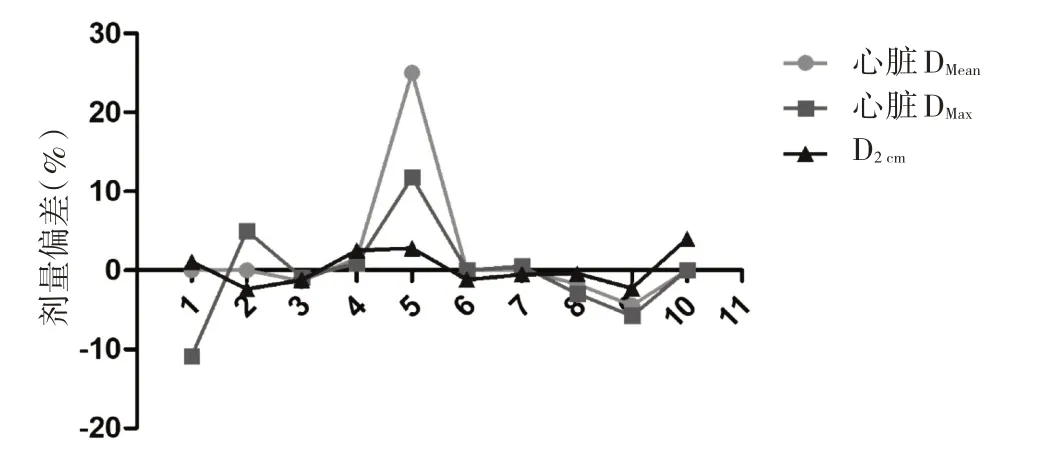
图8 心脏DMean、DMax以及PTV 的D2 cm剂量偏差

图9 计划靶区的DMax、DMin以及CI 偏差
3 讨论
目前主流的计划系统使用容积旋转调强技术(volumetric modulated arc therapy,VMAT)技术治疗肺癌SBRT 计划时经常在四维CT 重建的CT-A 图像进行计划设计,然而这样只能近似地计算出不同时相上的患者所获得的剂量[18-19]。在胸部肿瘤中,呼吸运动导致的肿瘤和危及器官的运动是放疗中剂量不确定因素之一[20-21]。对于肺部肿瘤的SBRT 等大剂量低分次的放疗消融技术,已有的研究表明,动态器官和靶区在治疗时所受到的剂量因剂量梯度效应会发生变化,但变化的量在个体的患者身上无法衡量;对于使用调强等技术来实施SBRT 治疗,必须考虑照射野与运动器官和靶区的相互运动效应,这个效应引起的个体的患者剂量学变化也暂时无法衡量[22-23]。这两个不确定的因素引起的总的剂量学变化,导致了临床放疗医师对于运动靶区和器官的剂量评估上的缺陷。本文提出的基于治疗中实时肿瘤运动状态的四维剂量重建方法,考虑了运动肿瘤在放疗实施期间,患者体内结构的变化,弥补了传统平均时相加权的计算方法的缺陷。
笔者对10 例行SBRT 治疗的早期NSCLC 患者进行四维剂量学评估,并与传统的三维剂量学评估方法进行剂量学参数的对比分析发现,所有参数的平均剂量偏差都在5%以内。对危及器官和靶区的三维剂量与四维剂量偏差的纵向比较如图5-9所示,但是对患者独立对比分析发现,除第5 例患者的肺和心脏以及第9 例患者肺和CI的剂量偏差>5%其余患者的相关参数的剂量偏差均在5%以内,三维剂量和四维重建剂量差异的主要来源笔者认为主要是AIP时相图像和T10%~T50%时相图像解剖结构发生变化导致CT值不同从而引起剂量计算的差异。通过分析比较三维剂量与四维剂量,发现全肺DMean及V10、PTV 的CI 及R50、肋骨D3差异均有统计学意义,其余靶区以及危及器官参数的三维、四维剂量比较差异均无统计学意义。因此对于受呼吸运动影响比较大的肺部肿瘤,尤其对分次剂量比较高SBRT计划,在进行计划评估时更要着重关注靶区和危及器官的四维剂量。
由表2 可知肺、心脏及肋骨的四维剂量均比三维评估的剂量大;而PTV DMax、PTV DMin、CI、D2cm,则变小;脊髓的差异不大。因此,临床医生在评估SBRT计划时,对于靶区剂量采用三维评估时可能导致靶区剂量不足,对于肺、心脏和肋骨等危及器官的三维剂量评估时可能会导致危及器官剂量实际接受的剂量要高于三维计算的剂量,但是对于受呼吸影响不大的骨性结构脊髓来说,两者之间几乎无剂量差异,虽然脊髓的三维剂量与四维剂量差异不大,但脊髓属于串行器官,如果某一点受到的剂量过高就会导致整个器官功能的丧失,因此,还是要密切关注脊髓的剂量变化并对其谨慎评估。
由图9和表2可见,靶区的剂量偏差范围在-11.15%~6.83%,运动器官的剂量偏差范围在-11.20%~25%,与Sun 等[24]通过呼吸加权得到的剂量偏差靶区-14.73%~12.73%,危及器官剂量偏差-8.99%~8.56%的结果具有一定的差异,其原因可能是两者选择的患者类型不同,Sun 等[24]选择的患者均为肺下叶NSCLC 患者,肿瘤运动幅度较大,而本文随机选用的上、中、下叶的NSCLC 患者。同时Sun等[24]通过将各时相剂量变形配准映射50%的时相CT图像中,而本文是基于AIP图像上进行剂量映射叠加。此外,Ehrbar[25]等对9例腹部和胸部肿瘤患者进行回顾性研究,在进行刚行配准之后得到的四维剂量与三维剂量之间的偏差为靶体积为-2.1%~1.4%,危及器官为-0.8%~1.7%,由于两者之间选择的患者不一样,靶区和危及器官受呼吸运动的影响也有差异;其次两者之间的配准方法也有差异。但是以上两项研究和本研究充分说明了呼吸运动会影响靶区所受的实际剂量的事实,因而在实际治疗中要特别关注其影响。
ICRU-24号报道指出靶区剂量偏差5%以上就可能使原发灶失控或并发症发生率增加[26],通过本研究笔者发现对于大部分患者目前采用传统三维剂量评估方式对肺癌的SBRT放疗计划评估不会使原发灶失控或并发症发生率增加;但通过10 例患者的个体化对比分析,笔者发现第5例患者的心脏平均剂量偏差和第9例患者的靶区和肺的剂量偏差超过5%,其原因可能是实际治疗时肿瘤运动曲线不规律且与CT模拟机采集的呼吸曲线不一致引起。对于这类位于胸部的肿瘤运动幅度较大患者,笔者认为在CT 模拟定位之前进行有规律的呼吸训练能够提高患者在治疗时呼吸频率与采集的呼吸频率吻合度,也即提高患者体内肿瘤与解剖结构运动的重复性,以降低传统三维剂量学评估的误差影响。
本文采用四维剂量重建方法,考虑到了患者治疗期间不同时相下患者解剖结构变化,并依据不同时相CT在治疗期间的时间权重进行了剂量加权修正,弥补了传统按平均时间剂量权重分配的方法的不足,可以更加准确反映患者实际的受照射剂量。将此方法应用于10 例肺癌SBRT 患者的四维剂量学重建,笔者发现对于大部分患者其剂量偏差都在5%以内,但使用四维剂量学的计算方式,因其评估方式更加科学合理,有利于临床医生对患者的放疗时的实际放疗剂量有一定的认知及把握,以及对肿瘤的杀灭和患者放疗后并发症的预测。除此之外,本研究存在一定的不足,本文只是对患者的呼吸振幅进行5等分且样本量较少,后续加大样本量并对振幅进行10等分然后加权得到四维剂量进行研究,使得计算的剂量更加接近实际治疗的剂量。此外,本文所述的四维剂量重建方法是以照射野同步照射到患者为假设前提,未考虑子野传递剂量的时间同步问题,本方法有待进一步改进。但总体来说,本文这一剂量重建方法的提出,为放疗的更加精准实施并临床获益提供了一定的理论支撑。
