金属有机骨架-分子印迹复合微球的溶胶-凝胶法制备、表征及其对杜仲中桃叶珊瑚苷的提取分离
2023-11-27李中正杨城城王建霞王思源
李中正,向 波,邓 文,杨城城,王建霞,王思源,石 欣,田 果,李 辉*
金属有机骨架-分子印迹复合微球的溶胶-凝胶法制备、表征及其对杜仲中桃叶珊瑚苷的提取分离
李中正1,向 波2#,邓 文3,杨城城3,王建霞1,王思源1,石 欣1,田 果1,李 辉3*
1. 吉首大学医学院,湖南 吉首 416000 2. 吉首大学第一附属医院 检验科,湖南 吉首 416000 3. 吉首大学化学化工学院,湖南 吉首 416000
以金属有机骨架(metal-organic frameworks,MOFs)为载体,制备桃叶珊瑚苷印迹复合材料,并用于杜仲中桃叶珊瑚苷的提取和分离。采用溶胶-凝胶法制备了桃叶珊瑚苷印迹聚合物(EM@MIPs),并通过傅里叶变换红外光谱(Fourier transform infrared spectrometer,FT-IR)和扫描电子显微镜(scanning electron microscope,SEM)表征了该聚合物(EM@MIP3)表面化学官能团和形貌特征,通过色谱法考察了印迹材料对杜仲桃叶珊瑚苷的分离效果。印迹材料(EM@MIP3)具有较高的印迹因子(6.830)和较高选择性,相对于喇叭糖苷、车前草苷和京尼平苷,其对桃叶珊瑚苷的选择性因子()值分别为4.931、4.896和3.418。采用色谱法测定EM@MIP3柱对桃叶珊瑚苷的吸附能力,其吸附量为51.34 mg/g。使用EM@MIP3柱对杜仲提取物中桃叶珊瑚苷进行在线分离纯化时,桃叶珊瑚苷产品纯度大于85%,回收率高于95%。此外,EM@MIP3聚合物可重复使用。印迹材料(EM@MIP3)有望发展成为一种高效的吸附介质,用于中药中桃叶珊瑚苷的分离和纯化。
杜仲;溶胶-凝胶法;分子印迹聚合物;金属有机骨架材料;桃叶珊瑚苷;提取分离;喇叭糖苷;车前草苷;京尼平苷
桃叶珊瑚苷是一种广泛存在于杜仲、车前草、人参、延胡索等植物中的天然产物,具有降压、抗氧化、抗衰老、抗炎、抗纤维化、抗癌等多种生物活性[1-4]。从杜仲药材中提取高附加值的桃叶珊瑚苷已成为杜仲产业发展的重要一环。然而,由于植物中成分复杂,且存在大量结构相似的化合物,使得桃叶珊瑚苷的分离费时费力[5]。桃叶珊瑚苷的传统分离往往涉及沉淀、结晶、两相萃取、大孔树脂吸附等繁琐的程序。而高选择吸附剂的研究和应用对于该化合物的分离纯化具有重要意义。
分子印迹聚合物(molecularly imprinted polymer,MIPs)基于其对目标化合物的高选择性结合能力,为从复杂系统中实现高效分离提供了可能。MIPs已广泛应用于色谱分离[6-8]、生物传感器[9-10]、催化[11-12]和其他领域[13-14]。表面印迹法可将吸附位点布置在载体表面,从而在很大程度上改善分子识别过程中的传质动力学。但选择高比表面、易于修饰和具有较多活性基团的载体至关重要。
金属有机骨架(metal-organic frameworks,MOFs)是金属离子与有机配体组装而成的多孔晶体材料[15]。MIL-101(Cr)作为MOFs家族的一员,通过金属铬离子(III)与对苯二甲酸[16-18]配位而成。与传统多孔材料(如活性炭、沸石、分子筛等)相比,MIL-101(Cr)具有比表面积大、孔隙率高、孔可设计、易于合成等特点[19-20],广泛用于吸附分离、催化、载药及药物控释等领域[21-22]。但MOFs材料对目标化合物选择性不够高,限制了其应用。将MOFs的高吸附容量与MIPs的高选择性相结合,有利于制备选择性和吸附性能优良的新型吸附材料,这为以MOFs为基体制备新型分子印迹聚合物提供了新思路。通过该方法获得的新型印迹聚合物在吸附选择性、结合容量和传质动力学方面将大幅提高。一些研究人员将MIPs固定在MOFs上,开发出了新型分子印迹电化学传感器,在色谱分析中表现出更高的选择性和灵敏度[23-25]。
MOFs基MIPs的制备主要是将MIPs负载到MOFs基质上或直接通过黏合剂进行结合,但这种固化方法很不稳定,并会引起严重的非特异性结合而导致测量差异[26-27]。溶胶-凝胶法是一种通过水解来制备高交联无定形二氧化硅材料的新技术[28]。二氧化硅基材是绿色、生物相容性高和环境友好型材料。近年来,溶胶-凝胶法被用来制备MIPs[29-30]。溶胶-凝胶反应可在水或醇介质中进行,其前驱体毒性明显低于有机试剂,且溶胶-凝胶法制备的MIPs具有更高的选择性和更快的传质速率[31]。凝胶二氧化硅的刚性及高度交联结构有利于创建形状选择性的印迹位点,增强印迹材料的物理刚性、化学惰性、热稳定性和亲水性[32]。
本研究以氨基修饰的MIL-101(Cr)材料为载体,采用溶胶-凝胶法制备了MOFs基桃叶珊瑚苷印迹聚合物(EM@MIPs)。优化了制备条件,并将分子印迹聚合物EM@MIP3用作液相色谱固定相,评价其分子识别能力。此外,还研究了EM@MIP3在线提取和分离杜仲粗提物中桃叶珊瑚苷的应用性,并考察了EM@MIP3的重复使用性。
1 仪器与材料
1.1 仪器
S-3400型扫描电子显微镜(SEM)、LC-2010 AHT型高效液相色谱仪、UV-2550型紫外/可见分光光度计,日本岛津仪器公司;WGH-30A型傅里叶变换红外光谱(Fourier transform infrared spectrometer,FT-IR)光谱仪,天津仪器有限公司;Branson型超声波清洗器,上海必能信超声波有限公司。
1.2 试剂
桃叶珊瑚苷(批号20160202)、京尼平苷(批号20130514)、喇叭糖苷(批号20130615)和车前草苷(批号20130525)购自中国河南万嘉股份有限公司,质量分数均≥98%。MIL-101(Cr),平均粒径300 nm,来自中国江苏先锋纳米材料股份有限公司。甲苯、二甲基亚砜(DMSO)、甲醇、异丙醇、乙腈、乙酸和乙醇,均为分析纯,来自中国天津永大化学试剂厂。3-氨丙基三乙氧基硅烷(3- aminopropyltriethoxysilane,APTES,质量分数99%)和四乙氧基硅烷(tetraethyl orthosilicate,TEOS,质量分数99%)来自中国上海阿拉丁生化技术股份有限公司。浓HCl和浓NH3·H2O购自中国上海申博化工厂。去离子水使用前经0.45 μm微孔滤膜滤过。不锈钢空柱(5 cm×2 mm)来自日本岛津公司。
1.3 材料
1.3.1 药材 杜仲购自中药材市场(产地湖南慈利),经湘西土家族苗族自治州民族中医院药剂科王洪副主任中药师鉴定,为杜仲科杜仲属落叶乔木杜仲Oliver.的干燥树皮。
1.3.2 杜仲提取物样品溶液的制备 将10.0 g干燥杜仲原料粉末加入200 mL石油醚中,在54.9 ℃下加热回流12 h。滤过后,将固体用200 mL乙醇在49.9 ℃下再萃取30 min。将收集的乙醇滤液减压蒸发以除去大部分溶剂。将杜仲提取物溶解在含有1% H2O的20 mL乙腈中待用[33]。
2 方法与结果
2.1 EM@MIPs的制备
2.1.1 MIL-101(Cr)的氨基改性 为提高载体活性,制备前,先用乙二胺为改性剂[34]对金属有机骨架MIL-101(Cr)进行化学修饰。将MIL-101(Cr)粉末4.0 g和乙二胺0.3 g加入100 mL甲苯中,加热回流12 h,滤过得到的固体用50 mL无水乙醇洗涤3次,真空干燥24 h,得到灰色固体,即MIL-101(Cr)-NH2(EM)。
2.1.2 EM@MIPs的制备 采用溶胶-凝胶法进行,制备流程如图1所示,EM@MIPs的合成始于溶胶-凝胶功能前体APTES的酸性水解。在20 mL异丙醇-乙醇混合溶剂(5∶1)中加入一定体积的APTES(如表1所示)和0.5 mL 0.1 mol/L HCl,待APTES水解。搅拌均匀后,室温下放置6 h。然后,在剧烈搅拌下加入0.1 mmol桃叶珊瑚苷、400 mg EM和0.2 mL DMSO,均匀分散后,静置4 h,得溶液A。另将一定体积的功能前体TEOS(如表1所示)和0.5 mL 0.1 mol/L HCl加入到10 mL异丙醇-乙醇混合溶剂(5∶1)中,搅拌20 min,得溶液B。将溶液A与溶液B混合,混合溶液通入Ar气流中鼓泡20 min,加入1.0 mL 1.0 mol/L NH3·H2O,溶液在室温下放置12 h。然后将反应混合物倒入20 mL甲醇中,反复超声处理直至滤液中检测不到桃叶珊瑚苷。收集固体并在49.9 ℃下干燥过夜,生成桃叶珊瑚苷印迹聚合物EM@MIPs。作为对照,按照相同的程序(但不添加模板桃叶珊瑚苷)制备非印迹聚合物EM@NIPs。
2.1.3 EM@MIPs制备条件优化 溶剂类型、功能单体和交联剂用量等影响聚合物性能。用异丙醇-乙醇(5∶1)混合物为溶剂时,因极性较弱有利于模板和功能单体间的相互作用,而乙醇可促进单体溶解。优化了模板、功能单体和交联单体的物质的量比。表1分别给出了摩尔比为1∶4∶5、1∶6∶10、1∶8∶15和1∶10∶20时,制备的EM@MIPs的IF值(色谱条件:EM@MIPs色谱柱;流动相为乙腈;体积流量0.2 mL/min;柱温24.9℃;检测波长235 nm;进样量10 μL。底物质量浓度0.2 mg/mL)。从表1可知,IF值随功能前驱体和交联前驱体的体积增加而增加,当APTES和TEOS与模板的物质的量比高于8∶1和15∶1时,IF值增加缓慢。因此,选用模板-APTES-TEOS的物质的量比为1∶8∶15来制备印迹材料,这样获得的印迹聚合物EM@ MIP3的IF值最高(6.830)。
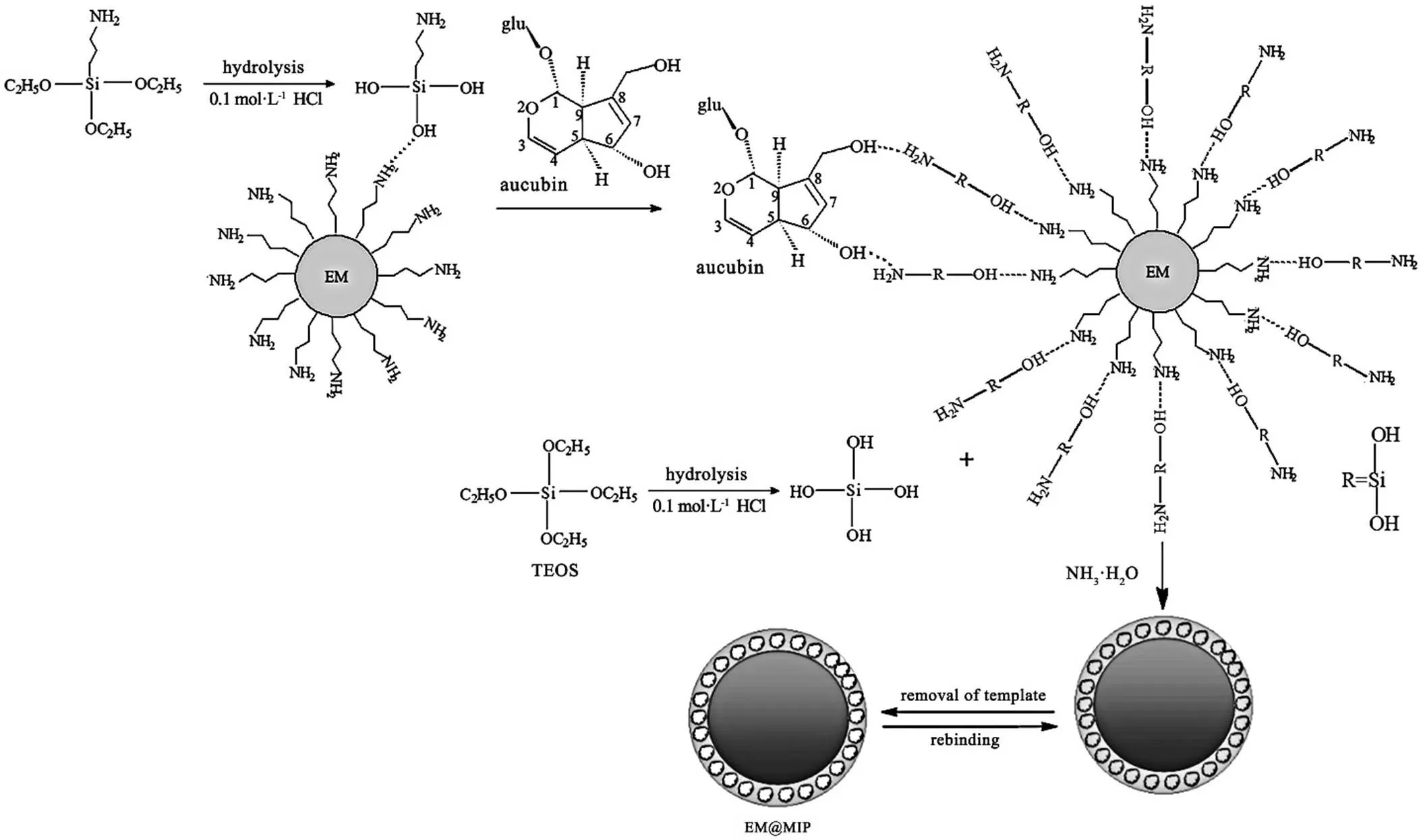
图1 桃叶珊瑚苷印迹聚合物(EM@MIPs)的制备示意图
2.2 EM@MIP3和EM@NIP3的表征
2.2.1 FT-IR分析 EM@MIP3和EM@NIP3的FT-IR光谱图如图2所示。EM@MIP3有几个主要的红外吸收峰,即3526 cm−1处O-H键伸缩振动、3475 cm−1处N-H键伸缩振动、3028 cm−1处-CH2基团中C-H键伸缩振动、1650 cm−1处C=O键伸缩振动,1410 cm−1桃叶珊瑚苷分子双环框架振动,1253 cm−1处C-O键伸缩振动,1145 cm−1处C-O-C伸缩振动,1082 cm−1处Si-O键伸缩振动,以及桃叶珊瑚苷分子中615 cm−1处糖苷环框架振动。
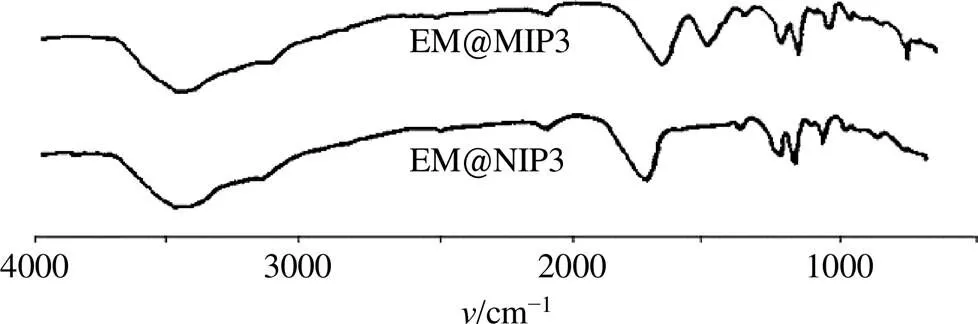
图2 EM@MIP3和EM@NIP3的FT-IR光谱
与EM@MIP3的FT-IR光谱相比,EM@NIP3在1410 cm−1和615 cm−1(桃叶珊瑚苷分子的2个特定吸收峰)处没有显示出红外吸收。EM@NIP3的吸收峰为3522 cm−1处O-H键伸缩振动,3481 cm−1处N-H键伸缩振动,3030 cm−1处-CH2基团中C-H键伸缩振动,1655 cm−1处C=O键伸缩振动,1253 cm−1处C-O键伸缩振动、1147 cm−1处C-O-C伸缩振动、1086 cm−1处Si-O键伸缩振动。这些红外吸收峰表明印迹过程成功。
2.2.2 SEM观察 EM@MIP3和EM@NIP3的SEM照片如图3所示,2种聚合物微球颗粒大小较均匀,平均粒径0.5~1.0 μm。此外,还观察到一些微细颗粒或颗粒微团,这可能来源于制备过程中的一些副反应,例如交联前体或功能单体之间的低聚作用等。这种均匀印迹微球更适合作为色谱介质。因此,使用EM@MIP3和EM@NIP3颗粒作为色谱固定相来评价其分子识别性能。

图3 EM@MIP3 (a) 和EM@NIP3 (b) 的SEM照片
2.3 EM@MIP3色谱行为测试
用分子印迹聚合物作为固定相,在LC-2010 AHT高效液相色谱系统中测试EM@MIP3的色谱行为。首先将中空不锈钢柱(5 cm×2 mm)用甲醇和去离子水反复清洗,除去柱内壁的灰尘和污垢,然后风干。称取0.15 g EM@MIP3粉末,分散到异丙醇中,以甲醇为介质,用匀浆法将聚合物填充到柱中。最后将柱连接到液相色谱系统中,用甲醇和乙腈为流动相依次洗脱,直至观察到稳定的基线。用乙腈-甲醇(20∶1)为混合溶剂,分别配制桃叶珊瑚苷、喇叭糖苷、车前草苷、京尼平苷标准溶液0.2 mg/mL,所有标准溶液均保持在24.9 ℃。用含水乙腈(含10%、5%、2%、1%水)作为流动相,流动相体积流量为0.2 mL/min,检测波长为235 nm,等度模式下,测定了EM@MIP3柱的色谱行为。柱温在24.9~44.9 ℃变化,进样体积为10 μL。用丙酮测试色谱柱的死时间。容量因子()、选择性因子()和IF分别由公式(1)、(2)和(3)计算。
=(r-0)/0(1)
=桃叶珊瑚苷/com(2)
IF=MIP3/NIP3(3)
r是化合物的保留时间,0是色谱柱的死时间,桃叶珊瑚苷和com是模板和结构相关化合物的容量因子,MIP3和NIP3分别是EM@MIP3和EM@NIP3色谱柱的容量因子
采用前沿液相色谱法测试了EM@MIP3柱对目标物的吸附能力,用目标物质量浓度为0.01 mg/mL- 1%水的乙腈溶液为流动相,当流动相以0.2 mL/min的速率泵入柱中后,当流出曲线达到一稳定的平台后,完成突破。由突破曲线可计算印迹聚合物的吸附量[35]。
将分子印迹聚合物作为色谱固定相,通过色谱法可获得其对不同化合物的保留值[6-37]及分离效能。但色谱柱填装的均匀性和通透性均会影响测定结果。本研究采用浆料法填充色谱柱,装柱前将聚合物分散在异丙醇中,再用高压泵进行装填。
色谱柱通透性通过柱后压(又称背压,其高低反映了色谱柱的通透性)来评价。图4分别以甲醇、水、乙腈和2.0 mmol/L NaH2PO4-Na2HPO4(pH 8.0)缓冲溶液为流动相,不同体积流量(0.2、0.4、0.6、0.8、1.0 mL/min)时的柱后压。从图4中可以看出,当使用2.0 mmol/L NaH2PO4-Na2HPO4(pH 8.0)缓冲溶液或纯水作为流动相时,柱后压较高;而当使用乙腈时柱后压相对较低。另外,柱后压对流动相流速高度依赖,流速越快柱后压越高。因此,选择乙腈作为基础流动相,选择体积流量为0.2 mL/min进行后续实验。
使用不同体积分数的乙腈溶液(含10%、5%、2%、1%水)作为流动相,测试了桃叶珊瑚苷及其结构类似物(喇叭糖苷、车前草苷和京尼平苷,分子结构如图5所示)在EM@MIP3和EM@NIP3柱上的保留能力。表2显示了EM@MIP3色谱柱在不同流动相下的值。从表中数据可知,以乙腈为流动相时,EM@MIP3色谱柱对桃叶珊瑚苷的保留能力最强,值最高,为10.64;当乙腈流动相中水含量增加时,桃叶珊瑚苷的值减少。当流动相中的水含量高于10%时,选择性丧失。这表明印迹位点和模板分子之间的作用力主要为氢键。但分析物的分子结构,如分子形状、官能团位置和数量,也会影响其保留,这可从相同流动相下几种化合物不同的保留因子推断得出。喇叭糖苷是一种模板类似物,可视为桃叶珊瑚苷分子C8位羟甲基被乙酸甲酯取代的产物,尽管含有1个糖基和1个环戊烯基吡喃双环结构,但在印迹柱上的保留因子降低。同样,京尼平苷在印迹柱上的弱保留也可能是由于京尼平苷分子结构中官能团位置和类型的差异造成的。车前草苷分子除含有1个糖基外,与模板分子的分子结构存在较大差异,因此,其在EM@MIP3柱上的保留最弱。
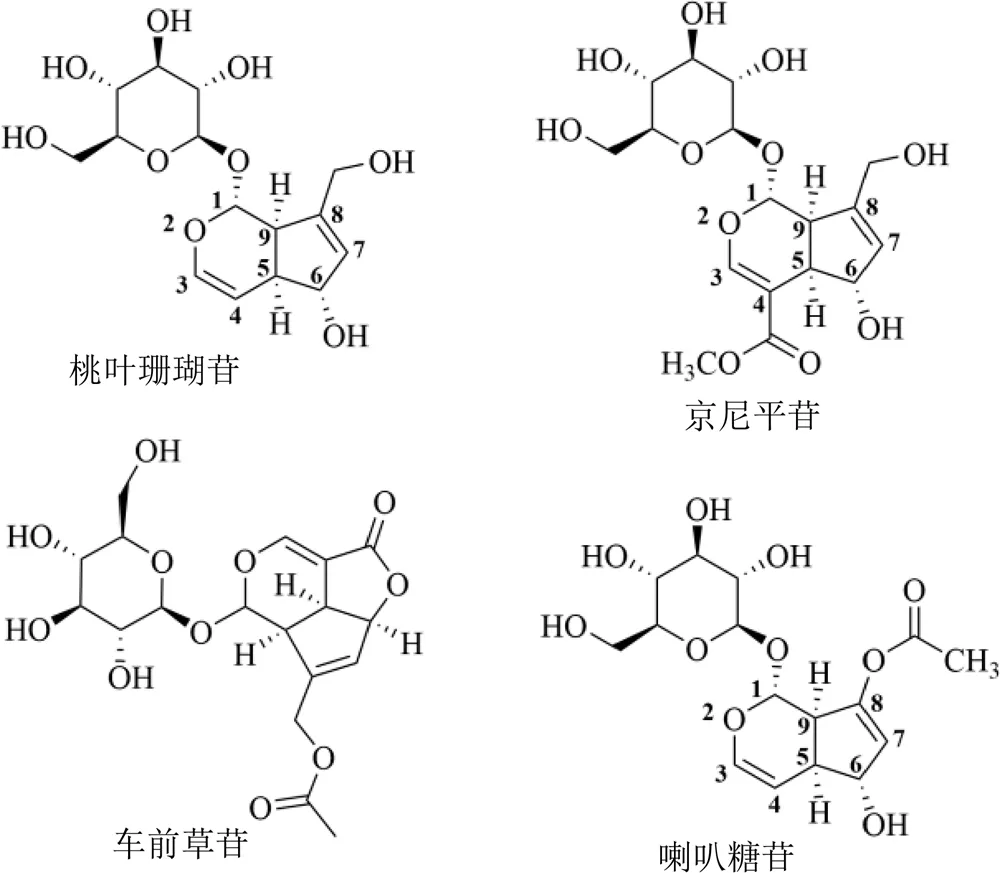
图5 桃叶珊瑚苷(AU)、京尼平苷(GP)、喇叭糖苷(BG)和车前草苷(PG)的分子结构
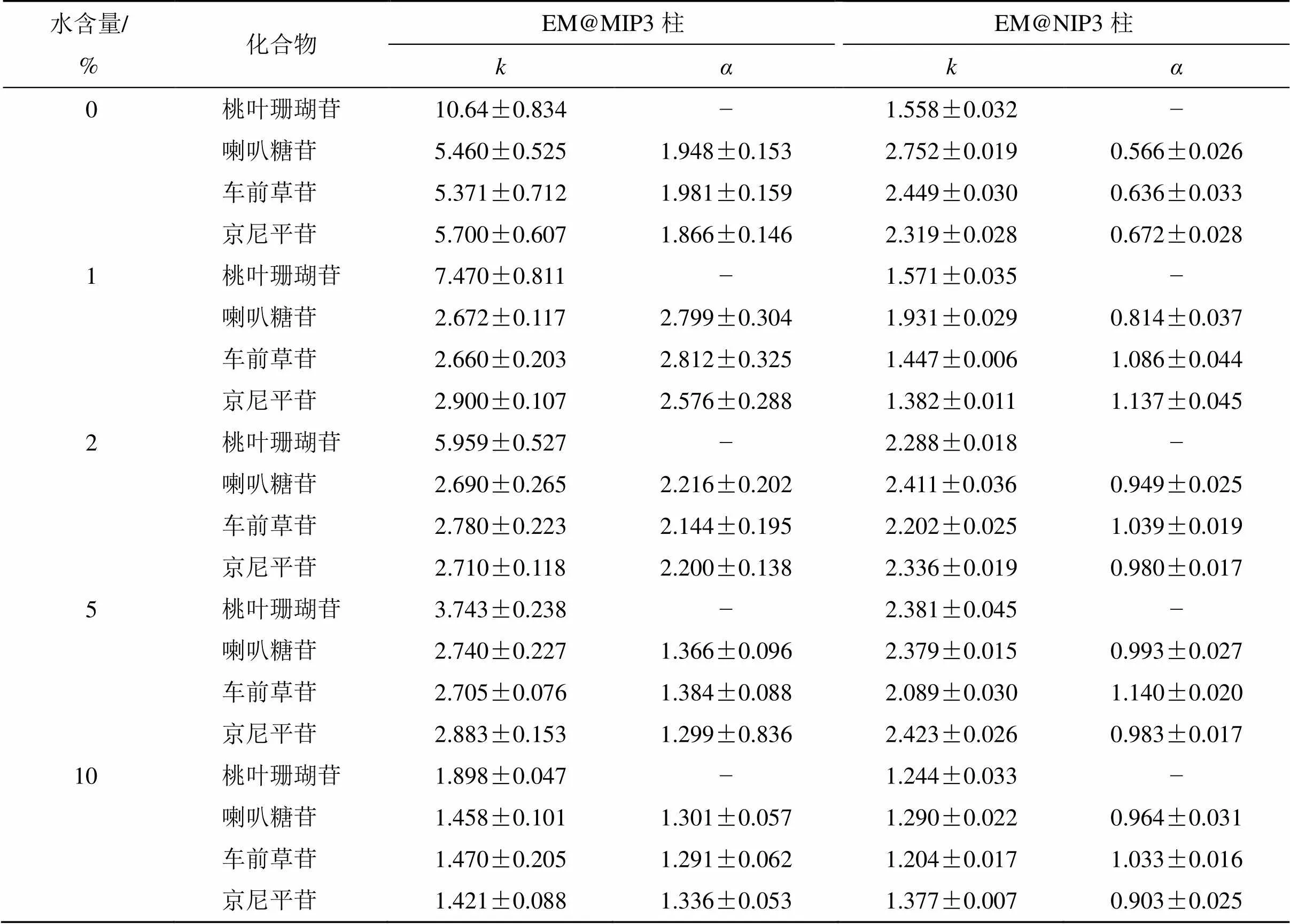
表2 使用不同体积分数乙腈作为流动相时,EM@MIP3和EM@NIP3柱对桃叶珊瑚苷及其结构类似物的保留行为
表2还显示了分子印迹柱对桃叶珊瑚苷的与变化规律。随着流动相中水含量的增加,EM@ MIP3色谱柱的选择性先增大后减小。当使用含1%水的乙腈作为流动相时,印迹聚合物对模板选择性最高,其相对于喇叭糖苷、车前草苷和京尼平苷,分别为2.799、2.812和2.576。与印迹聚合物柱相比,非印迹柱EM@NIP3对几种化合物的保留能力较弱,几乎没有选择性。
印迹柱对桃叶珊瑚苷的高选择性源于EM@ MIP3柱基质中与模板分子在大小、形状和官能团等方面匹配的结合位点。这些结果也可从图6所示的色谱洗脱曲线得到证实(色谱条件:EM@MIP3色谱柱,含1%水的乙腈为流动相,柱温24.9 ℃;底物质量浓度0.2 mg/mL;进样量10 μL)。因此,用含1%水的乙腈作为流动相时,EM@MIP3柱对桃叶珊瑚苷具有较高的选择性保留能力。
用含1%水的乙腈作为流动相时,测试了EM@ MIP3柱在不同温度(24.9、34.9、44.9 ℃)下的保留行为。表3显示了该印迹柱对几种化合物的值(色谱条件:EM@MIP3色谱柱;以含1%水的乙腈为流动相,体积流量为0.2 mL/min,底物质量浓度0.2 mg/mL;进样量10 μL)。可以发现,柱温24.9 ℃时,印迹柱具有最高的值,其对模板的为7.470。柱温升高,值下降。不同柱温下EM@MIP柱的值如表3所示。结果表明,印迹柱的值随温度先升高后降低,当柱温34.9 ℃时选择性最高,EM@ MIP柱对桃叶珊瑚苷的值相对于喇叭糖苷、车前草苷和京尼平苷分别为4.931、4.896、3.418。优化的色谱条件:柱温34.9 ℃、流动相为含1%水的乙腈、体积流量0.2 mL/min。
2.4 EM@MIP3柱分离桃叶珊瑚苷
基于EM@MIP3柱对模板分子的选择识别能力,测试了印迹柱对模拟混合物中桃叶珊瑚苷、喇叭糖苷、车前草苷和京尼平苷的分离能力。当底物质量浓度为0.1 mg/mL,柱温为34.9 ℃时,图7-a和b分别显示了模型混合物在EM@MIP3和EM@NIP3聚合物固定相上的流出曲线。显然,分子印迹柱EM@NIP3可以将桃叶珊瑚苷从模拟混合物中完全分离出来。但对于EM@NIP3色谱柱,在色谱图上仅观察到单峰,模拟混合物没有分离。
本实验还测试了分子印迹材料的固相萃取应用性能。但萃取前,需知道其吸附容量。为此,利用前沿色谱技术进行测量。所谓前沿色谱,就是以含有待测物质的溶液为流动相,当流动相留给固定相时,待测物在固定相上进行吸附脱附,当吸附剂达到吸附饱和时,待测物质便随流动相流出,在色谱图上呈现出待测物的流出曲线,即穿透曲线;当目标物在色谱柱上不再被保留时,流出曲线呈现一高的平台。一般而言,穿透时间越长,吸附量越高,根据流出曲线形状、平台半高处的保留值及相应色谱理论便可计算吸附量。图7-c给出了桃叶珊瑚苷在分子印迹柱EM@NIP3及非印迹柱EM@MIP3上的穿透曲线,可以发现,在加载初期,由于聚合物基质中存在大量结合位点,桃叶珊瑚苷分子几乎完全保留在结合位点上,流出液中未检测到桃叶珊瑚苷。随着桃叶珊瑚苷的不断流入,空白吸附位点变少,流出曲线上升。当所有结合位点被占据后,桃叶珊瑚苷将不再被保留,流出曲线构建了1个高的平台。通过半高法,求得桃叶珊瑚苷在EM@NIP3柱和EM@MIP3柱上的吸附容量分别为23.72、51.34 mg/g。
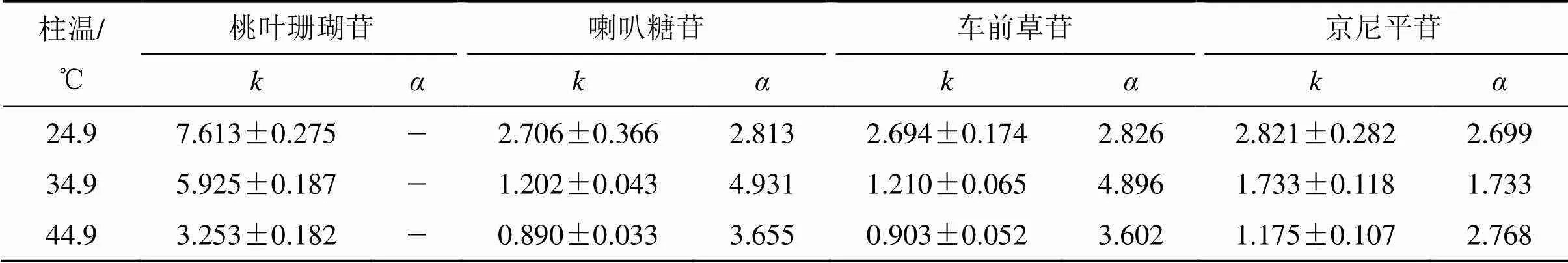
表3 不同柱温下EM@MIP3柱对印迹模板桃叶珊瑚苷及其结构类似物的k和α值
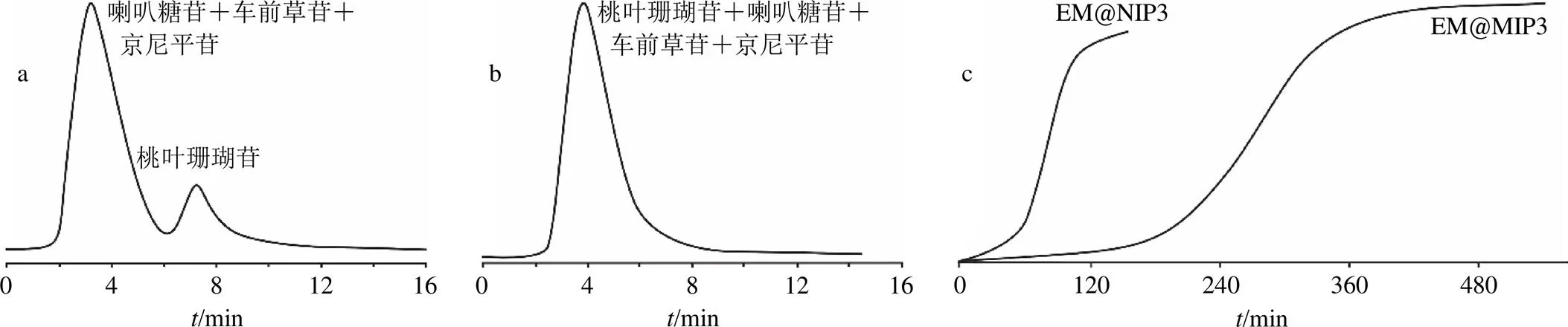
图7 桃叶珊瑚苷、京尼平苷、喇叭糖苷和车前草苷的模型混合物在EM@MIP3 (a) 和EM@NIP3 (b) 柱的洗脱曲线和0.01 mg·mL−1桃叶珊瑚苷在2根柱上的穿透曲线(c)
使用在线色谱系统进行目标化合物的分离应用。进样前,用含有1%水的乙腈溶液作为流动相平衡色谱柱。桃叶珊瑚苷的分离以一种在线方式进行,以EM@MIP3为分离柱,洗脱剂为含1%水的乙腈溶液,体积流量0.2 mL/min,柱温设定为34.9 ℃。向EM@MIP3色谱柱中分别注入20、40、60、80、100 μL的杜仲提取物样品溶液,收集保留时间为6.5~9.0 min的流出液,旋转蒸发脱除溶剂,即得桃叶珊瑚苷产品。
各产品的纯度及目标物回收率如表4所示,可以发现,当样品溶液进样体积小于60 μL时,得到的桃叶珊瑚苷产品质量分数85%以上,回收率高于95%。图8-b和c给出了杜仲提取物样品溶液的HPLC图及装载体积为60 μL时,分离所得桃叶珊瑚苷产品的HPLC图[色谱条件:C18柱(150 mm×4.6 mm,5 μm);流动相为甲醇-水-乙酸混合溶液(20∶80∶1.5);体积流量1.0 mL/min;进样体积10 μL;检测波长235 nm)]。
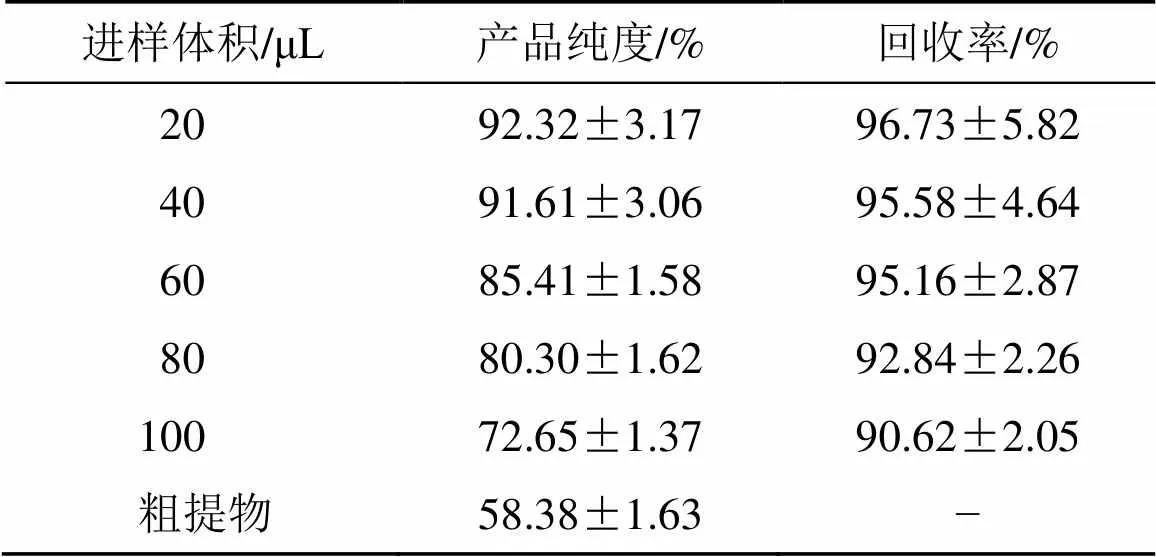
表4 EM@MIP3色谱柱在线分离杜仲桃叶珊瑚苷
利用分子印迹材料从含有0.2 mg/mL桃叶珊瑚苷的乙腈溶液中分离目标化合物,探讨了EM@MIP3的重复使用性能。结果表明印迹材料重复使用10次后,桃叶珊瑚苷回收率几乎恒定,聚合物重复使用性高。
3 讨论
采用溶胶-凝胶法成功制备了MOF基桃叶珊瑚苷印迹复合微球,优化制备条件为桃叶珊瑚苷与APTES和TEOS的物质的量比为1∶8∶15。优化条件下制备的分子印迹聚合物EM@MIP3具有最高的IF值(6.830)。当以EM@MIP3为液相色谱固定相,以含1%水的乙腈混合溶液为流动相(体积流量0.2 mL/min,柱温34.9 ℃)时,印迹柱对桃叶珊瑚苷具有最高的选择保留能力,其对桃叶珊瑚苷的相对于喇叭糖苷、车前草苷和京尼平苷分别为4.931、4.896和3.418。EM@MIP3柱对桃叶珊瑚苷的吸附容量达51.34 mg/g。基于分子印迹聚合物的高选择性及高吸附能力,以之为吸附剂在线萃取杜仲粗提物中的桃叶珊瑚苷时,当样品溶液装载体积小于60 μL时,一次萃取可获得纯度85%以上的桃叶珊瑚苷产品,回收率高于95%。这种分子印迹固相萃取为杜仲桃叶珊瑚苷的分离纯化提供了一种新的简单方法,有望推广到其他中药活性成分的提取及分离纯化。
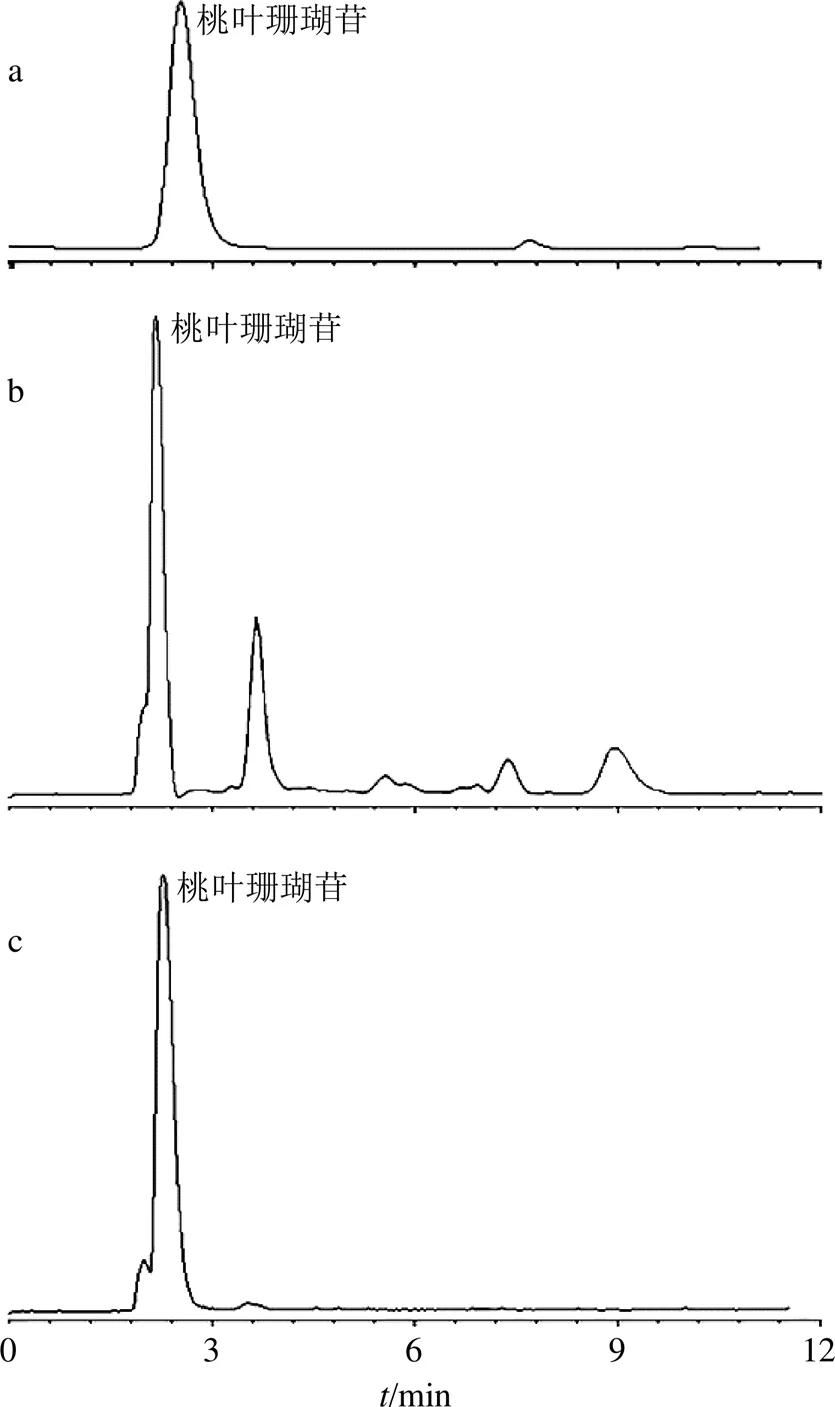
图8 桃叶珊瑚苷标准品(a)、杜仲粗提物(b)及经EM@ MIP3柱分离后的桃叶珊瑚苷产品(c)的HPLC图
利益冲突 所有作者均声明不存在利益冲突
[1] Zeng X C, Guo F, Ouyang D S. A review of the pharmacology and toxicology of aucubin [J]., 2020, 140: 104443.
[2] Huang T L, Yang S H, Chen Y R,. The therapeutic effect of aucubin-supplemented hyaluronic acid on interleukin-1beta-stimulated human articular chondrocytes [J]., 2019, 53: 1-8.
[3] Liao Y H, Chen F, Xu L J,. Study on extraction and antibacterial activity of aucubin fromseed-draff waste biomass [J]., 2022, 8(10): e10765.
[4] Potočnjak I, Marinić J, Batičić L,. Aucubin protects against cisplatin-induced acute kidney injury in mice via attenuation of oxidative stress, apoptosis and inflammation [J]., 2020, 142: 111472.
[5] Yu L, Cao L, Chang Y H,. Enhanced extraction performance of iridoids, phenolic acids fromleaves by tailor-made ternary deep eutectic solvent [J]., 2021, 161: 105788.
[6] Xu Y W, Tan Y L, Majeed Z,. Hybrid molecularly imprinted polymers for targeted separation and enrichment of 10-hydroxycamptothecin inDecne [J]., 2023, doi: 10.1080/14786419.2023.2228981.
[7] Karaman Ersoy Ş, Tütem E, Sözgen Başkan K,. Preparation, characterization and usage of molecularly imprinted polymer for the isolation of quercetin from hydrolyzed nettle extract [J]., 2016, 1017/1018: 89-100.
[8] 倪付勇, 刘露, 宋亚玲, 等. 分子印迹技术定向分离桂枝茯苓胶囊中活性成分去氢土莫酸 [J]. 中草药, 2015, 46(6): 853-856.
[9] Karimi-Maleh H, Yola M L, Atar N,. A novel detection method for organophosphorus insecticide fenamiphos: Molecularly imprinted electrochemical sensor based on core-shell Co3O4@MOF-74 nanocomposite [J]., 2021, 592: 174-185.
[10] Aftim N, Istamboulié G, Piletska E,. Biosensor- assisted selection of optimal parameters for designing molecularly imprinted polymers selective to phosmet insecticide [J]., 2017, 174: 414-419.
[11] Cai J T, Chen T, Xu Y H,. A versatile signal- enhanced ECL sensing platform based on molecular imprinting technique via PET-RAFT cross-linking polymerization using bifunctional ruthenium complex as both catalyst and sensing probes [J]., 2019, 124/125: 15-24.
[12] Cho S J, Noh H B, Won M S,. A selective glucose sensor based on direct oxidation on a bimetal catalyst with a molecular imprinted polymer [J]., 2018, 99: 471-478.
[13] Mokhtari P, Ghaedi M. Water compatible molecularly imprinted polymer for controlled release of riboflavin as drug delivery system [J]., 2019, 118: 614-618.
[14] Loghmani M H, Shojaie A F, Hosseini S A. Glutathione- responsive hydrogel and molecularly imprinted polymer nanospheres: New aspect on cisplatin delivery [J]., 2021, 96: 98-108.
[15] 蔡梦如, 姚宇, 尹东阁, 等. 金属有机骨架材料在中药研究的应用进展 [J]. 中草药, 2021, 52(16): 5028-5038.
[16] Yang K, Sun Q, Xue F,. Adsorption of volatile organic compounds by metal-organic frameworks MIL- 101: Influence of molecular size and shape [J]., 2011, 195: 124-131.
[17] Rajati H, Navarchian A H, Tangestaninejad S. Preparation and characterization of mixed matrix membranes based on Matrimid/PVDF blend and MIL-101(Cr) as filler for CO2/CH4separation [J]., 2018, 185: 92-104.
[18] Gargiulo N, Peluso A, Aprea P,. Chromium-based MIL-101 metal organic framework as a fully regenerable D4 adsorbent for biogas purification [J]., 2019, 138: 230-235.
[19] Kirchon A, Feng L, Drake H F,. From fundamentals to applications: A toolbox for robust and multifunctional MOF materials [J]., 2018, 47(23): 8611- 8638.
[20] Li J, Wang X X, Zhao G X,. Metal-organic framework-based materials: Superior adsorbents for the capture of toxic and radioactive metal ions [J]., 2018, 47(7): 2322-2356.
[21] Li J R, Sculley J, Zhou H C. Metal-organic frameworks for separations [J]., 2012, 112(2): 869-932.
[22] Xie L J, Liu S Q, Han Z B,. Preparation and characterization of metal-organic framework MIL-101 (Cr)-coated solid-phase microextraction fiber [J]., 2015, 853: 303-310.
[23] Hageneder S, Bauch M, Dostalek J. Plasmonically amplified bioassay-total internal reflection fluorescence. epifluorescence geometry [J]., 2016, 156/157: 225-231.
[24] Eskandari H, Amirzehni M, Asadollahzadeh H,. MIP-capped terbium MOF-76 for the selective fluorometric detection of cefixime after its preconcentration with magnetic graphene oxide [J]., 2018, 275: 145-154.
[25] Rawool C R, Srivastava A K. A dual template imprinted polymer modified electrochemical sensor based on Cu metal organic framework/mesoporous carbon for highly sensitive and selective recognition of rifampicin and isoniazid [J]., 2019, 288: 493-506.
[26] Arabi M, Ostovan A, Bagheri A R,. Strategies of molecular imprinting-based solid-phase extraction prior to chromatographic analysis [J]., 2020, 128: 115923.
[27] Chen G N, Guo P Q, Wang Y,. Preparation of molecularly imprinted polymers and application in a biomimetic biotin-avidin-ELISA for the detection of bovine serum albumin [J]., 2019, 198: 55-62.
[28] Lofgreen J E, Ozin G A. Controlling morphology and porosity to improve performance of molecularly imprinted sol-gel silica [J]., 2014, 43(3): 911-933.
[29] Chen G N, Shu H, Wang L,. Facile one-step targeted immobilization of an enzyme based on silane emulsion self-assembled molecularly imprinted polymers for visual sensors [J]., 2019, 145(1): 268-276.
[30] Zhao T, Wang Q Q, Li J,. Study on an electrochromatography method based on organic- inorganic hybrid molecularly imprinted monolith for determination of trace trichlorfon in vegetables [J]., 2014, 94(10): 1974-1980.
[31] Bie Z J, Chen Y, Ye J,. Boronate-affinity glycan- oriented surface imprinting: A new strategy to mimic lectins for the recognition of an intact glycoprotein and its characteristic fragments [J]., 2015, 54(35): 10211-10215.
[32] Shang L, Liu C J, Watanabe M,. LSPR sensor array based on molecularly imprinted sol-gels for pattern recognition of volatile organic acids [J]., 2017, 249: 14-21.
[33] 陈玉甫, 张学俊, 王明力, 等. 不同方法提取杜仲中桃叶珊瑚苷等4种高活性成分的比较研究 [J]. 天然产物研究与开发, 2019, 31(1): 10-15.
[34] Tian H X, Hui L, Mao L,. Preparation of a pinoresinol diglucoside imprinted polymer using metal organic frame as the matrix for extracting target compound from[J]., 2021, 56(18): 3136-3150.
[35] Ostrihoňová M, Cabadaj P, Polakovič M. Design of frontal chromatography separation of 1-phenylethanol and acetophenone using a hydrophobic resin [J]., 2023, 314: 123578.
[36] Wang D D, Luo X X, Wang M,. Selective separation and purification of polydatin by molecularly imprinted polymers from the extract ofet, rats’ plasma and urine [J]., 2020, 1156: 122307.
[37] Miura C, Li H, Matsunaga H,. Molecularly imprinted polymer for chlorogenic acid by modified precipitation polymerization and its application to extraction of chlorogenic acid fromleaves [J]., 2015, 114: 139-144.
Preparation of metal-organic frameworks-based molecularly imprinted polymer microsphere by a sol-gel technique and its application in extraction and separation of aucubin from
LI Zhong-zheng1, XIANG Bo2, DENG Wen3, YANG Cheng-cheng3, WANG Jian-xia1, WANG Si-yuan1, SHI Xin1, TIAN Guo1, LI Hui3
1. School of Medicine, Jishou University, Jishou 416000, China 2. Department of Clinical Laboratory, First Affiliated Hospital of Jishou University, Jishou 416000, China 3. College of Chemistry and Chemical Engineering, Jishou University, Jishou 416000, China
To prepare an aucubin imprinted polymer (EM@MIPs) composite with metal-organic frameworks (MOFs) as the carrier and apply its to the extraction and separation of aucubin from Duzhong ().A sol-gel method was utilized to prepared EM@MIPs and the superficial chemical functional groups and morphology of polymers were characterized by Fourier transform infrared spectrometer (FT-IR) and scanning electron microscope (SEM). The molecular recognition behavior for this imprinted material was evaluated through chromatographic method.The imprint materials (EM@MIP3) obtained under the optimized conditions possessed a high imprinting factor (6.830) and a high selectivity toward the template, with selectivity factor () values of 4.931, 4.896 and 3.418 relative to bugle glucoside, plantain glucoside and geniposide, respectively. The binding capacity for aucubin on the EM@MIP3 column was determined by frontal chromatography technique, with a value of 51.34 mg/g. The EM@MIP3 column can be utilized to on-line separation of aucubin from the extract of, obtaining more than 90% purity of aucubin products, with a recovery higher than 95%. In addition, the reusability for the EM@MIP3 polymer was satisfactory.This imprint materials (EM@MIP3) are expected to be developed into an efficient adsorption media for the separation and purification of aucubin from Chinese medicines.
Oliv.; sol-gel technique; molecularly imprinted polymer; metal organic frameworks; aucubin; extraction and separation; bugle glucoside; plantain glucoside; geniposide
R283.6
A
0253 - 2670(2023)22 - 7402 - 10
10.7501/j.issn.0253-2670.2023.22.016
2023-08-17
国家自然科学基金资助项目(21865011)
李中正,博士,副教授,硕士生导师,主要从事中药药效物质基础与作用机制研究。E-mail: 397182163@163.com
通信作者:李 辉,博士,教授,硕士生导师,主要从事分子印迹药物载体的研究。E-mail: lihuijsdx@163.com
向 波,硕士,主任技师,主要从事药物检验新剂型与新技术的研究。E-mail: xiangbobo1999@163.com
[责任编辑 郑礼胜]
