大米发酵物的提取工艺优化及抗氧化活性研究
2023-11-26郝雯雯于瑞莲王贝琦李兴阳王琴钱和
郝雯雯,于瑞莲*,王贝琦,李兴阳,王琴,钱和
1(南京中医药大学 药学院,江苏 南京,210023)2(无锡市检验检测认证研究院,江苏 无锡,214000)3(江南大学 食品学院,江苏 无锡,214122)
大米是我国历史悠久的主要粮食作物之一,具有较高的营养价值和低致敏性,含有多种营养物质,如微量元素、碳水化合物以及良好配比的氨基酸,可为机体代谢提供充分的能量[1-2]。大米在满足个体营养需求的同时不会造成机体的不良反应[3],被广泛应用于婴幼儿配方食品,常作为牛奶不耐受的替代[4]。此外,从大米中提取的一些成分,如油、脂肪酸等也常应用于护肤调理剂,充分体现其使用安全性[5]。在日常生活中,大米常通过烘烤、蒸煮和煎炸等方法食用,但有关其再加工产品的开发和利用的研究较少,主要是通过酶降解、超声波技术、微波处理等提取大米中的活性物质[6]。采用这些非发酵方法加工处理大米时,会出现大米颗粒大小不均,高温破坏活性物质,微量营养元素损失等问题[7]。因此,通过发酵技术改善大米性质逐渐成为大米加工的研究热点。发酵物提取法是利用微生物菌种对以大米为主要配方的培养基质进行生物发酵,使得大米中的活性物质进行转化[8]。常见的微生物菌种主要有酵母菌、乳酸杆菌、双歧杆菌等。有研究表明,利用酵母发酵的大米滤液在抗氧化、修复皮肤屏障方面具有较好的疗效,拓展了大米制品在护肤领域的应用[9-10]。
本研究是利用本实验室具有抗氧化活性的专利菌种IsariacicadaeY.R.L-3与大米进行发酵,以大米发酵物为研究对象,优化其提取方法,探讨其抗氧化活性及对皮肤细胞氧化损伤的保护作用,以提高大米的应用价值,促进抗氧化活性养颜食品原料的开发。
1 材料和方法
1.1 材料与试剂
本实验所用菌种IsariacicadaeY.R.L-3,已获得国家发明专利(专利号:ZL 2017 1 1245962.3)。
本实验所用细胞为人永生化角质细胞(HaCaT),由南京中医药大学药理实验室馈赠。
DPPH,上海源叶生物科技有限公司;水杨酸,上海凌峰化学试剂有限公司;乙醇,无锡亚盛化工有限公司;FeSO4·7H2O,国药集团;磷酸盐缓冲液(phosphate buffer saline,PBS)、胰蛋白酶、胎牛血清、青霉素-链霉素溶液,南京森贝伽生物科技有限公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(methylthiazolyldiphenyl-tetrazolium bromide, MTT),广州赛国生物科技有限公司;二甲基亚砜(dimethyl sulfoxide, DMSO)、丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)试剂盒,南京建成生物科技有限公司。
1.2 仪器与设备
SW-CJ-2G型超净工作台,苏州净化实验设备有限公司;YCP-50型CO2培养箱,长沙华曦电子科技有限公司;XD-202型倒置显微镜,江南永新光学有限公司;Spectra Max 190型酶标仪,美谷分子仪器有限公司。
1.3 实验方法
1.3.1 大米发酵物的制备
按专利要求,配制以干品大米为主要成分的无菌固体培养基质,在无菌条件下均匀接种约11 mL含有Y.R.L-3菌丝体球的种子液。在(22±2) ℃,正常空气湿度下发酵培养30 d,收集固体培养基质,烘干后备用。
1.3.2 大米发酵物提取工艺的优化
将发酵物粉碎后,过筛,按照料液比加入水,按照体积比加入乙醇(95%),加热回流提取一定时间,滤液经离心抽滤后即得发酵物提取液。
根据前期单因素试验结果,选取回流提取时间(A)、料液比(B)、乙醇(95%)体积含量(C)和过筛目数(D)为自变量,以发酵物提取液的蛋白质(考马斯亮蓝法[11])和总糖(硫酸-蒽酮法[12])含量为考察指标,设计四因素三水平正交试验(表1)。
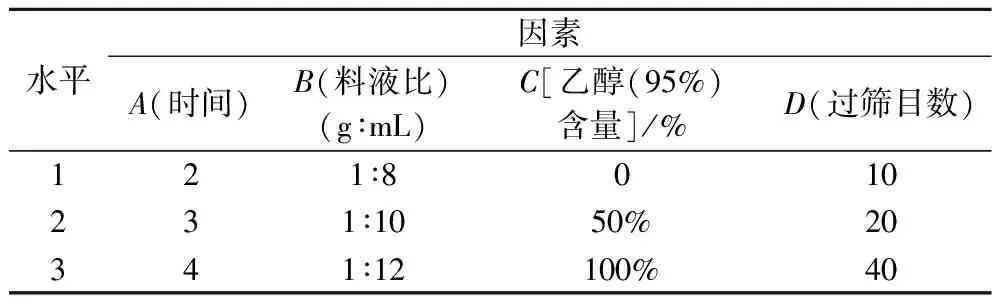
表1 正交试验因素水平表Table 1 Factors and levels of orthogonal experiment
1.3.3 大米发酵物提取液清除自由基能力测定
1.3.3.1 DPPH自由基清除率测定
参照文献[13]并稍作修改。将大米发酵物提取液稀释成0.2~2 mg/mL不同质量浓度的样品液,用无水乙醇稀释DPPH溶液,使其在517 nm下的吸光度为0.70±0.2。将样品液与DPPH-乙醇溶液按1∶10体积比混匀,室温条件下避光静置30 min,在517 nm下测定其吸光度A1,同时用等体积蒸馏水与DPPH-乙醇溶液混合后在相同波长下测定的吸光度为A0。DPPH自由基清除率的计算如公式(1)所示:
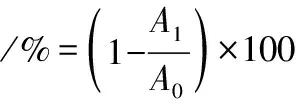
(1)
1.3.3.2 ABTS阳离子自由基清除率测定
参照文献[14]并稍作修改。将7 mmol/L的ABTS溶液与2.4 mmol/L的过硫酸钾溶液按1∶1体积比混匀,配制成ABTS工作液,用PBS磷酸盐缓冲液稀释,使得ABTS工作液在734 nm下的吸光度为0.70±0.05。以4 mL 0.2~2 mg/mL不同质量浓度的大米发酵物提取液为样品液,加入0.5 mL ABTS工作液,室温避光反应6 min,在734 nm下测定吸光度A1,等体积蒸馏水代替样品液,测得吸光度值A0。ABTS阳离子自由基清除率按公式(2)计算:
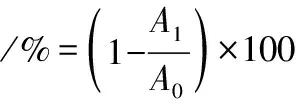
(2)
1.3.3.3 羟自由基清除率测定
参照文献[15]并稍作修改。取0.2~2 mg/mL不同质量浓度的大米发酵物提取液作为样品液,依次加入0.5 mL 9 mmol/mL的FeSO4溶液,0.5 mL 9 mmol/mL的乙醇-水杨酸溶液,以及0.5 mL H2O2溶液,37 ℃水浴加热15 min后在510 nm下测定吸光度Ax,等体积蒸馏水代替H2O2为参比溶液,测定吸光度为Ax0,等体积蒸馏水代替样品液,测定吸光度为A0。羟自由基清除率按公式(3)计算:
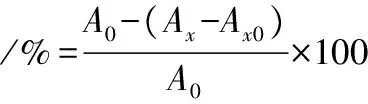
(3)
1.3.4 大米发酵物提取液对HaCaT细胞的保护作用
1.3.4.1 细胞培养
HaCaT细胞于含有84%高糖DMEM培养基、15%胎牛血清及1%青霉素-链霉素的培养瓶中,放置在37 ℃、5% CO2的培养箱中培养,当细胞生长至80%~90%融合度时,进行传代或实验。
1.3.4.2 细胞毒性试验[16]
将对数生长期的HaCaT细胞以1×104个/孔,180 μL/孔接种于96孔板,每组设置6个复孔,37 ℃,5% CO2条件下孵育12 h。细胞状态稳定后,每孔分别加入20 μL不同质量浓度的大米发酵物提取液(20~200 μg/mL),继续孵育24 h后,加入MTT试剂(5 mg/mL),37 ℃孵育4 h后,弃去上清液,加入150 μL DMSO溶液,在490 nm下测定吸光度,并计算细胞存活率。
1.3.4.3 H2O2损伤模型的建立
将对数生长期的HaCaT细胞以1×104个/孔,180 μL/孔接种于96孔板,每组设置6个复孔,37 ℃,5% CO2条件下孵育12 h。细胞状态稳定后,每孔分别加入20 μL H2O2溶液(0.2~4 mmol/L),继续孵育24 h后,加入MTT试剂(5 mg/mL),37 ℃孵育4 h后,弃去上清液,加入150 μL DMSO溶液,在490 nm下测定吸光度,并计算细胞存活率。
1.3.4.4 大米发酵物提取液对H2O2诱导的HaCaT细胞存活率的影响
将对数生长期的HaCaT细胞以1×104个/孔,160 μL/孔接种于96孔板,设置对照组、H2O2组、实验组,每组设置6个复孔。实验组每孔分别加入20 μL不同质量浓度的大米发酵物提取液(40~200 μg/mL),孵育4 h后,除对照组外,其余组均加入20 μL H2O2溶液并孵育20 h,随后通过MTT法检测细胞存活率。
1.3.4.5 HaCaT细胞中SOD、MDA、GSH-Px的测定
将HaCaT细胞接种于6孔板,设置对照组、H2O2组、不同浓度大米发酵物提取液组。处理结束后,收集经细胞裂解液裂解的细胞,用二喹啉甲酸法(bicinchoninic acid assay,BCA)测定其蛋白浓度,并根据制造商说明进行SOD、MDA、GSH-Px的含量测定。
1.4 分析方法
结果用平均数±标准差表示,采用Graph Pad Prism 8软件进行作图和统计分析处理。样品组间采用单因素ANOVA分析,P<0.05为差异有统计学意义。
2 结果与分析
2.1 提取工艺优化
正交试验结果见表2和表3。
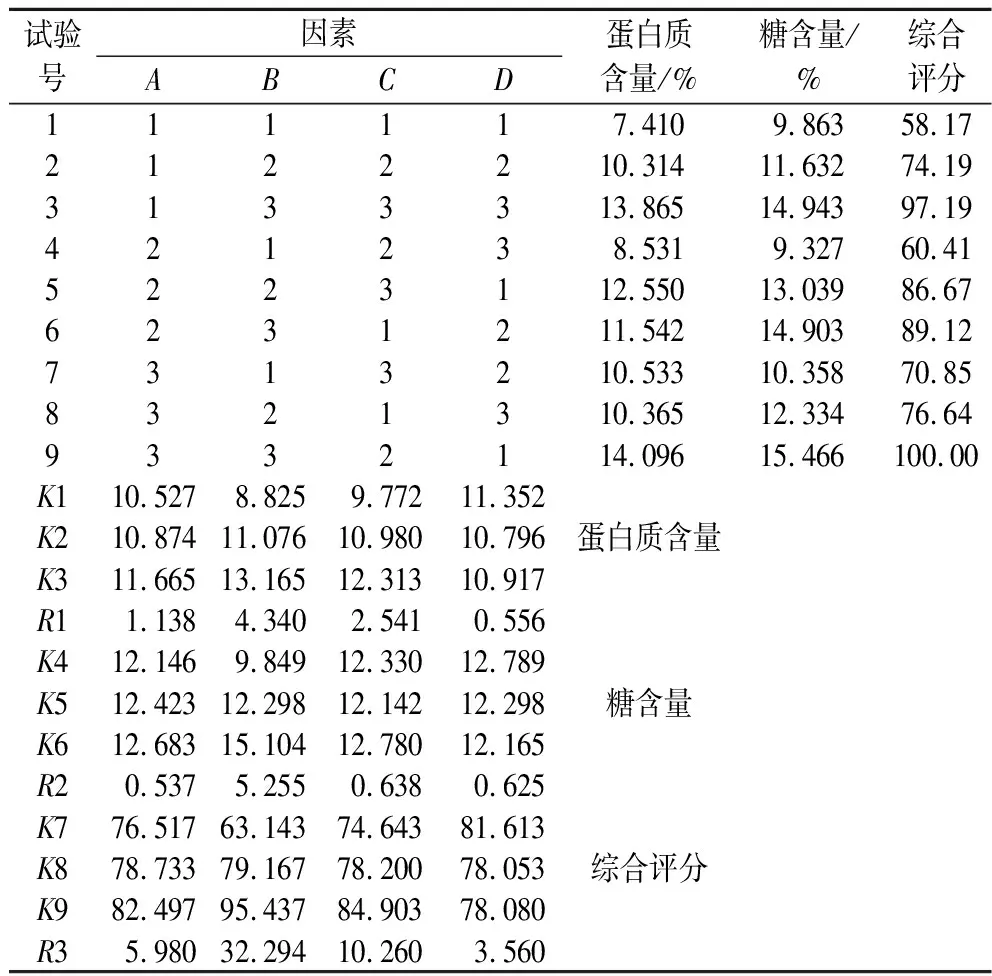
表2 正交试验结果Table 2 Analysis of orthogonal experiment results
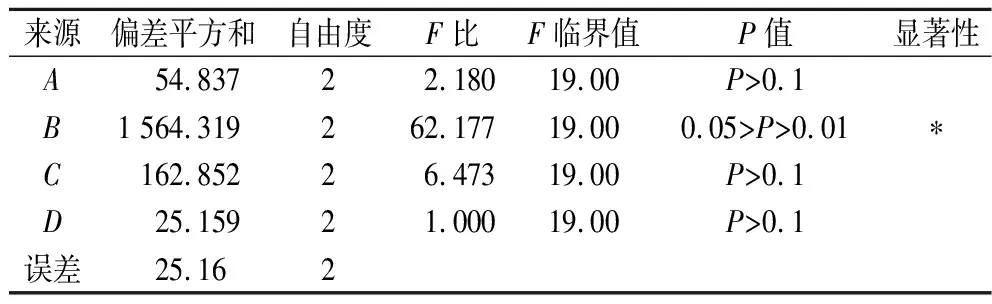
表3 方差分析结果(综合评分)Table 3 Results of variance analysis (comprehensive score)
由R3(综合评分极差)值可知,各因素的影响依次为料液比>乙醇(95%)体积比例>提取时间>过筛目数。通过方差分析可知,料液比对大米发酵物的蛋白质和总糖含量具有显著影响。综合考虑,大米发酵物过10目筛低于过40目筛的得率,因而选取过40目筛。而乙醇(95%)体积比例和提取时间对大米发酵物蛋白质和总糖含量无显著影响,为避免乙醇的致敏性及提高提取效率,故选取1∶12(g∶mL)的料液比、不含95%乙醇、回流提取2 h为最佳提取工艺。
2.2 大米发酵物提取液清除自由基能力
DPPH本身是一种稳定的自由基,呈深紫色,在517 nm处有最大吸收值,其褪色程度与自由基清除率呈正比[17]。由图1-a可知,质量浓度在0.2~2 mg/mL的大米发酵物提取液能产生约45%~95%的DPPH自由基清除率,其清除率随浓度的增加而增加,并且通过线性拟合计算出大米发酵物提取液清除DPPH自由基的半数有效浓度(IC50)为0.352 mg/mL。
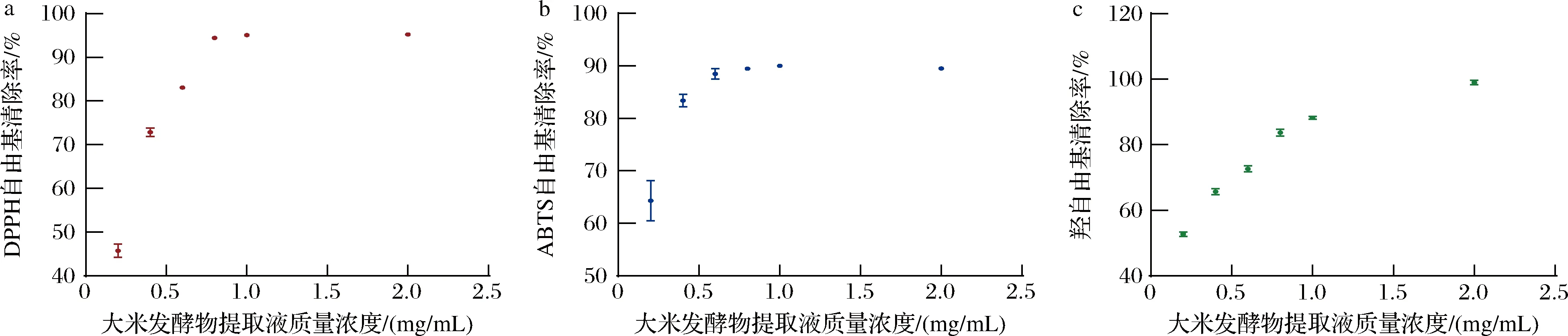
a-DPPH自由基;b-ABTS阳离子自由基;c-羟自由基图1 大米发酵物提取液清除自由基能力Fig.1 Free radical scavenging ability of rice fermentation
ABTS在过硫酸钾的氧化作用下,易生成自由基阳离子ABTS+,呈蓝绿色[18]。如图1-b所示,大米发酵物提取液的浓度越高对ABTS阳离子自由基的清除效果越好,经计算,其ABTS阳离子自由基清除率的IC50为0.302 mg/mL,并且2.0 mg/mL的大米发酵物提取液可以清除约89%的ABTS阳离子自由基。
羟自由基作为机体代谢的副产物,具有毒性强、危害大、较活跃的特点,是引起化学致癌、病理变化的重要因素[19]。通过图1-c可以观察到,当大米发酵物提取液的质量浓度超过2.0 mg/mL时,羟自由基的清除率无限接近于100%。此外,低浓度的大米发酵物提取液对羟自由基同样具有一定的清除作用。
2.3 大米发酵物提取液对H2O2诱导的HaCaT细胞的保护作用
如图2所示,大米发酵物提取液质量浓度为20、40 μg/mL时,对HaCaT细胞的影响较小,其存活率约为96%。随着大米发酵物提取液浓度的增加,细胞存活率也逐渐增加,100~150 μg/mL大米发酵物提取液组细胞存活率与对照组相比有显著性差异。但当样品质量浓度达到200 μg/mL时,细胞存活率又有所下降,表明大米发酵物提取液在一定浓度范围内不会引起HaCaT细胞毒性,并且高浓度的大米发酵提取液促进HaCaT细胞增殖而不会造成其持续增殖。
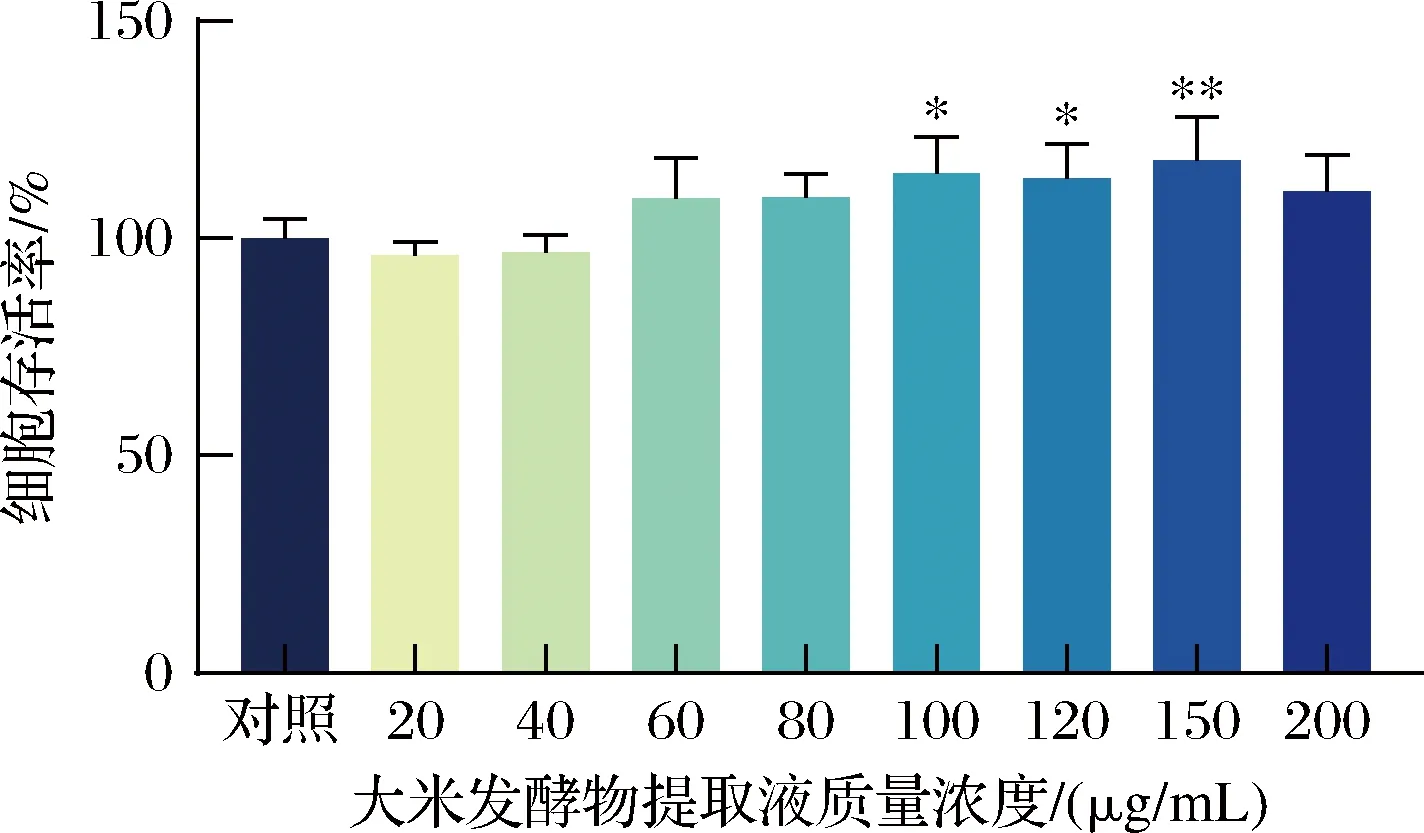
图2 大米发酵物对HaCaT的细胞毒性Fig.2 Cytotoxicity of rice fermentation to HaCaT注:与对照组相比,*P<0.05,**P<0.01,***P<0.001,****P<0.000 1。
为了进一步验证大米发酵物提取液的抗氧化作用,建立了H2O2氧化损伤的HaCaT细胞模型。H2O2虽然不是定义上的自由基,但它是一种重要的氧化剂[20]。外源性的H2O2可以穿透细胞膜,诱导机体产生过多的活性氧,造成细胞内氧化还原失衡[21],诱导细胞凋亡,从而引起氧化损伤,因此H2O2常作为体外氧化应激模型的诱导剂。
本研究采用MTT法测定暴露于不同浓度H2O2下HaCaT细胞存活率,判断H2O2对HaCaT细胞的损伤程度,从而选择最佳的造模浓度。如图3所示,
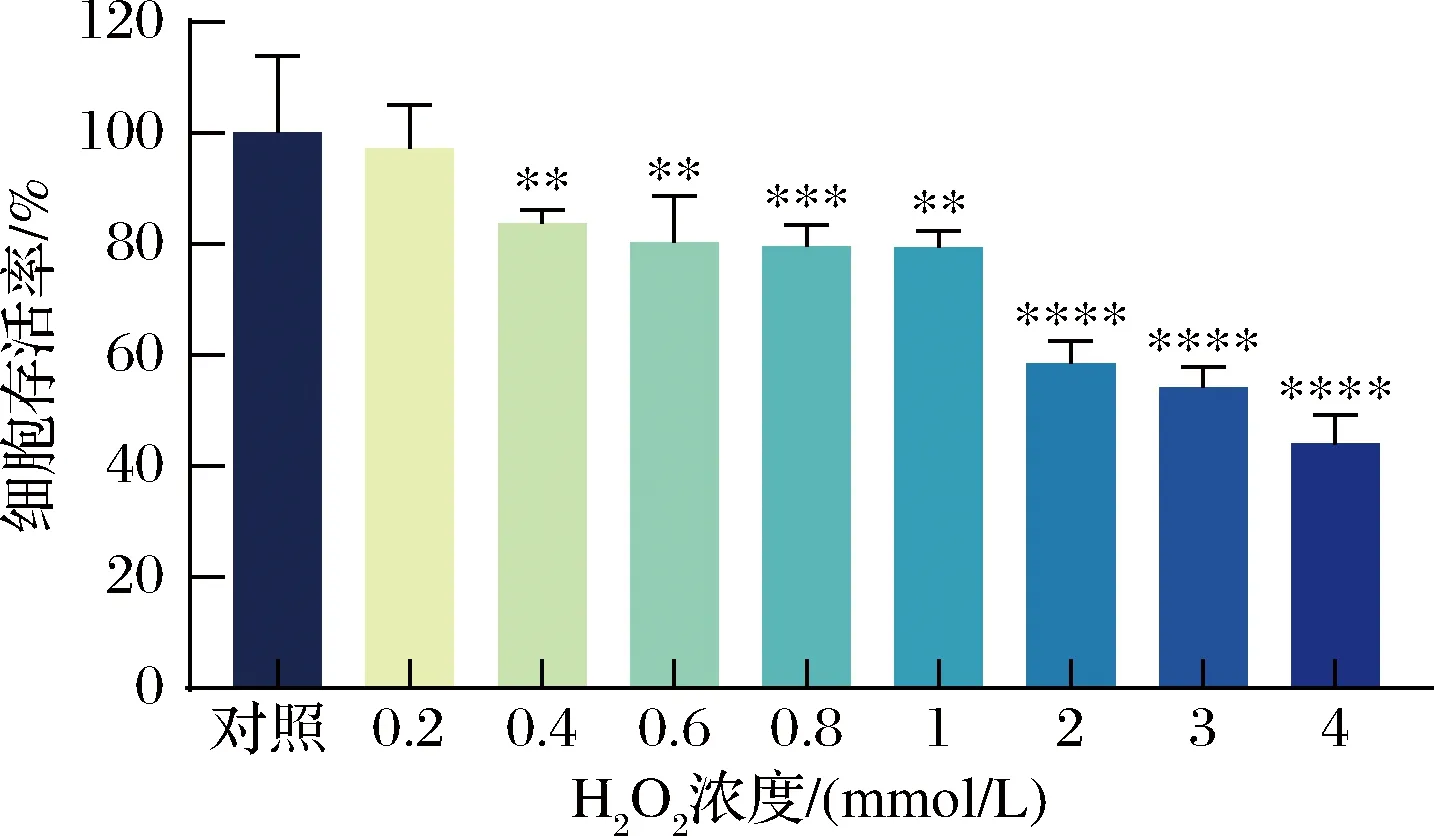
图3 H2O2诱导HaCaT细胞氧化损伤Fig.3 Oxidative damage of HaCaT cells induced by H2O2
HaCaT细胞存活率随着H2O2浓度的增加而降低。当H2O2浓度为3 mmol/L时,HaCaT细胞存活率仅为54%,与空白对照组相比具有显著性差异,因此,选取3 mmol/L的H2O2作为后续实验的造模浓度。
由图4可知,H2O2组细胞受到刺激后存活率明显下降,而给药组细胞存活率呈剂量依赖性增加,与H2O2组相比有统计学意义。以100~150 μg/mL大米发酵物提取液处理的细胞存活率几乎提高至100%。表明大米发酵物提取液可以有效保护HaCaT细胞免受H2O2刺激,具有较强抵御氧化损伤的能力。而当样品质量浓度为200 μg/mL时,细胞存活率高达125.66%,这可能与图2中显示的大米发酵物提取液本身对HaCaT细胞的促增殖作用有关。
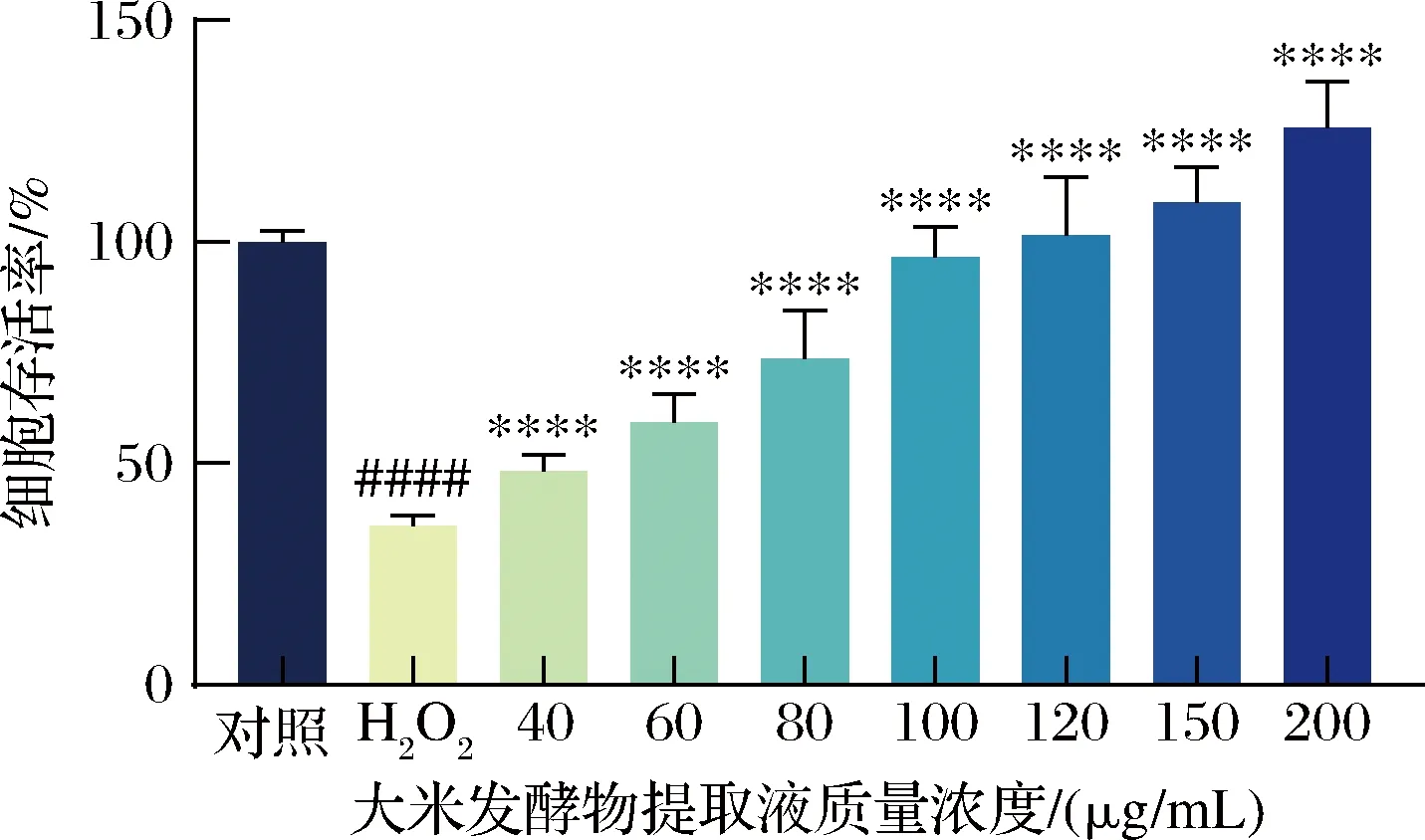
图4 大米发酵物对HaCaT细胞的保护作用Fig.4 Protective effects of rice fermentation on HaCaT cells注:与对照组相比,#P<0.05,##P<0.01,####P<0.000 1;与H2O2组相比,*P<0.05,**P<0.01,***P<0.001,****P<0.000 1。
2.4 大米发酵物提取液对细胞中MDA、SOD及GSH-Px含量的影响
当HaCaT细胞受到H2O2攻击时,细胞膜的结构和功能遭到破坏,发生脂质过氧化反应,产生大量MDA[22]。MDA具有一定毒性,通常通过测定其水平来反应细胞氧化损伤程度[23]。如图5-a所示,HaCaT细胞在未经任何处理的情况下,MDA的含量约为0.41 nmol/mg prot,经H2O2诱导后,细胞中MDA含量急剧增加,远高于对照组(P<0.001),表明其氧化损伤严重。然而,大米发酵物提取液能够降低细胞中MDA水平,以100 μg/mL提取液作用效果最为显著。由此推测大米发酵物提取液可以通过降低MDA水平,抑制促氧化剂的分泌,达到缓解氧化损伤的目的。
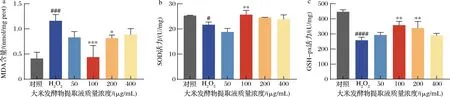
a-MDA;b-SOD;c-GSH-Px图5 HaCaT细胞中MDA、SOD、GSH-Px水平Fig.5 MDA, SOD and GSH-Px levels in HaCaT cells
GSH-Px是存在于哺乳动物中的内源性抗氧化剂,以矿物硒为基本成分,可以发挥清除H2O2、磷脂自由基的作用,避免过氧化物的干扰和攻击,并保证膜结构的完整和其正常功能[26]。H2O2组中HaCaT细胞由于受到H2O2攻击,GSH-Px含量下降至约为对照组的1/2,使得细胞无法利用其对抗氧化损伤。但经不同浓度大米发酵物提取液处理后,HaCaT细胞中GSH-Px的含量均呈一定程度的增加,100、200 μg/mL大米发酵物提取液组的作用与H2O2组相比有显著性差异。
3 结论
氧化应激是造成衰老和心血管疾病、肺水肿、恶性肿瘤等疾病的诱因[27],因此寻找安全且具有较高抗氧化活性的物质十分重要。本研究中大米发酵物在过40目筛、1∶12(g∶mL)的料液比、回流提取2 h的条件下能最大限度地保留其本身的蛋白质和总糖,有助于补充机体受氧化损伤后丢失的基础营养物质。除此之外,大米发酵物提取液的清除自由基能力及对H2O2诱导的HaCaT细胞氧化损伤的保护作用进一步体现了其抗氧化活性,表明其在皮肤氧化损伤中能发挥一定预防和修复作用,为延缓衰老和抗氧化养颜食品的开发和深入研究提供了参考。
