嗜酸乳杆菌CICC 6074 全基因组信息和高温、高盐胁迫下的转录组学分析
2023-11-26黎谢飞时淄航曹莹吴振蔡振东曾小群涂茂林潘道东
黎谢飞,时淄航,曹莹,吴振,蔡振东,曾小群,涂茂林,潘道东*
(1 宁波大学农产品质量安全危害因子与风险防控国家重点实验室 浙江宁波315211 2 宁波大学食品与药学学院 浙江省动物蛋白食品精深加工技术重点实验室 浙江宁波 315211)
乳酸菌是一类常见的益生菌,也是肠道微生物的重要组成之一[1],对于维持肠道微生物平衡具有不可或缺的作用。益生菌只有在被消费者摄入并成功在肠道内存活和定植后才能发挥益生作用,而研究发现,益生菌的活性在食用时至少应达到107CFU/g[2]。益生菌食品从生产到被消费者摄入,所承载的益生菌一直暴露在各种环境条件下,这些对益生菌的存活和保存来说都是挑战[3-4]。
在工业加工和储存过程中,益生菌对温度变化的敏感性很容易影响最佳剂量的益生菌的制备,益生菌对高温的敏感性限制其作为营养品的应用[5]。培养温度对产品发酵时代谢产物的产生也有很大的影响,比如在30 ℃或37 ℃发酵产物中,乳酸和乙酸的比值为3∶2,而在42 ℃或45 ℃孵育时,乳酸和乙酸的比值低于理论值[6]。因此生产发酵温度的选择和发酵过程中的温度控制非常重要。较高的发酵温度对发酵行业有吸引力,因为这不仅可以提高产品的发酵速率,还将大大降低高温消毒后设备的冷却时间和成本[7]。酸乳工业生产中,发酵温度一般控制在42~45 ℃,这在保证发酵效果的基础上大大节约了生产时间[8]。选择耐高温的生产菌株非常重要。江南大学Ge等[7]筛选出一株耐高温突变株干酪乳杆菌G-03(Lactobacillus casei G-03),其在41 ℃发酵条件下乳酸浓度和乳酸产量分别比对照组菌株高115.2%和97.8%。
高盐、高渗透压环境是益生菌需要挑战的环境,高盐环境下生长的益生菌的存活率及细胞结构、性质都会受到影响[9]。Piuri等[10]发现高盐环境(1 mol/L NaCl)下干酪乳杆菌ATCC 393(Lactobacillus casei ATCC 393)细胞壁的结构、性质发生变化,细胞显著大于对照组,其对诱变剂和细胞壁靶向抗生素的敏感性增加。没有暴露在渗透压下进行喷雾干燥的植物乳杆菌LPS 47(Lactobacillus plantarum LPS 47),在存活率、湿度和储存期间的稳定性方面较对照组(0.25~0.75 mol/L NaCl)有明显的改善[11]。据报道,高盐饮食会引起乳酸杆菌减少,从而改变肠道免疫稳态,导致对炎症侵袭的脆弱性增加[12-13],山东大学齐鲁医院Dong等[14]也发现高盐饮食组Wistar 大鼠肠道内容物中乳酸杆菌的数量显著降低,这表明高盐摄入量与肠道菌群组成的变化有关。德国柏林Max-Delbrück 分子医学中心一项发表在《Nature》上的研究显示,高盐摄入会影响小鼠的肠道微生物群,特别是降低鼠乳杆菌的种群数量;与这些发现一致的是,在人类的一项试验研究中,适度的高盐挑战降低了乳酸菌的肠道存活率[15]。
嗜酸乳杆菌是目前我国卫健委批准的可用于保健食品的益生菌菌种之一,被广泛添加到各种益生菌食品中充当益生菌补充剂。研究提高乳酸菌细胞对生产、储存或消化过程中发生的环境胁迫的抵抗力得到研究者的广泛关注[16]。研究乳酸菌在各种应激条件(高温、高浓度盐、胆盐、过氧化氢或低pH 值)下的生理状态和应激反应很有必要。本文采用转录组学分析方法研究嗜酸乳杆菌CICC 6074(Lactobacillus acidophilus CICC 6074)在高温和高盐环境胁迫过程中乳酸菌对环境的应激反应,探究耐受过程中微生物细胞内可能发生的生理生化反应,为后续提升嗜酸乳杆菌的抗盐、抗高温性质研究提供参考。
1 材料与方法
1.1 菌株、材料与主要试剂
嗜酸乳杆菌CICC 6074 购买自中国工业微生物菌种保藏管理中心(CICC)。乳酸菌培养基MRS肉汤和MRS 琼脂,中国海博生物技术有限公司。基因组DNA 提取试剂盒QIAGEN Genomic-tips,德国Qiagen 公司;1D 文库构建连接试剂盒SQKLSK109,英国Oxford Nanopore Technologie 公司;总RNA 提取使用TRIzol 试剂,美国赛默飞Invitrogen 公司;双链cDNA 合成试剂盒SuperScript double-stranded cDNA synthesis kit,美国赛默飞Invitrogen公司;cDNA 扩增试 剂Phusion DNA polymerase,美国NEB 公司;构建转录组测序文库构建试剂盒TruSeqTM RNA sample preparation Kit,美国Illumina 公司。
1.2 主要设备与仪器
Centrifuge5804R 高速冷冻离心机,德国Eppendorf 公司;核酸电泳仪PowerPac HC,美国Bio-Rad 公司;恒温恒湿箱HWS-250B,中国泰斯特公司;Nanodrop ND-2000,美国赛默飞公司;PromethION 测序仪,英国Oxford Nanopore Technology 公司;Illumina HiSeq X Ten 测序仪,美国Illumina 公司。
1.3 试验方法
1.3.1 乳酸菌的培养与菌体的获取 经过两代活化的嗜酸乳杆菌按体积分数2%接入新鲜的MRS液体培养基,静置培养16 h 后4 ℃条件下8 000×g离心5 min 去上清收取菌体,液氮速冻后置于-80℃暂存以备后续基因组DNA 提取试验。细菌的高温和高盐胁迫方法参照Kilstrup等[17]的方法并略作修改,经过两代活化的嗜酸乳杆菌按体积分数2%接入新鲜的MRS 液体培养基,静置培养16 h后分别在43 ℃和0.45 mol/L NaCl 条件下耐受3 h,4 ℃条件下8 000×g 离心5 min 去上清收取菌体,液氮速冻后置于-80 ℃暂存以备后续总RNA提取试验。
1.3.2 基因组DNA 与总RNA 的提取 采用QIAGEN Genomic-tips 试剂盒提取菌体基因组DNA,0.75%琼脂糖电泳检测样品是否有降解以及DNA 片段大小,Nanodrop 对DNA 进行定量,高质量的DNA 样品用于后续的建库测序;采用TRIzol法提取未胁迫对照组、高温胁迫组和高盐胁迫组的菌体总RNA,去除基因组DNA 后,用1%琼脂糖电泳和Agilent2100 生物分析仪检测总RNA 的质量,使用Nanodrop 进行RNA 定量,高质量的RNA 样品用于后续的建库。
1.3.3 建库、测序和质控 全基因组测序使用SQK-LSK109 连接试剂盒构建1D 文库,在PromethION 测序仪上进行测序。RNA 测序使用TruSeqTM RNA sample preparation Kit)进 行RNA 文库构建,在Illumina HiSeq×TenPE150 测序平台上进行双端测序。下机后的原始数据首先去除接头序列和5' 端非A、T、G、C 的碱基,然后去掉测序质量值小于Q20 的序列,再去除含N 的比例达到10%的序列,最后舍弃去掉接头序列及质量修剪后长度太小的小片段;经过质控后得到可用于后续分析的高质量序列。
1.3.4 基因组与转录组注释 基因组测序的高质量序列经Unicycler(linux-64 v0.4.8)软件组装拼接后[18],首先采用BLASTN 进行质粒分析,然后分别 用 prodigal(v2.6.3)、tRNAscan -SE -2.0和RNAmmer(v1.2)进行编码基因、tRNA 基因预测和rRNA 基因预测。采用Interproscan(v5.25-64.0)将预测得到的编码蛋白分别与COG、KEGG、GO、Refseq、Pfam 和TIGRFAMs 等6 个数据库比对进行功能注释[19]。Bowtie2(v2.3.5)软件被用来对RNA测序后得到的高质量序列进行注释[20],参考基因组序列为完成的嗜酸乳杆菌CICC 6074 基因组序列。
1.3.5 全基因组比对与转录组基因表达分析采用Geneious Prime 对嗜酸乳杆菌基因组进行基因组分析,Mauve Alignment 程序进行全基因组比对。使用RSEM(v1.3.1)进行转录本定量,FPKM 和TPM 方法衡量表达水平。转录本定量后,使用DESeq2(v1.24.0)软件进行基因表达差异分析[21]。
1.3.6 功能富集分析 使用软件Goatools(v1.1.6)进行GO 富集分析[22],KOBAS(v2.0)进 行KEGG Pathway 富集分析[23],使用Fisher 精确检验进行计算。使 用4 种多重检验方 法(Bonferroni,Holm,Sidak 和false discovery rate),对P 值进行了校正,以控制计算的假阳性率。通常情况下,当经过校正的P≤0.05 时,认为此GO 功能存在显著富集情况或者此KEGG 通路为在差异表达基因中显著富集的KEGG 通路。
2 结果与分析
2.1 全基因组拼接与注释结果
随机取100 000 条质控后的序列,利用BLASTN 将其与nt 数据进行比对,统计序列在nt库中的分布情况及比对上的物种分布,结果发现,99.58%的序列被分配到了嗜酸乳杆菌这个种的分类下面,分配到其它菌种的和分类不清晰的序列数占0.42%,说明测序结果无数据污染情况。下机原始数据经过质控和拼接步骤后,得到1 个大小为1 992 024 nt 的重叠群,测序深度为456.16,未发现质粒序列。分析后可知,得到的基因组长1 992 024 bp,是一条双链环状DNA 分子,GC 含量为34.71%,结果与NCBI 上已经完成拼接的嗜酸乳杆菌种各株的基因组信息符合。这也说明了此次的测序结果准确可靠,可用于后续的分析。根据核酸序列特征,对基因组上的基因组结构进行预测,总共得到1 864 个完整的CDS,其它基因组结构预测结果见表1。
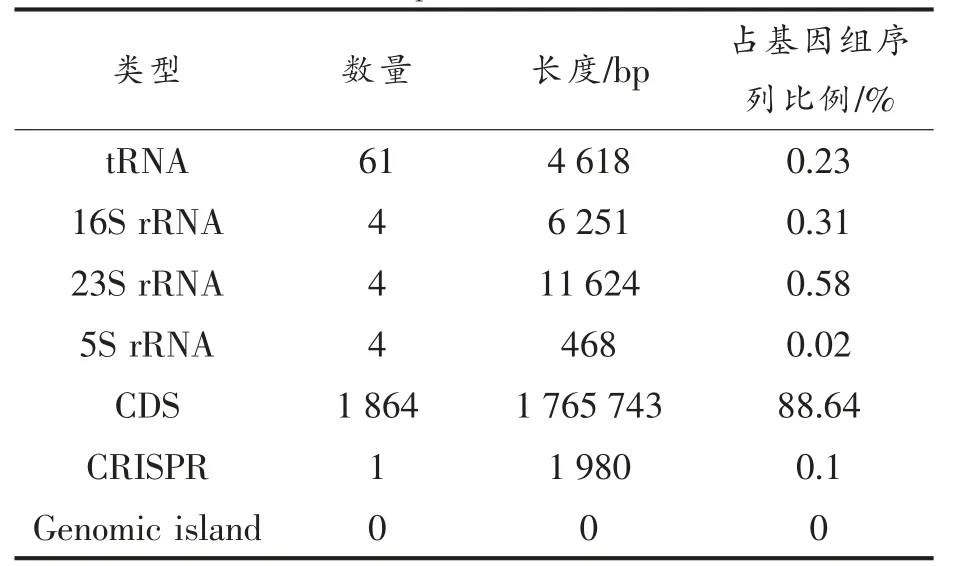
表1 嗜酸乳杆菌CICC 6074 基因组结构预测结果Table 1 Results of genome structure prediction of L.acidophilus CICC 6074
2.2 嗜酸乳杆菌CICC 6074 基因组注释结果
将基因组上预测出来的编码序列与COG、KEGG、GO、Refseq、Pfam 和TIGRFAMs 等数据 库进行比对,详细结果见表2。可以看出,单独注释到Refseq 数据库的CDS 最多为1 855 条,占总CDS 数的99.52%,注释到TIGRFAMs 数据库的CDS 最少为617 条,占总CDS 数的33.1%,能够注释到所有数据的CDS 为492 条,经过6 个数据的注释,所有的1 864 个CDS 得到了充分注释。图1展示了嗜酸乳杆菌CICC 6074 基因组中注释到COG 数据库的CDS 功能分类统计,可以看出,翻译、核糖体结构、化合物在生物体内的生物合成相关的基因数量最多为184 条,碳水化合物的转运和代谢相关的基因次之为171 条,而RNA 加工、修饰,染色质结构与动力学,细胞核结构相关的基因数最少为0,功能未知的基因也有67 条。这说明此基因组中蛋白质甚至是酶类的翻译、合成处于一个最重要的地位,能量代谢以及其它如氨基酸、核苷酸、脂类的代谢也相对重要。
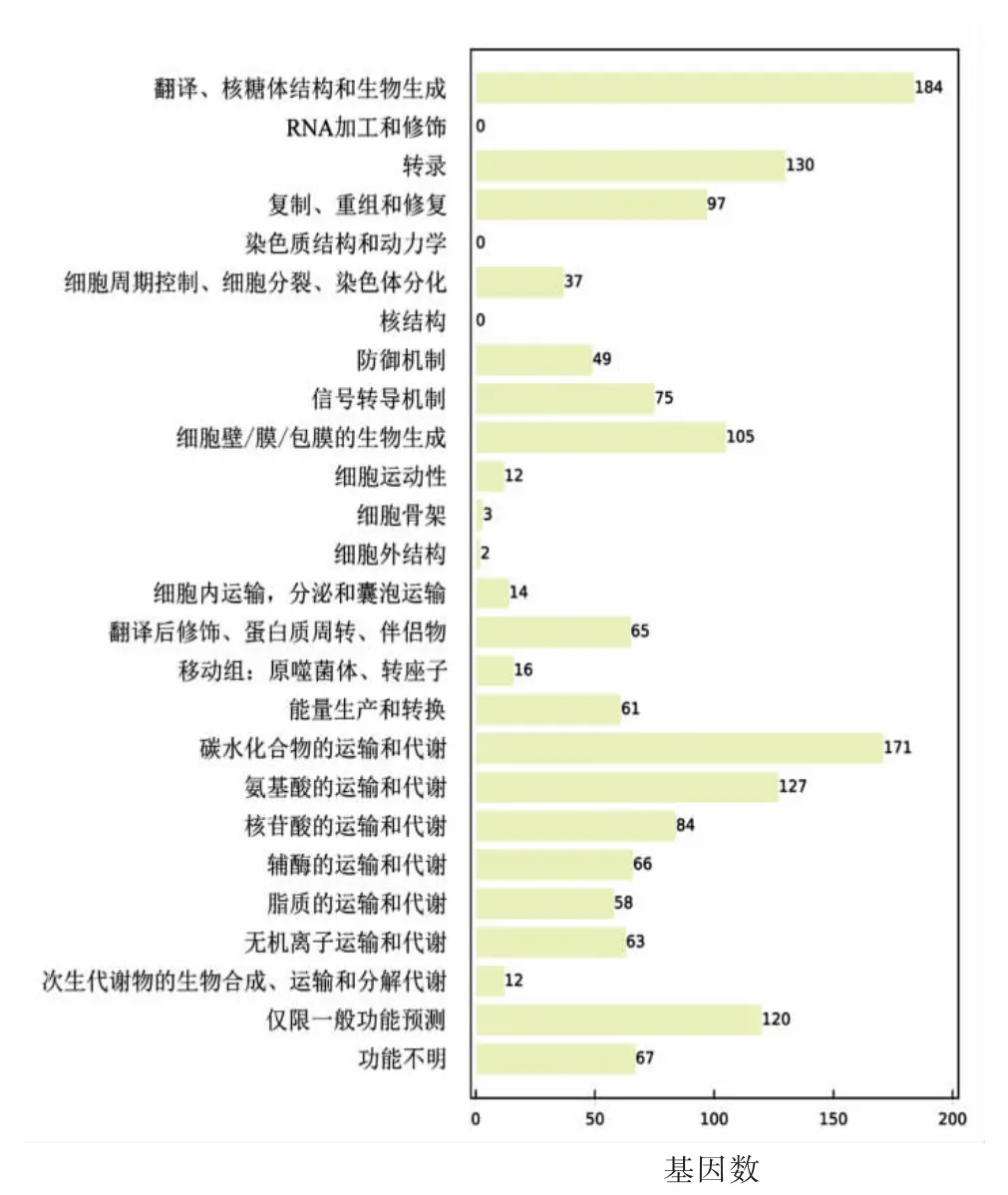
图1 基因组编码蛋白COG 功能分类统计Fig.1 Functional classification statistics of CDS in COG database

图2 嗜酸乳杆菌CICC 6074 基因组圈图Fig.2 Genome circle map of L.acidophilus CICC 6074

表2 基因组编码蛋白功能注释统计表Table 2 Statistical table of functional annotation of CDS
2.3 全基因组草图绘制与比对
将基因组测序深度、GC 分布、GC-skew 以及基因组结构注释进行整合,使用Circos(v0.69)绘制全基因组圈图。如图3 所示,由外到内依次为正义链编码基因、负义链编码基因、tRNA 基因(橙色)和rRNA 基因(紫色)、CRISPR 序列(蓝色)和基因岛序列(绿色)、GC 比、GC-skew 与测序深度。
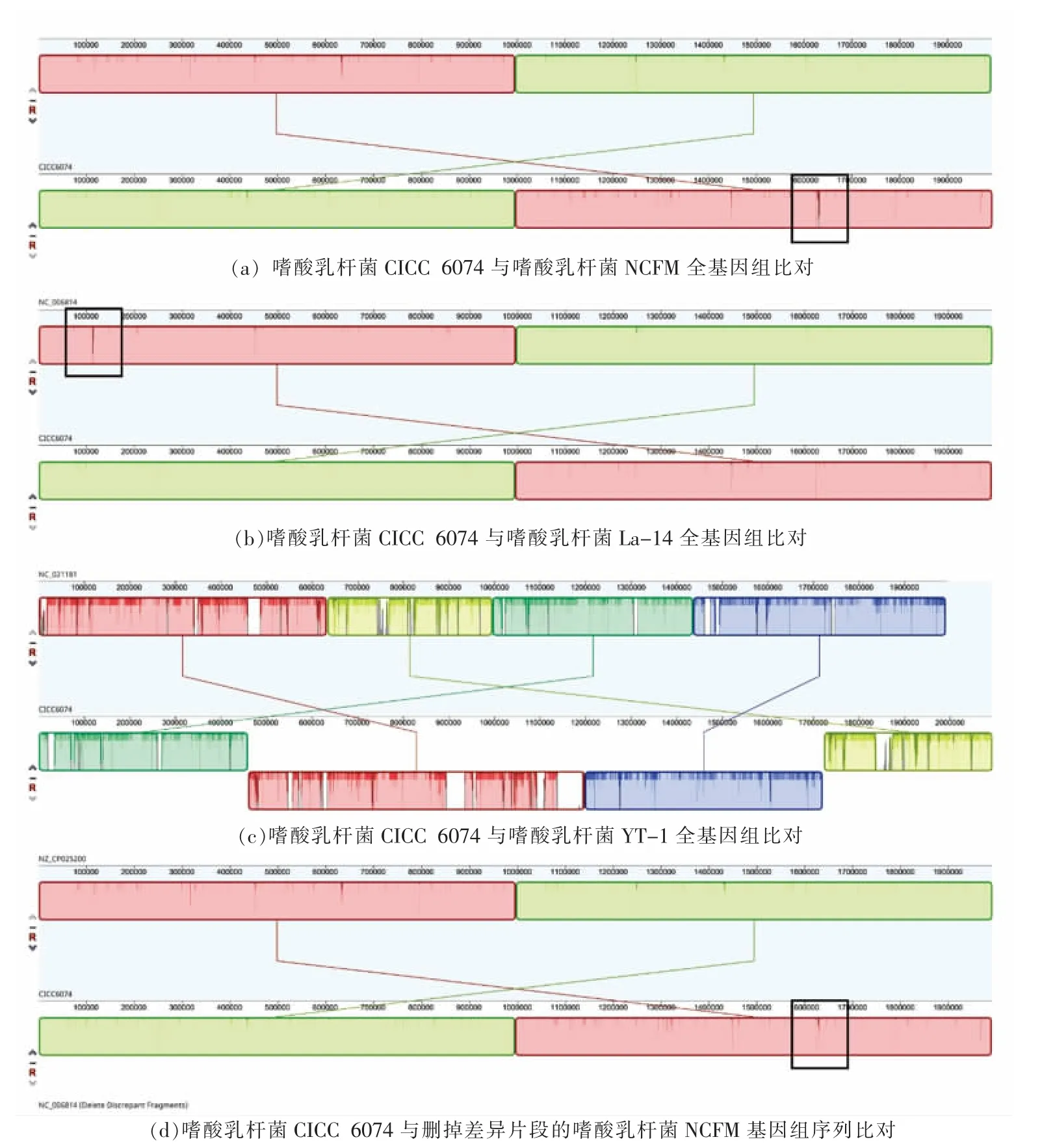
图3 嗜酸乳杆菌CICC 6074 与其它株嗜酸乳杆菌全基因比对Fig.3 Whole genome alignment of L.acidophilus CICC 6074 with other strains of L.acidophilus
以“Lactobacillus acidophilus” 为关键词在NCBI 上的Genome 数据库里搜索,发现嗜酸乳杆菌的基因组信息有61 条,有9 条完成了拼接,其余的为重叠群或者基因组骨架。完成拼接的9 条完整基因组中,长度分布范围为1.99 Mb 到2.09 Mb,包含的CDS 数为1 756 个到1 867 个不等(数据截至2021 年12 月,NCBI 上Genome 数据库信息,https://www.ncbi.nlm.nih.gov/genome/browse/#!/prokaryotes/1099/)。可知,嗜酸乳杆菌不同株的基因组间存在一定的差异性。采用Mauve Alignment程序进行全基因组序列比对,结果如图3 所示,图3a、3b、3c 分别为嗜酸乳杆菌CICC 6074 的基因组与嗜酸乳杆菌NCFM(NC_006814)、嗜酸乳杆菌La-14(NC_021181)和嗜酸 乳杆菌 YT1(NZ_CP025200)基因组 比对的 结果。可 知,NC_006814、NC_021181 与嗜酸 乳杆菌 CICC 6074 基因组的相似度比NZ_CP025200 与嗜酸乳杆菌CICC 6074 基因组的相似度高。经分析,删掉NC_006814 中16SrRNA 基因(163 426~1 632 698)和23S rRNA 基因(1 630 941~1 628 035)的间隔区比嗜酸乳杆菌CICC 6074 基因组中16SrRNA基因(637135~635577)和23S rRNA 基因(635372~632 467)的间隔区多出的1 536 对碱基后,两个基因组的相似度最高(图3d)。除了主要来自于两对23SrRNA 基因(相似性分别为99.3%和96.1%)、一对transposase 基因(相似性为97.5%)、一对16SrRNA 基因(相似性为99.2%)的序列差异,其它CDS 的分布位置与序列基本一致。
2.4 转录组测序结果注释与表达量分析
将经过质控和拼接后的RNA 序列与对照基因组的序列进行比对注释,并对注释情况进行统计。基于表达矩阵,进行样本间Venn,PCA 分析,获取组间的共表达和特表达基因。图4a 可以看出,对照组检测出了1 704 个表达基因,热胁迫组和盐胁迫组分别检测出了1 805 和1 713 个表达基因,其中3 组共表达的基因有1 677 个,热胁迫组特异表达的基因有74 个,盐胁迫组有1 个。PCA 分析发现,图4b 中PC1 的贡献度为69.16%,PC2 的贡献度为17.48%,3 组样品能够较好的分别聚集到一起,组间差异明显。结果表明,在不同胁迫环境中,嗜酸乳杆菌CICC 6074 的基因表达谱会发生不同程度的变化,在高温胁迫时乳酸菌细胞内表达的基因数量明显上升,而在高盐胁迫的环境中则上升的不多。说明在面对高温胁迫时,嗜酸乳杆菌的细胞可能会做出更多的应激反应。
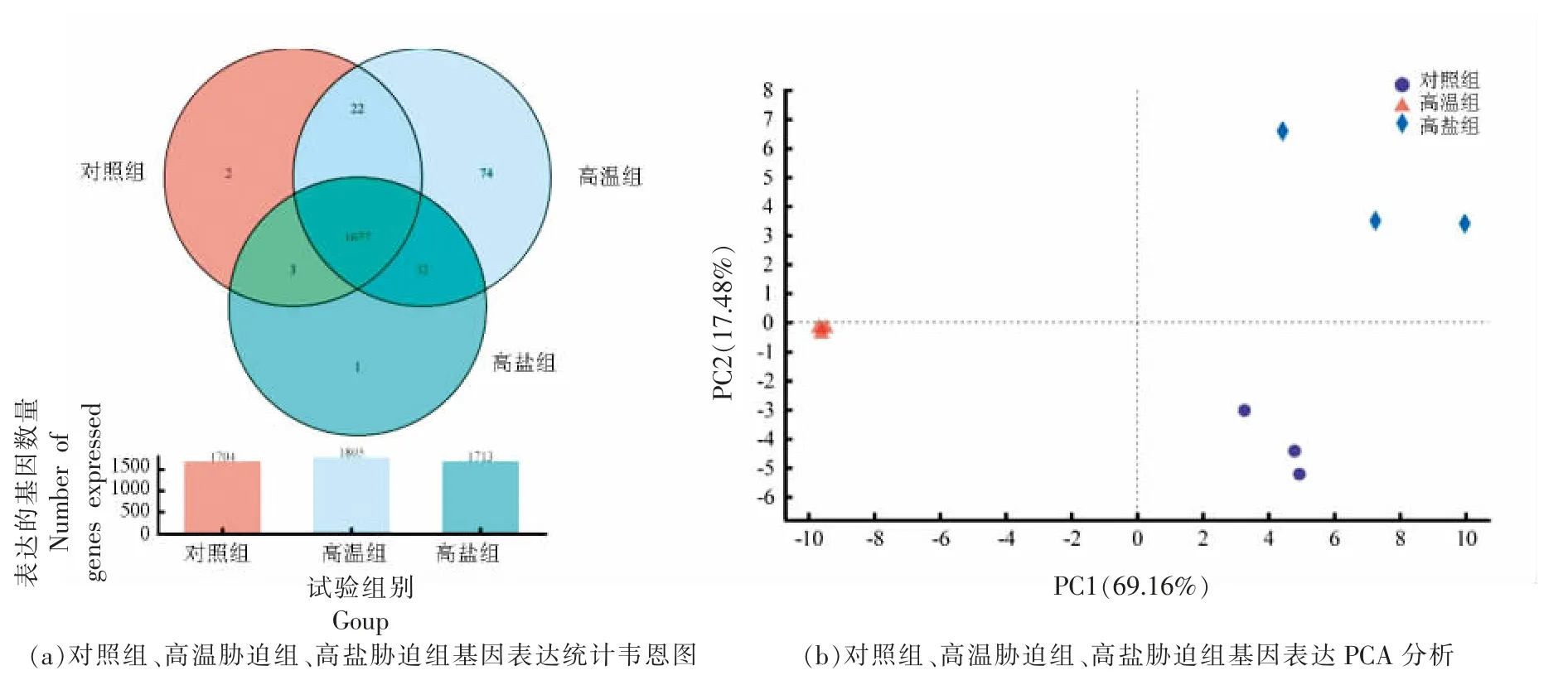
图4 转录组基因表达量分析Fig.4 Gene expression analysis of transcriptome
2.5 转录组基因差异表达分析
图5 表达量差异火山图显示了不同组间转录组基因的差异表达情况,横坐标为不同基因在两组样本间表达差异的倍数变化值,纵坐标为基因表达量变化差异的统计学检验值,图中红色圆点、绿色圆点和灰色圆点分别表示显著上调、显著下调和非显著差异的基因。可知在热胁迫组,总共检测到1 790 个差异表达基因,其中1 277 个有差异但不显著,513 个有显著性差异;显著上调305个,显著下调208 个。在盐胁迫组中总共检测到1 654 个差异表达基因,相较对照组来说,其中1 494 个有差异但不显著,161 个有显著性差异;显著上调81 个,显著下调80 个。在Zhang等[24]的研究中,高温胁迫下的鼠李糖乳杆菌hsryfm 1301的转录组中有242 个基因表达上调,320 个基因表达下调,Zhao等[25]的文章中盐胁迫下植物乳杆菌KLDS1.0391 的转录组中有260 个基因表达差异显著,其中159 个基因表达显著上调,101 个基因表达显著下调。这些结果与本研究相似,也说明了在面对高温胁迫时嗜酸乳杆菌的细胞可能会做出更多的应激反应。一个有意思的现象是,在热应激时,嗜酸乳杆菌的α-半乳糖苷酶较对照组有83.32 倍的上调,这或许对嗜酸乳杆菌在食品生产或者饲料生产上有着巨大的应用价值[26-27]。
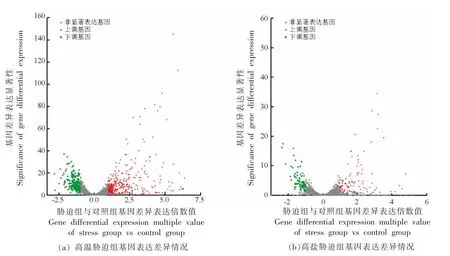
图5 表达量差异火山图Fig.5 Differential expression volcano map
2.6 功能富集分析
对差异表达基因集中的基因进行GO 富集和KEGG 富集分析,结果如图6 所示。图6a 和图6b展示了热胁迫组、盐胁迫组分别与对照组的差异表达基因GO 功能富集分析结果,可以看出,热胁迫组与对照组的差异表达基因主要富集于氨基酸、硫胺素、有机酸及tRNA 相关的生物学过程,而盐胁迫组与对照组的差异表达基因主要富集于脱氧核糖核苷酸、嘧啶脱氧核糖核苷酸合成与代谢,肽跨膜转运酶活性,肽转运酶活性,酰胺跨膜转运酶活性等生物过程。图6c 和图6d 展示了热胁迫组、盐胁迫组分别与对照组的差异表达基因KEGG 功能富集分析结果,在热胁迫组中碳水化合物代谢、翻译、膜运输、氨基酸代谢、核苷酸的代谢等代谢通路富集的基因相对较多,而在盐胁迫组中核苷酸代谢、膜运输、碳水化合物代谢、氨基酸代谢和细胞群体感应或者生物膜形成等代谢通路富集的基因相对较多。这同样证明了上文的陈述,两组胁迫条件下细胞的应激反应是不同的。

图6 转录组功能富集分析Fig.6 Functional enrichment analysis of transcriptome
Chen等[6]和Ge等[7]的研究说明了高温处理会影响乳酸菌的有机酸代谢,这与我们的结果有一定的一致性,而López-Bucio等[28]也说明了有机酸代谢在细胞水平上对多种生物化学途径(包括能量生产、氨基酸生物合成前体的形成)以及对环境的适应具有重要意义。在高温下培养细胞会抑制蛋白质的合成,而持续热胁迫也会导致细胞对于环境的适应,也就是蛋白质合成的逐渐恢复[29],这说明为了帮助细胞适应热胁迫,会有大量的翻译调控过程参与进来。细胞对盐胁迫的反应是通过渗透液的合成、K+的吸收和Na+在质膜上的外排[30],说明了膜运输对细胞适应盐胁迫环境的重要性,我们的结果中高盐胁迫下嗜酸乳杆菌的转录组中膜运输的生物过程明显增多。在Fu等[31]的研究中,氨基酸代谢、碳水化合物代谢、能量代谢、膜转运、调控功能和细胞信号转导等变化对海藻希瓦氏菌的高盐响应具有重要意义,而Conde等[32]也描述了糖醇代谢可能在高盐胁迫下受到调节,功能富集分析发现在高盐胁迫时乳酸菌的糖醇代谢增强。
3 结论
嗜酸乳杆菌CICC 6074 的基因组长1 992 024 bp,是一条双链环状DNA分子,GC 含量为34.71%,总共预测出来1 864 个基因,与已经发表的嗜酸乳杆菌的基因组相似度极高,遗传信息基本一致。高温和高盐两种胁迫条件下嗜酸乳杆菌的转录组与对照组产生了一定的差异性,分析发现,在面对高温胁迫时,嗜酸乳杆菌的细胞可能会做出更多的应激反应。功能富集分析的结果表明,在高温胁迫时,嗜酸乳杆菌可能主要通过增强有机酸的代谢和翻译调控过程来提升细胞对环境的适应性;而在高盐胁迫时,则主要通过增强糖醇类代谢和增强膜运输来提升生存能力。
