未漂洗鱼糜冻藏过程中晚期糖化终末产物形成及机制
2023-11-26李佳艺苏婕王发祥李向红俞健刘永乐
李佳艺,苏婕,王发祥*,李向红,俞健,刘永乐
(1 长沙理工大学食品与生物工程学院 湖南省水生资源食品加工工程技术研究中心 长沙410114 2 山东华宇工学院 山东德州 253034)
鱼糜是一种基于鱼肉凝胶的精加工鱼类产品,由于营养好、味道鲜美、成本低和易于生产、储存和运输等特点,因此在世界各地深受欢迎[1]。漂洗是传统鱼糜加工技术的重要工序,通过漂洗纯化和浓缩鱼肌纤维蛋白,使其具有良好的凝胶形成能力[2]。同时漂洗还可去除多余的脂肪、血液和色素,从而提高鱼糜的感官质量,并减缓其氧化劣变[3]。然而,漂洗过程不仅带来额外的水消耗和废物处理问题,还导致营养和风味物质的巨大损失[4]。此外,漂洗过程中丢失的水溶性蛋白质对延缓鱼糜冷冻收缩和蛋白质交联具有重要作用[5]。为解决这些问题,研究未漂洗鱼糜成为一个替代方案,然而其加工技术目前在基础理论研究和实际应用中仍存在诸多问题,如凝胶形成能力较差,贮藏过程中易氧化劣变、潜在危害物形成等[6],有待进一步研究解决。
近年来,随着淡水鱼养殖产量的增加以及海洋渔业资源的不断减少,淡水鱼逐渐成为鱼糜加工的主要原料之一。鲢鱼价格低廉,每年养殖产量约400 万t,是最典型的大宗低值淡水鱼,加工成鱼糜是其最有竞争力的利用途径[7]。利用鲢鱼为原料加工未漂洗鱼糜已有一些研究报道,主要集中在其制作工艺[8]、凝胶增强技术[9]、抗冻和抗氧化[10]等方面,而关于其加工和冻藏过程中潜在危害物的形成规律的研究比较缺乏。
晚期糖化终末产物(advanced glycation endproducts,AGEs)是一组广泛存在于肉类食品的潜在危害物质,长期摄入会对人体产生伤害,增加多种慢性疾病的发生率[11]。食品中AGEs 形成的途径和影响因素复杂,主要在美拉德反应的初期和末期通过多种途径产生,也与食品中蛋白质、脂肪等组分的氧化反应有关[12]。AGEs 种类多样,其中Nε-羧甲基 赖氨酸(Nε-carboxymethylysine,CML)、Nε-羧乙基赖氨酸(Nε-carboxyethylysine,CEL)被认为是最典型的两种AGEs。未漂洗鲢鱼鱼糜中含有丰富的蛋白质和不饱和脂肪酸,其在斩拌、加热和冻藏过程中易发生氧化等化学反应[13],十分有利于AGEs 的形成。然而,尽管存在高AGEs 含量的潜在安全隐患,目前关于未漂洗鱼糜产品AGEs 的基础研究还十分薄弱,尤其是有关冻藏温度和冻藏过程对AGEs 形成的影响研究接近空白。本研究探讨不同温度(-18,-60 ℃)下未漂洗鲢鱼鱼糜冻藏过程中AGEs 含量与其蛋白质、脂肪氧化的关系,揭示AGEs 的形成机制。
1 材料与方法
1.1 材料与试剂
新鲜鲢鱼:购于长沙本地菜市场,每尾重(2.0±0.2)kg。
d4-CML 和d4-CEL 标样(纯度>98%),购自加拿大TRC 公司;氯化钠、三氯乙酸、EDTA、2,4-二硝基苯肼(DNPH)、5,5′-二硫代双(2-硝基苯甲酸)(DTNB)、2-硫代巴比妥酸(TBA)、盐酸胍均为国产分析纯。
1.2 仪器与设备
ZB-20 型斩拌机,山东省诸城市华钢机械有限公司;TU-1901 紫外可见分光光度计,北京普析通用仪器有限责任公司;T10-BASIC 手持式均质机,德国IKA 仪器有限公司;Altus A-30 UPLC 色谱仪和Qtrap 4500 三重四级杆质谱仪,德国PerkinElmer 公司。
1.3 试验方法
1.3.1 未漂洗生鱼糜样品制备 参考暴伊芮等[14]的方法,将新鲜鲢鱼宰杀后采背部肌肉,放入斩拌机中于0~4 ℃条件下预斩1 min,按每100 g 鱼肉加入2.5 g 食盐继续斩拌5 min,即为生鱼糜。将生鱼糜分装于若干带盖塑料盒中,每盒25 g,分别置于-18 ℃和-60 ℃冰箱冻藏,在第0,15,30,45,60 d 取出,于4 ℃解冻12 h 进行后续试验。
1.3.2 未漂洗熟鱼糜样品制备 生鱼糜样品解冻后,称取12.5 g 置于特制铝盒中,加盖密封后于90 ℃水浴加热30 min,立即取出后冰水冷却15 min,即为熟鱼糜样品。
1.3.3 AGEs 含量测定 生/熟鱼糜样品中的两种AGEs(CML 和CEL)参照Niu等[15]的方法提取和HPLC-MS/MS 分析。不同冻藏周期的鱼糜样品真空干燥成粉末,取一定量用0.2 mol/L 的硼酸缓冲液(pH 9.2)和2 mol/L 的硼氢化钠还原8 h,然后与甲醇-氯仿(体积比2∶1)混合,离心脱脂沉淀蛋白质。在沉淀中加入6 mol/L HCl,110 ℃水解24 h,水解液稀释后加入内标(d4-CML 和d4-CEL),真空干燥后以超纯水重悬浮,SPE 固相萃取纯化,洗脱液在60 ℃下氮吹干燥,并溶解在80%甲醇水溶液中;最后经0.22 μm 膜过滤后进行HPLC-MS/MS 分析[15],最终含量换算为每kg 鱼糜湿重中CML 和CEL 的含量。
1.3.4 鱼糜蛋白质样品制备 参照Shen等[16]的方法,称取2 g 解冻后生鱼糜样品,加入40 mL 磷酸缓冲液(pH 为7.0,含0.5 mol/L NaCl-15.6 mmol/L NaH2PO4),充分匀浆后于4 ℃静置提取1 h,4℃、6 000 r/min 离心10 min,上清液即为鱼糜蛋白质提取液,以福林酚试剂法测定其蛋白含量。
1.3.5 蛋白质羰基含量测定 羰基含量参照Pan等[17]的方法以DNPH 法测定。
1.3.6 Ca2+-ATPase 活性测定 参照Benjakul等[18]的方法,取2 mL 的鱼糜蛋白样品与0.5 mL Tris-HCl 缓冲液(0.5 mol/L,pH 7.0),8 mL CaCl2溶液(10 mmol/L)和0.5 mL ATP(20 mmol/L,pH 7.0)反应8 min;立即加入5 mL 15%三氯乙酸(TCA,4℃)终止反应,混合物以6 000 r/min 离心5 min,通过钼酸铵比色法测量上清液中的无机磷含量。
1.3.7 总巯基和活性巯基的测定 采用Ellman's试剂法,参照Olver等[19]的方法稍作修改。0.5 mL鱼糜蛋白样品与2.5 mL Tris-Gly 缓冲液(0.086 mol/L Tris、0.09 mol/L 甘氨酸、8 mol/L尿素、4 mmol/L EDTA,pH 8.0)和0.02 mL DTNB 混合,25℃下保温1 h 后,在412 nm 处测定溶液吸光度,使用13 600 L/mol/cm 的消光系数计算总巯基含量;测定活性巯基时Tris-Gly 缓冲液除不含8 mol/L尿素外,其余操作与总巯基测定相同。
1.3.8 硫代巴比妥酸(TBA 值)的测定 生/熟鱼糜样品中的脂肪氧化情况以TBA 监测,TBA 值参照Witte等[20]的方法测定,以每克鱼糜样品中丙二醛(MDA)的毫克数表示。
1.4 数据处理
所有试验均重复3 次,试验结果以平均值±标准差来表示,使用SPSS 23 软件进行方差分析和Pearson 相关性分析,均值在α=0.05 水平进行显著性检验。
2 结果分析
2.1 冻藏过程对鱼糜AGEs 形成的影响
CML 和CEL 是食品中最典型的两种AGEs,鱼糜中在不同温度下冻藏及热处理后CML 和CEL 的含量变化如图1 所示。可见,无论是在常规温度(-18 ℃)还是超低温(-60 ℃)冻藏,两种AGEs 的含量均随着冻藏时间的延长而显著增加(P<0.05),说明冻藏过程对鱼糜中AGEs 的形成有较大影响。研究表明,食品中AGEs 主要是在美拉德反应过程中形成的,而脂肪氧化、蛋白质氧化等反应也会产生AGEs 的前体物,如具有很强活性的乙二醛和丙酮醛[29],这些α-二羰基前体物与游离氨基酸或蛋白质以共价键形式结合,形成游离态或结合态AGEs(如CML、CEL 等)[21]。在相同冻藏周期,-18 ℃冻藏组样品中的CML 和CEL 含量均明显高于-60 ℃冻藏组,如生鱼糜在-18 ℃冻藏60 d 后,CML 和CEL 的含量分别由12.53 mg/kg和5.78 mg/kg 增加至21.51 mg/kg 和10.88 mg/kg,显著高于-60 ℃冻藏组的20.0 mg/kg 和9.37 mg/kg。这可能是因为在-18 ℃冻藏过程中发生了更多的蛋白质变性和脂质氧化,从而促进了AGEs 形成,在其它食品的研究中也有类似的结果[22]。
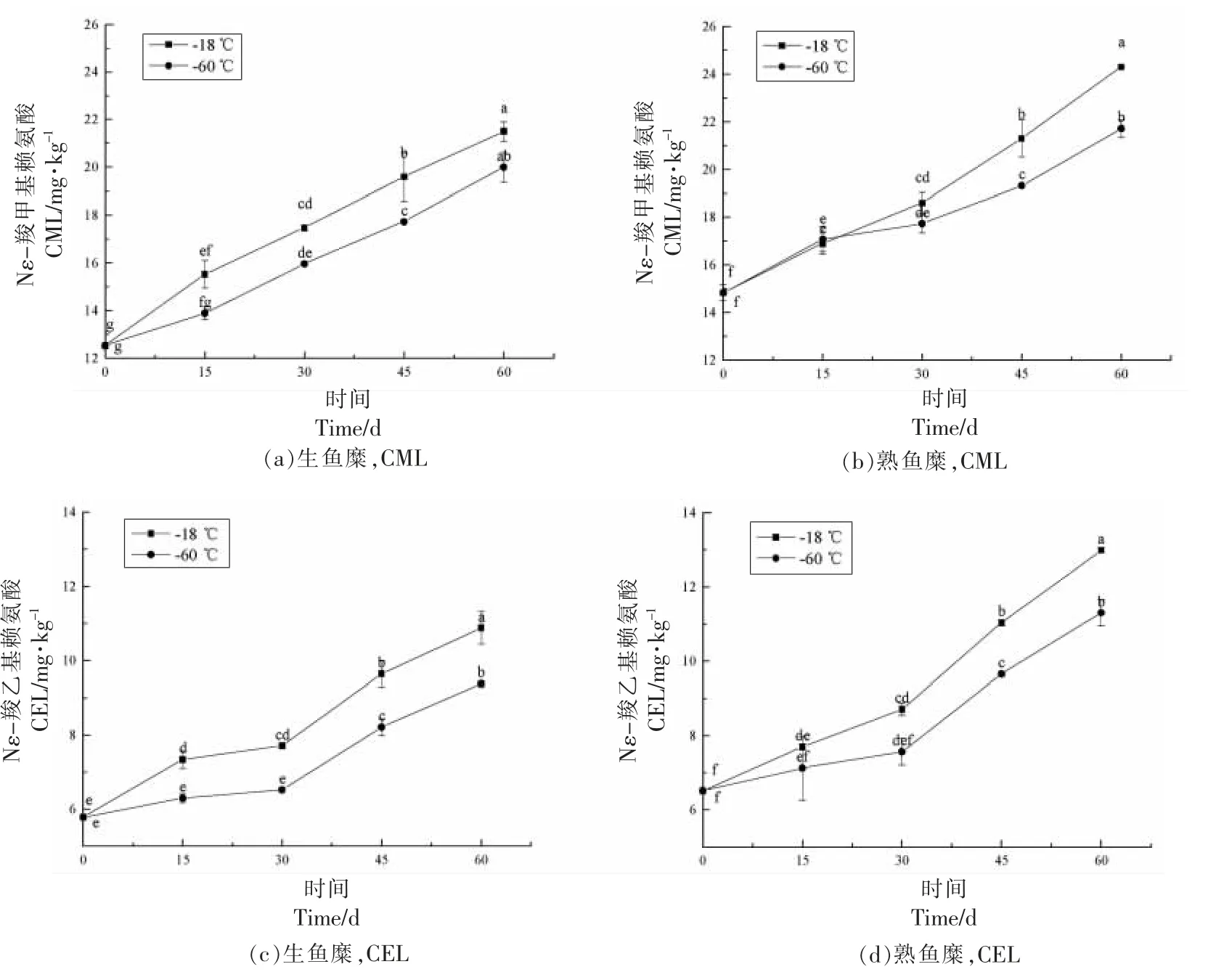
图1 不同冻藏温度下冻藏过程中未漂洗鱼糜中CML 和CEL 的变化Fig.1 Changes in the content of CML and CEL of unwashed surimi during frozen storage at different freezing temperatures
此外,熟鱼糜样品中CML 和CEL 含量随冻藏时间的变化趋势与生鱼糜样品一致,但其含量分别达到14.83~24.31 mg/kg 和6.52~12.99 mg/kg,较其相应的生鱼糜样品增加了约1.05~1.23 倍,表明热处理促进了鱼糜中AGEs 的生成。这与Niu等[15]的研究结果相似。在高温条件下,鱼糜中的美拉德反应、蛋白质和脂质氧化反应加速,促进了活性前体物质的生成,从而增加了AGEs 的含量[23-24]。
2.2 冻藏过程对鱼糜脂肪氧化影响
未漂洗鱼糜中含有较高含量的不饱和脂肪酸,在加热和贮藏过程中易发生氧化反应。TBA 值反映了脂质氧化过氧化物降解产物丙二醛(MDA)的水平,是表征食品脂肪氧化程度的常用指标[25],未漂洗鱼糜样品在冻藏过程中TBA 值的变化如图2 所示。随着冻藏时间的延长,生鱼糜样品的TBA 值均呈现先增加后降低的趋势,这与蔡秋杏等[26]研究厦门白姑鱼腌制加工过程中TBA 值的变化趋势类似。冻藏前期TBA 值上升主要是因为鱼糜冻藏过程中脂肪氧化程度不断加剧导致产生了更多的氢过氧化物降解产物(如MDA);-18 ℃冻藏组样品的TBA 值显著高于-60 ℃冻藏组,说明超低温冻藏可以有效抑制脂质氧化,与武华等[27]的研究结论一致。冻藏后期TBA 值下降可能是由于鱼糜中脂肪氧化速率接近峰值但其次级氧化产物醛、酮类物质进一步降解成了挥发性物质[28],也可能是醛类与鱼糜中其它成分(如蛋白质)结合导致其与TBA 反应的量减少[29]。熟鱼糜样品的TBA 值变化趋势与生鱼糜一致,但全部-60 ℃冻藏组以及-18 ℃冻藏组30 d 前样品的TBA 值明显高于其对应的生鱼糜样品,说明热处理促进了鱼糜中的脂肪氧化反应,这与李晓燕等[30]的研究结果相符。
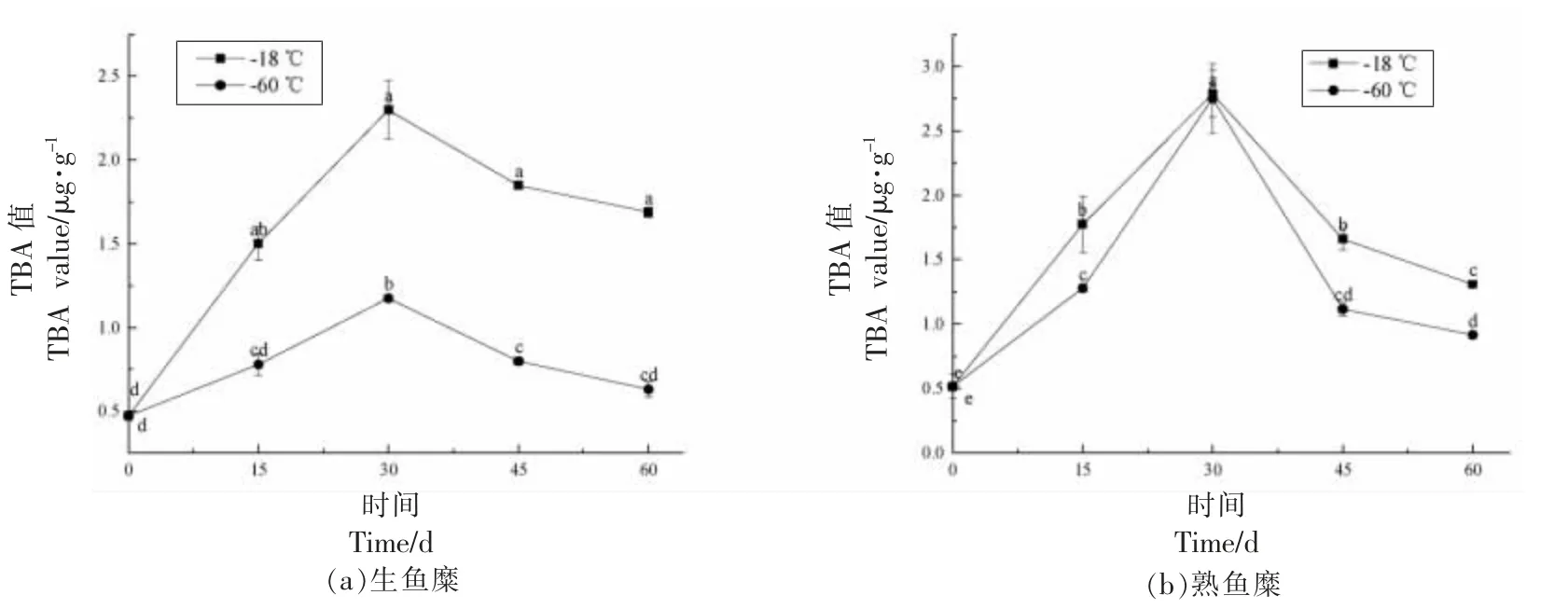
图2 不同冻藏温度下冻藏过程中未漂洗鱼糜中TBA 值的变化Fig.2 Changes in the TBA value of unwashed surimi during frozen storage at different freezing temperatures
2.3 冻藏过程中鱼糜蛋白质羰基含量的变化
蛋白羰基含量是蛋白质氧化损伤的敏感指标,羰基的形成是蛋白质分子被机体产生的氧自由基修饰的重要产物,是判断蛋白质氧化程度的重要指标之一[31]。生鱼糜冻藏过程中蛋白质羰基含量的变化如图3 所示。可见,无论在-18 ℃还是-60 ℃条件下冻藏,鱼糜蛋白质羰基含量均随冻藏时间增加而显著上升(P<0.05),表明冻藏过程中鱼糜蛋白质持续发生了不同程度的氧化。在相同的冻藏周期,-18 ℃冻藏组样品的羰基含量均高于-60 ℃组,表明冻藏温度也对鱼糜蛋白质氧化有重要影响,超低温冻藏能一定程度上抑制蛋白质氧化,这可能是由于传统冻藏温度(-18 ℃)诱导了更多的蛋白质变性或去折叠[32],与-60 ℃相比更有利于形成席夫碱等反应,从而使胺与羰基之间的反应速度更快[33]。

图3 不同冻藏温度下冻藏过程中未漂洗鱼糜蛋白质羰基含量的变化Fig.3 Changes in the protein carbonyl content of unwashed surimi during frozen storage at different freezing temperatures
2.4 冻藏过程中鱼糜蛋白质Ca2+-ATPase 活性的变化
Ca2+-ATPase 活性通常可作为蛋白质分子完整性的指标,其活性下降被视为是肌球蛋白头部巯基氧化和蛋白交联引起的蛋白质变性[7]。由图4可知,两种冻藏温度下的鱼糜蛋白质Ca2+-ATPase活性均随冻藏时间的延长呈下降趋势,表明冻藏过程中蛋白质变性程度不断增加;鱼糜在-18 ℃冻藏条件 下15 d,Ca2+-ATPase 活性为0.040 μmol Pi/mg/min,较第0 天样品(0.129 μmol Pi/mg/min)显著下降了69.0%,而-60 ℃组样品仍为0.125 μmol Pi/mg/min,变化不显著;冻藏60 d 后,-18 ℃冻藏组样品的Ca2+-ATPase 活性降低了84.9%至0.019 μmol Pi/mg/min,而-60 ℃组(0.093 μmol Pi/mg/min)仅降低了27.9%。说明-18 ℃冻藏条件下鱼糜蛋白质发生了较多的变性或去折叠[34],从而更容易被氧化,这与其羰基含量检测的结果一致(图3)。柴智等[35]研究也发现鳜鱼在不同冻藏温度下冻藏过程中Ca2+-ATPase 活性逐渐降低,且冻藏温度越高,下降趋势越明显。
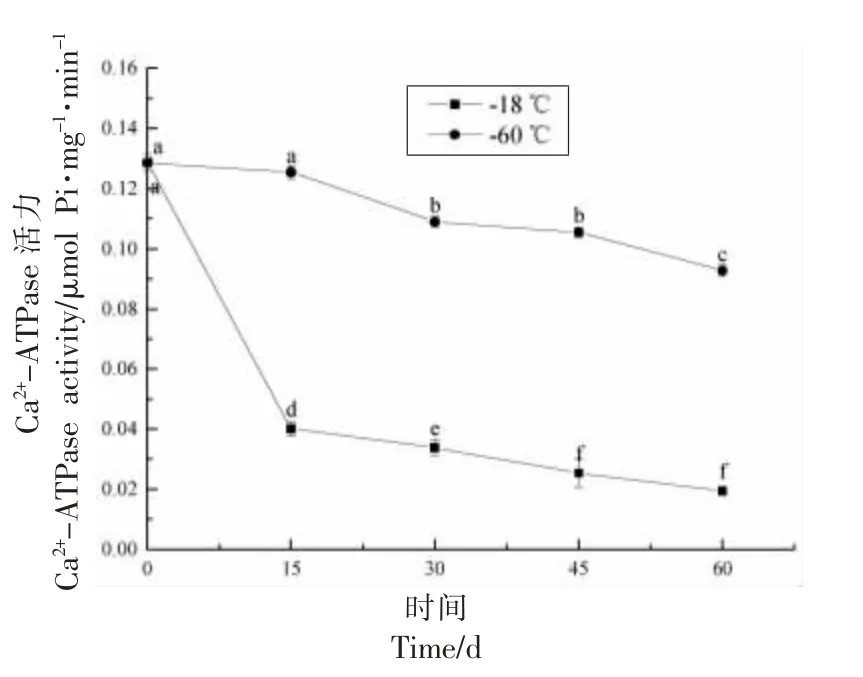
图4 不同冻藏温度下冻藏过程中未漂洗鱼糜蛋白质Ca2+-ATPase 活性的变化Fig.4 Changes in Ca2+-ATPase activity of unwashed surimi during frozen storage at different freezing temperatures
2.5 冻藏过程中鱼糜蛋白质巯基含量的变化
肌肉食品中蛋白质氧化的另一个标志是SH基团的丢失,因为它们很容易通过脱氢形成二硫键。由图5 可知,随着冻藏时间的延长,鱼糜蛋白质的总巯基含量呈下降趋势,而活性巯基含量呈上升趋势。活性巯基含量上升可能是因为冻藏过程中蛋白质变性和去折叠导致原来包埋在分子内部的巯基暴露出来,而总巯基含量下降则可能是因为活性巯基对氧化反应敏感,导致形成了分子内或分子间二硫键[22];有研究表明,肌红蛋白氧化、脂肪氧化和冰晶形成对组织的损伤是巯基向二硫键转化的重要原因[36]。冻藏60 d 后,-60 ℃冻藏组样品的活性巯基和总巯基含量分别较第0 天时(28.5 μmol/g)上升和下降了21.5%和10.0%,显著低于-18 ℃冻藏组的38.3%和21.9%(P<0.05),说明-60 ℃冻藏对鱼糜蛋白质巯基变化影响较小,可能是因为超低温条件下产生的冰晶较小,对鱼糜蛋白质的空间结构的破坏较小,从而减轻了其变性和氧化程度。
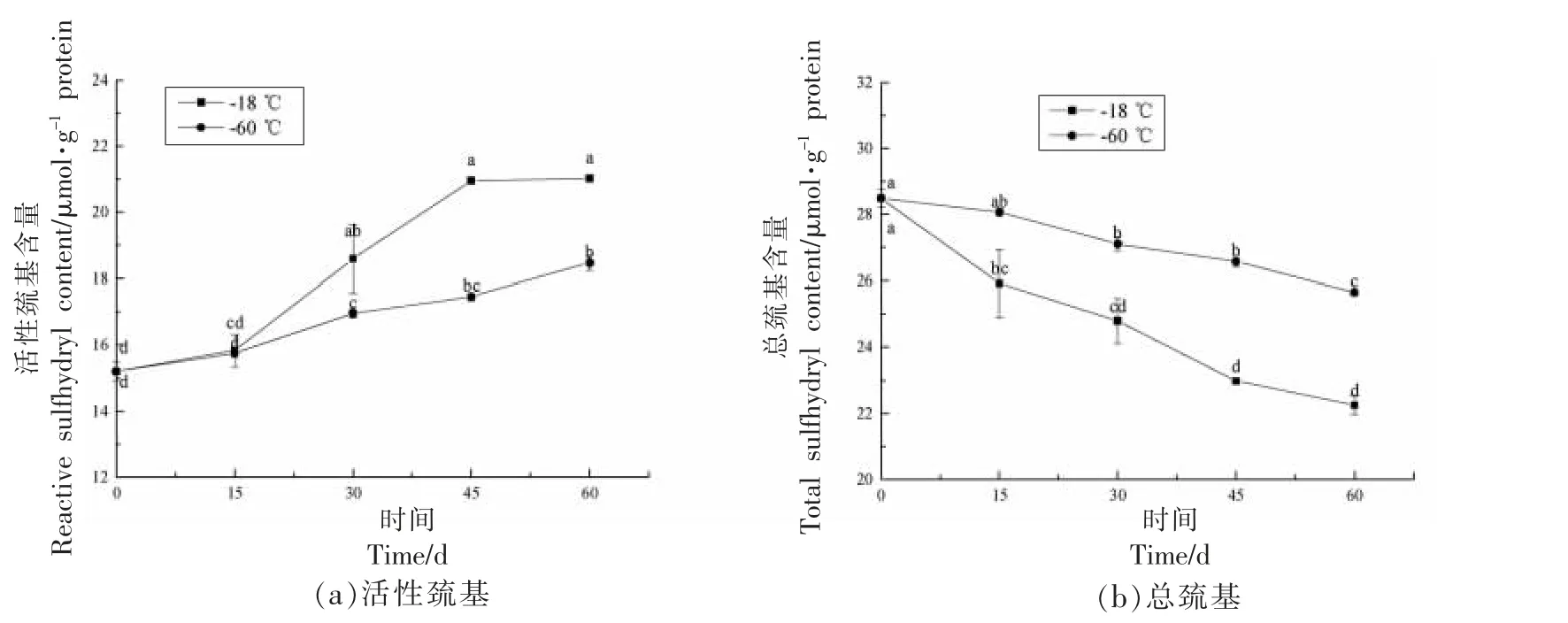
图5 不同冻藏温度下冻藏过程中鱼糜中(a)活性巯基和(b)总巯基含量变化Fig.5 Changes in the content of(a)reactive sulfhydryl and(b)total sulfhydryl groups of unwashed surimi during frozen storage at different freezing temperatures
2.6 AGE 形成与脂肪、蛋白质氧化的相关性
研究表明,食品中的AGEs 主要通过美拉德反应途径产生,也可以在蛋白质、脂肪等组分的氧化反应过程中形成[12]。分析冻藏过程中未漂洗鱼糜中AGEs(CML 和CEL)含量与鱼糜蛋白质和脂肪氧化指标之间的相关性,结果见表1。可见,无论是生鱼糜还是熟鱼糜样品,其两种AGEs 含量均与冻藏时间呈极显著正相关(P<0.01),说明冻藏过程是影响未漂洗鱼糜AGEs 形成的重要因素,这与Niu等[15]和Yu等[33]的结论一致。羰基、活性巯基、总巯基含量和Ca2+-ATPase 活力均是能表征生鱼糜蛋白质氧化的指标,其中羰基含量和活性巯基含量在冻藏过程中升高(图3、图5a),与鱼糜AGEs 含量呈极显著正相关(P<0.01),而总巯基含量和Ca2+-ATPase 活力在冻藏过程中下降(图5b、图4),与鱼糜AGEs 含量呈极显著负相关(P<0.01),表明蛋白质氧化导致的蛋白结构损伤、部分基团暴露和氧化产物增加是未漂洗鱼糜冻藏过程中AGEs 形成的主要原因。TBA 值是表征鱼糜脂质氧化的指标,冻藏过程中生熟鱼糜的TBA 值均呈先增加后降低趋势(图2),生鱼糜的TBA 值与其CML 和CEL 含量呈极显著正相关(P<0.01),而与熟鱼糜的CML 和CEL 含量也呈显著正相关(r=0.408~0.526,P<0.05),表明脂质氧化也是促进鱼糜AGEs 形成的重要因素。Yu等[33]的研究结果表明脂质氧化促进了CML 和CEL 的生成,这与本研究的结果一致。然而,熟鱼糜的TBA 值与所有样品的CML 和CEL 含量均无显著性相关性(P>0.05),可能与热处理促进了脂肪氧化产物进一步降解或转化有关[28],而脂肪氧化进一步影响蛋白质氧化,从而间接影响AGEs 的生成。总之,未漂洗鱼糜冻藏过程中AGEs 形成与其脂肪和蛋白质密切相关,由于蛋白质的冷冻变性和结构损伤,导致氨基酸残基的暴露[33],加之脂质氧化形成的醛酮类产物,不可避免地会诱发蛋白质氧化,从而促进了AGEs 的形成。

表1 未漂洗鲢鱼鱼糜AGEs 含量与脂肪和蛋白质氧化指标间的相关性Table 1 Correlation analysis of AGEs and oxidation indexes of fat and protein in unwashed silver carp surimi
3 结论
未漂洗鲢鱼鱼糜在冻藏过程中AGEs(CML和CEL)的含量显著增加,超低温(-60 ℃)冻藏有利于抑制AGEs 形成,而加热促进了AGEs 形成。冻藏过程中鱼糜样品的蛋白质羰基和活性巯基含量逐渐上升,且与AGEs 含量显著正相关;蛋白质总巯基含量和Ca2+-ATPase 活性逐渐降低,且与AGEs 含量显著负相关,说明蛋白质的变性和氧化是鱼糜冻藏过程AGEs 形成的重要原因。此外,超低温冻藏有利于抑制脂质和蛋白质的氧化,从而抑制了AGEs 形成。
