双低油菜籽分离蛋白提取方法对其功能性的影响
2023-11-26蒋舒婷贺颖仇丹王亚娟邓尚贵
蒋舒婷,贺颖,仇丹,王亚娟*,邓尚贵
(1 宁波工程学院材料与化学工程学院 浙江宁波315211 2 浙江海洋大学食品与药学学院 浙江舟山 316022)
双低油菜(Canola),亦称芥花,系芸苔属十字花科植物,为加拿大育种专家Stefsson 于1974 年通过基因改造,从普通高芥酸油菜籽改良而得的新品种[1]。与传统的油菜籽相比,双低油菜籽的芥酸含量(<2%,油)、硫代葡萄糖苷含量(<30 μmol/g,饼)均大幅度降低[2]。双低油菜籽压榨所得芥花油中不饱和脂肪酸在90%以上,主要为亚油酸和亚麻酸,不含反式脂肪酸和胆固醇,而富含维生素E 和维生素K,使其具有一定的软化血管,降低冠状动脉心脏病,延缓衰老等功效,且吸收率可达99%[3]。自其被发现以来越来越被各国重视,种植面积也越来越广。据美国农业部(USDA)的统计,芥花油目前位居全球第三大食用油,约占全球食用油消费总量的15%,仅次于棕榈油与大豆油。2019-2020 年度全球菜籽饼粕产量0.39 亿t,我国消耗总量达0.11 亿t[4]。经压榨后的油菜籽粕含有极高的蛋白含量(约20%)[5],其中必需氨基酸和非必需氨基酸含量之比接近联合国食品和农业组织(简称FAO)和世界卫生组织(WHO)的推荐标准,属于比较优质的蛋白资源[6]。
油菜籽蛋白具有产量丰富,营养价值高,使用安全等优点,故许多国家,如加拿大、美国、法国、西欧及日本等很早就开展研究。然而,截止目前,因菜籽饼粕中的硫苷、植酸等抗营养因子,故其最主要用途是饲料行业,甚至被遗弃,用作肥料[7]。现有研究表明:脱毒后的油菜籽饼是一种品质优良的植物蛋白资源[8]。近年来,国内外学者对从油菜籽饼粕中高效提取的蛋白质进行了研究,其中将细胞壁的破碎使蛋白质大量溶出是关键工序。目前菜籽蛋白的提取方法主要包括pH 值分段控制法(即碱溶后等电点沉淀)[9]、盐溶法[10]、奥斯本法(OSB 法)[11]及酶解法[12]等。这些提取方法或多或少存在一些不足,如碱溶酸沉法中蛋白质易发生水解变性,盐溶过程需配合膜过滤,OSB 法收率较低,酶法、微生物发酵法目前仅限于试验阶段[13]。同一种植物蛋白,干燥方法的不同会使其理化性及功能有所差异[14],类似的,提取方法的不同亦会导致其功能性不同。本研究以国产秦杂油2 号双低油菜籽经冷榨制得的菜籽饼粕为原料,借助碱溶蛋白液中蛋白质分子上的电荷,使其在电场环境中定向移动,提取油菜籽分离蛋白,并与碱溶酸沉法提取的油菜籽蛋白的结构及功能性进行对比,旨在为油菜籽分离蛋白的实际应用提供参考。
1 材料与方法
1.1 材料与仪器
秦杂油2 号冷榨油菜籽粕,由陕西省杂交油菜研究中心提供;正己烷(AR),国药集团化学试剂有限公司;牛血清蛋白(AR)、考马斯亮蓝G-250(AR)、8-苯胺-1-萘磺酸(ANS,AR)、三(羟甲基)氨基甲烷(Tris,AR),北京索莱宝科技有限公司;磷酸(AR),国药集团化学试剂有限公司;PBS缓冲液,厦门海标科技有限公司;甘氨酸(AR)、β-巯基乙醇(AR),宁波萃英化学技术有限公司;乙二胺四乙酸(EDTA,AR)、二硫代二硝基苯甲酸(DTNB,AR)、三氯乙酸(TCA,AR),上海麦克林生化科技有限公司;尿素(AR),天津市大茂化学试剂厂;十二烷基硫酸钠(SDS,AR),国药集团化学试剂有限公司。
高速多功能粉碎机,武义海纳电器有限公司;TG16-WS 台式高速离心机,湖南湘仪实验室仪器开发公司;手持式pH 检测计,东莞万创电子制品有限公司;KEEZO 加热磁力搅拌器,上海精凿科技有限公司;Scientz-10N 台式冷冻干燥机,宁波新芝生物科技股份有限公司;JRJ300-D-I 剪切乳化机,上海标本模型厂。
1.2 油菜籽粕预处理
利用高速多功能粉碎机将油菜籽饼粕粉碎为75~270 μm 的颗粒,而后按料液比1∶4 加入正己烷,通风橱中机械搅拌1 h 后于8 000×g 条件下离心10 min,回收上清液,继续往不溶物中加入正己烷,搅拌离心,重复3 次。而后将不溶物平铺在锡箔纸上置于通风橱自然风干,得脱脂油菜籽粕粉。
1.3 油菜籽分离蛋白的提取
称取适量脱脂油菜籽粕粉,按料液比1∶20(g/mL)加入去离子水,而后使用NaOH 溶液将pH 值调至11.0,25 ℃机械搅拌2 h,期间每隔15 min 检查混合溶液的pH 值并保证其在10.5~11.0,然后于5 600×g 条件下离心10 min,留上清液过滤。
碱溶酸沉法:将上述滤液用HCl(1.0 mol/L)调pH 值至4.5~5.0,而后于4 ℃静置4 h,于5 600×g条件下离心10 min,刮取下层沉淀物,加少量去离子水,并将其调至pH 值为中性,冻干后得常规提取油菜籽分离蛋白(conventional rapeseed protein,简称CRP),其纯度采用元素分析法测定其N元素含量反推,淀粉含量采用GB/T5009.9-2008《食品中淀粉的测定》酸水解法测定。
电场提取法:将上述滤液置于电场中,以石墨为正极,钛板为负极,设置电场电压为16 V,隔30 min 收集电场正极板附近的絮凝物,后加少量去离子水,调节pH 值至中性,冻干后得电场提取油菜籽蛋白(electrostatic rapeseed protein,简称ERP),纯度及淀粉含量的测定同CRP。
1.4 分离蛋白的功能性测定
1.4.1 持水性 精确称取0.600 g 分离蛋白样品,加10 mL 去离子水至15 mL 的离心管中,漩涡振荡使之充分混合,于3 000×g 条件下离心30 min,小心倒去上清液,称重后使用公式(1)计算其吸水性(water absorption capacity,WAC),重复3 次取平均值。
式中:M0——干分离蛋白的质量,g;M1——干分离蛋白和空离心管的质量,g;M2——吸水后的分离蛋白和离心管的质量,g。
1.4.2 持油性 精确称取1.000 g 样品与10 mL大豆油一起置于15 mL 离心管,漩涡振荡使之充分混合,室温放置30 min 后于3 000×g 条件下离心30 min,而后倒去上清液,称重后使用公式(2)计算其吸油性(oil absorption capacity,OAC),重复3 次取平均值。
式中:M0——干分离蛋白的质量,g;M1——干分离蛋白和空离心管的质量,g;M2——吸油后的分离蛋白和离心管的质量,g。
1.4.3 溶解度 根据Petrucelli等[15]的方法检测,并做适量修改:称取6 份0.1000 g 蛋白样品溶于10 mL 去离子水中,磁力搅拌使之充分混合,分别调节pH 值至3.0,4.0,5.0,7.0,9.0 和12.0。室温下搅拌30 min,之后在4 000×g 条件下离心30 min,取上清液1 mL 加入5 mL 考马斯亮蓝溶液,充分混合后测定样品在595 nm 处的吸光度。试样测定3 次,结果取平均值。
1.4.4 乳化性及乳化稳定性 参照Yasumatsu等[16]的方法对油菜籽分离蛋白的乳化性及乳化稳定性进行测定:称取1.75 g 蛋白质样品加入25 mL 去离子水,高速剪切30 s,而后加入25 mL 玉米油,继续剪切乳化30 s,1 100×g 离心5 min,乳化能力EA 按公式(3)计算。乳化稳定性按如下方法:将此离心管在80 ℃水浴振荡30 min,后离心测乳液层高度并带入公式(4)计算乳化稳定性ES。
公式(3)中,H0——离心后样品总高度,cm;H1——乳液层高度,cm;公式(4)中H1——振荡前乳液层高度,cm;H2——振荡后乳液层高度,cm。
1.4.5 表面疏水性 参考Timilsena等[17]方法取一定量的蛋白质样品,分别加入20 mmol/L,pH 7.0的PBS 缓冲液,并配置成浓度为0.02,0.04,0.06,0.08,0.1 mg/mL 溶液。设定荧光分光光度计激发波长和发射波长分别为390 和470 nm,狭缝宽5 nm。向2 mL 蛋白溶液中加入20 μL 浓度8 mmol/L的8-苯胺-1-萘磺酸溶液,振动后静置5 min 测定荧光强度,以光强对蛋白质浓度作图,斜率即为表面疏水性S0。
1.4.6 游离巯基及二硫键含量 参照Tang[18]的方法测定游离巯基,具体方法如下:取l mL 10 mg/mL 样品蛋白分别加入2 mL 缓冲溶液(每升溶液含10.4 g Tris,6.9 g 甘氨酸,1.2 g EDTA,pH 8.0)和0.02 mL Ellman 试剂(0.2 g DTNB 溶于50 mL上述缓冲溶液中),于25 ℃保温5 min,在412 nm下测定吸光值,按公式(5)计算表面巯基,以不加样品蛋白只加Ellman 试剂的样为空白。
式中:A412nm——有DTNB 存在时样品的吸光值-无DTNB 存在时样品的吸光值;D——稀释倍数;m——固形物含量,g。
二硫键含量测定参考李丽娜等[19]的方法并稍作修改:取10 mg 蛋白样品,在样品中分别加入4 mL 的尿素-盐酸胍溶液(10.4 mg/mL Tris,6.9 mg/mL甘氨酸,1.2 mg/mL EDTA,0.48 mg/mg尿素,pH 8.0)再加入0.05 mL β-巯基乙醇。在25 ℃条件下,水浴保温1 h,再加入12% TCA 溶液10 mL 水浴1h,将溶液离心,弃上清液,取沉淀,将沉淀溶解在12%的TCA 中保温1 h 再次离心,加入10 mL EDTA 缓冲液1%的SDS 溶解沉淀,加入50 μL Ellman 试剂,剧烈振荡后于25 ℃保温1 h,在25 ℃条件下,然后离心(10 000 r/min,30 min),测定412 nm 处下的吸光值,总巯基含量SHtotal按公式(5)计算,二硫键SS 的含量按公式(6)计算:
1.5 分离蛋白的结构表征
1.5.1 氨基酸组成 采用GB5009.124-2016 《食品中氨基酸的测定》方法测定ERP 及CRP 中氨基酸的种类及所占比例。
1.5.2 圆二色谱 参照叶钰等[20]的方法,称取10 mg 样品加入5 mL 水,4 h 换一次水透析12 h,而后于3 000×g 离心5 min,取上清液,放入圆二色谱仪中,设定扫描范围为190~250 nm,狭缝宽度1 nm,扫描速度为50 nm/min,记录样品的圆二色谱图,得到的数据进一步通过软件拟合计算蛋白质的二级结构含量,结果为3 次平均。
2 结果与讨论
2.1 分离蛋白组成
使用2 种方法提取的油菜籽分离蛋白的收率、纯度及其中淀粉含量见表1。由表1 可知:相同条件下,使用ERP 的收率及纯度分别为12.34%和92.56%,均较CRP 的更高(其值分别为10.85%和89.04%)。油菜籽籽实中含有一定量的淀粉[21],而在碱溶酸沉提取时,碱液中的淀粉在调节pH值时会部分沉淀,因此在后续离心过程中淀粉很难去除,故而使用传统提取方法获得的植物蛋白中淀粉含量较电场中提取的高。

表1 两种方法提取的分离蛋白收率及纯度Table 1 Yield and purity of rapeseed protein extracted with two different method
2.2 氨基酸组成
蛋白质的基本结构单元是氨基酸,氨基酸组成会极大影响蛋白质的理化性及功能性,而蛋白质来源、品种、提取方法都会影响氨基酸比例[6,14-15]。表2 列出了ERP 和CRP 的氨基酸组成,由该表可知:油菜籽蛋白的氨基酸组成较全,含有人体所需的必需氨基酸,且必须氨基酸含量高于30%,各种必需氨基酸含量均接近FAO/WHO 的推荐值[22];而不同的提取方法得到的油菜籽分离蛋白中氨基酸所占比例不同,如ERP 疏水性氨基酸占氨基酸总量的47.97%,而CRP 中疏水性氨基酸仅为43.10%,这就造成了其功能性的不同。

表2 油菜籽分离蛋白的氨基酸组成与含量Table 2 Amino acid composition and content of CRP and ERP
支链氨基酸具有独特的生理功能,是肌肉代谢的重要燃料,可改善肝功能和病人蛋白质营养失常状态及抗疲劳功能[23],上表中显示油菜籽蛋白中支链氨基酸含量可达约15.84%~20.42%,意味着经过剧烈运动后,可通过油菜籽蛋白补充损失的蛋白质,因此油菜籽蛋白可作为一种良好的植物蛋白质来源。
2.3 持水、持油性
ERP 与CRP 的持水、持油性详见图1。植物蛋白的持水、持油性均会影响食品的品质及质构,持水性与蛋白质的保水性、溶胀性、溶解度和凝胶性等关键属性有关,而持油能力则表明蛋白质吸收和保留脂肪的能力。
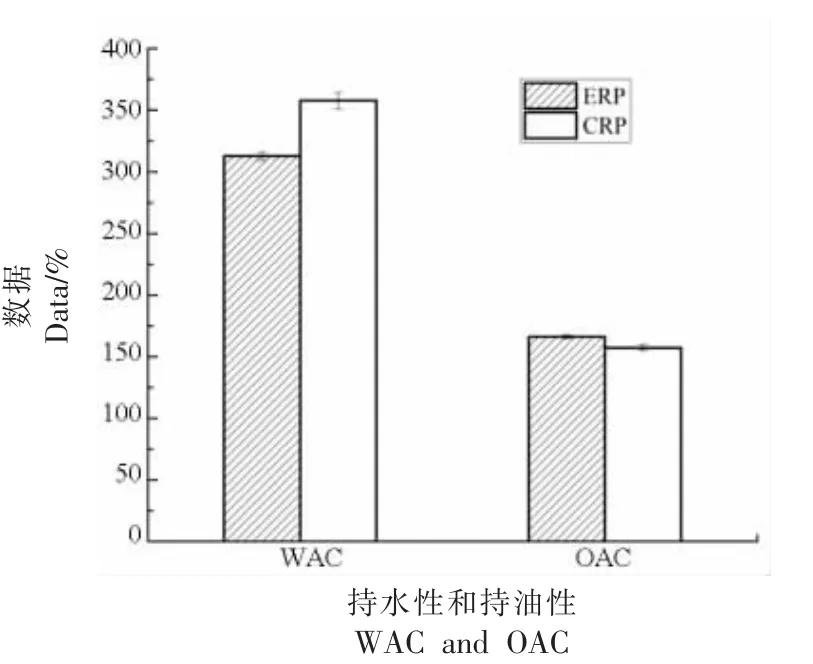
图1 菜籽蛋白持水、持油性对比Fig.1 WAC and OAC of rapeseed protein
由图1 可发现:电场提取出的分离蛋白ERP的持水性低于传统方法,相反其持油性略高于CRP,而持油性与其分子中疏水性氨基酸的含量及暴露量有关[24],该规律也与表2 中这两种方法所提的分离蛋白中疏水性氨基酸的占比相符,即ERP 中疏水性氨基酸占47.97%,略高于CRP(其值为43.10%)。
2.4 溶解度
以牛血清蛋白为标准物,经考马斯亮蓝显色后在595 nm 处的吸光度为纵坐标,蛋白质含量为横坐标绘制标准曲线,本试验所提分离蛋白ERP和CRP 在不同pH 值下的溶解度曲线见图2。
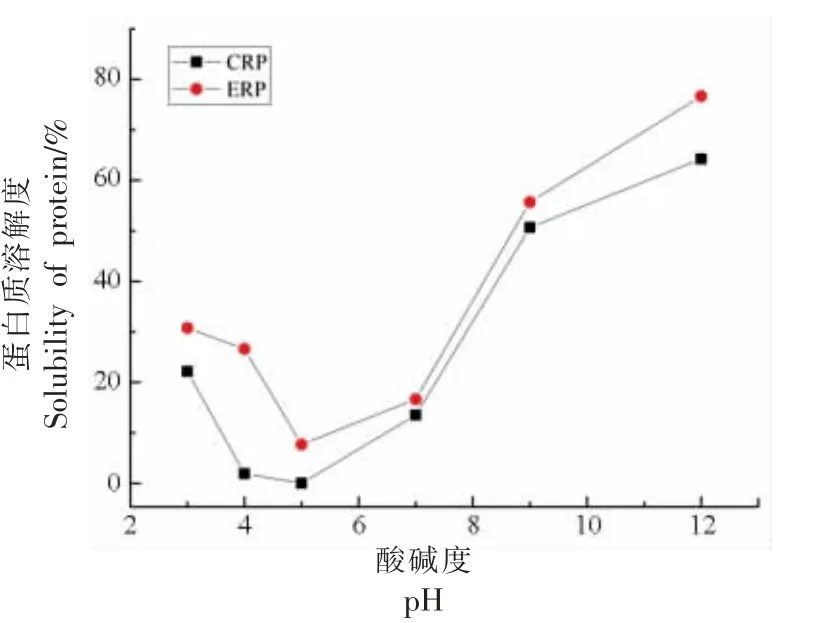
图2 两种方法提取的分离蛋白的溶解性Fig.2 Solubility rapeseed protein extracted with two methods
蛋白质的溶解度会显著影响其功能性,而由于其具有两亲性,因此会受到溶液pH 值、亲水-疏水性氨基酸比例及离子强度的影响[25-26]。由图2可知:随着环境pH 值的增加,油菜籽蛋白的溶解性呈先下降后增加的趋势,溶解度的最低点在其等电点附近(pH=5),此时ERP 和CRP 的溶解度分别为7.68%和0.03%。当溶液pH 值处于蛋白质等电点时,蛋白自身不带电,与水分子作用力最弱,此时蛋白质分子间的作用力增强,更易聚集;而当溶液pH 值偏离等电点时,蛋白带不同量的正或负电荷,其与水分子的结合能力增强,溶解度随之增加[27]。值得注意的是:使用电场提取的油菜籽分离蛋白的溶解度均较传统碱溶酸沉方法提取的高,其原因为ERP 中更少的淀粉组分,同时电场环境可能会对蛋白质的三级结构有所破坏,进而增加其与水分子的结合力。这与胡娟[28]所得的“在一定的脉冲电压范围内,蛋白质溶解度会随电压增加而增加”的结论相符。
2.5 乳化性及乳化稳定性
蛋白质的乳化性及乳化稳定性会受到蛋白质分子的大小、形状、pH 值、溶解度和疏水性的影响[29]。本试验所提取的油菜籽分离蛋白的乳化性及乳化稳定性结果见表3。

表3 两种方法提取的油菜籽分离蛋白的乳化性及乳化稳定性Table 3 Emulsification and emulsification stability of ERP and CRP
表3 中的数据显示:ERP 的乳化能力为(49.95±1.33)%,略高于CRP 的(47.13±1.74)%,分析原因为ERP 表面的疏水基团的暴露,使得其与大豆油的结合更强,同时由于ERP 具有更小的粒径,而粒径的减小对应着相对较大的蛋白质片段基团被破坏,形成更小的蛋白质单位,链段柔性增加,蛋白质分子链充分伸展,促使原来被包裹着的氨基酸残基凸显出来,因此柔性链段的增加及疏水基团的充分暴露使其具有更大的表面活性[30-31]。
乳化稳定性指乳液能够保持稳定状态,且不产生两相分层的现象,在工业生产中,乳液稳定性高有利于蛋白在产品中的利用。如表3 所示ERP和CRP 的乳化稳定性分别为90.85%和88.56%,即ERP 的乳化稳定性优于CRP,其原因是碱溶酸沉提取时溶液中的NaCl 无法完全去除,而盐离子的存在不利于乳液的稳定[13];同时ERP 样品大量存在的疏水基团的适当暴露(见表2 中数据)可促进其与油滴的相互作用,从而降低界面张力,提高其乳化稳定性[32]。
2.6 表面疏水性
ERP 和CRP 的表面疏水性数据见表4,如表所示:ERP 的表面疏水性比CRP 的高20%,而蛋白质表面疏水性与蛋白质表面暴露的疏水氨基酸残基的数量和类型有关,并受蛋白质结构的折叠、展开状态和变性的影响[33],因此可推测油菜籽蛋白在电流作用下,其三级甚至二级结构发生一定程度的改变,诱使以前隐藏在蛋白内部的疏水基团暴露出来,从而导致ERP 的表面疏水性高于CRP。由于ERP 的高表面疏水性,使得其持油性高于CRP(见图1)。

表4 两种方法提取的油菜籽蛋白的表面疏水性、巯基及二硫键含量Table 4 Surface hydrophobicity,sulfhydryl group and disulfide bond contents of ERP and CRP
2.7 巯基及二硫键含量
疏基和二硫键是构成蛋白质空间结构的骨架,在稳定蛋白质构象和保持蛋白质活性方面起重要作用,对蛋白质的功能特性有很大的影响,而在一定条件下二硫键与巯基会相互转化[34]。
电场中提取的油菜籽分离蛋白ERP 的游离巯基含量约为21.57 μmol/g,远低于CPR 的(约为34.33 μmol/g),相反的,ERP 中二硫键含量高于CRP,原因为电场的存在会诱导蛋白质的极性基团产生自由基,从而破坏蛋白质分子之间的静电作用,使之构象产生变化[35]。由于蛋白质的疏水相互作用,使得其表面自由基重新聚集,巯基与巯基之间的氧化作用增强,故而形成二硫键几率更大,残留在表面的游离巯基含量降低。同时,二硫键含量增加,其疏水性也相应增加;疏水性增强,乳化性及乳化稳定性提升,这也印证了图1 与表3 中的结论。
2.8 圆二色谱
蛋白质的二级、三级结构会影响其功能性,圆二色谱中有3 个特征结构峰:190 nm 处的正峰,208 和223 nm 处的2 个负峰对应着蛋白质的α-螺旋;而195 nm 左右处的正峰、215 nm 左右的负峰则为β-折叠结构;200 nm 左右处的负峰是无规卷曲结构形成的[36]。不同提取方法获得的油菜籽分离蛋白的圆二色谱图及各二级结构所占比例如图3 所示。

图3 提取方法对油菜籽分离蛋白二级结构的影响Fig.3 Effect of extraction methods on secondary structure of rapeseed protein
由图3b 可以看出:提取方法不同,得到分离蛋白的二级结构比例也有显著差异,如ERP 和CRP 的α-螺旋、β-折叠分别占33.05%,23.15%和29.88%,28.53%,即电场提取的油菜籽分离蛋白中α-螺旋所占比例更大,传统碱溶酸沉提取的蛋白中β-折叠结构相对较多,而在蛋白质的二级结构中,氢键对构象的稳定具有重要作用,β-折叠结构比α-螺旋结构更伸展,故而推测ERP 的结构及性能较CRP 更稳定,此部分内容有待后续工作印证。
有文献表明“蛋白质的α-螺旋结构与其乳状液稳定性之间呈正相关关系”[37],图3b 中结果显示ERP 中α-螺旋结构的比例较CRP 的大,这也解释了表3 中ERP 相对较优的乳化性及乳化稳定性。
3 结论
本文将弱电场引入油菜籽蛋白的提取工艺,并比较了弱电场及碱溶酸沉2 种方法提取的秦杂油2 号双低油菜籽蛋白ERP 和CRP 的功能性,结果表明:ERP 的收率及纯度比CRP 的高;同时,提取方法对油菜籽蛋白的结构及功能性均有不同程度的影响。氨基酸成分分析显示ERP 分子中疏水性氨基酸占比较CRP 的大,进而使得其持油性较高;弱电场所提油菜籽蛋白的表面疏水性及二硫键含量均高于常规碱溶酸沉法,从而保证了其良好的乳化性、乳化稳定性及持油性;ERP 的二级结构中α-螺旋所占比例更大,CRP 中β-折叠结构相对较多。本研究工作可为油菜籽蛋白的研究及开发利用提供理论参考,并对其它植物蛋白的提取及在食品中的应用有一定的借鉴意义。
