过敏性哮喘免疫调节机制
2023-11-24郑卉爽徐迎阳李丽莎关凯
郑卉爽,徐迎阳,李丽莎,关凯
作者单位:100730 北京,中国医学科学院 北京协和医学院 北京协和医院变态(过敏)反应科,过敏性疾病精准诊疗研究北京市重点实验室,国家皮肤与免疫疾病临床医学研究中心
哮喘是一种由多种细胞和细胞组分参与的慢性气道炎症性疾病,伴有气道高反应(airway hyper reactivity,AHR)可逆的气流受限,临床表现为反复发作的咳嗽、喘息、呼吸困难、胸闷等症状[1]。哮喘具有异质性,临床表型不同。过敏性哮喘是其中重要的表型之一,是一类由变应原诱发的哮喘。常见可诱发过敏性哮喘的变应原包括尘螨、真菌、花粉、动物皮屑等。过敏性哮喘是由Th2型炎症反应驱动,发生机制涉及适应性免疫和固有免疫。尤其是CD4+Th2细胞,可产生Th2细胞因子(IL-4、IL-5、IL-9和IL-13),导致大量嗜酸性粒细胞(eosinophils,Eos)在气道壁堆积,黏液过度分泌,并由过敏原特异性B细胞合成免疫球蛋白E(immunoglobulinE,IgE),从而促进肥大细胞释放大量炎症介质参与疾病(图1)。本综述主要介绍过敏性哮喘的发病机制及研究进展,从固有免疫、适应性免疫、细胞外囊泡以及微生物组学方面展开阐述。
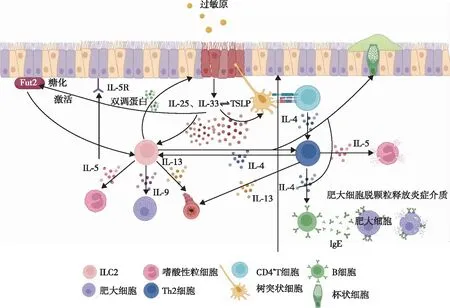
图1 过敏性哮喘发病机制Fig 1 Pathogenesis of allergic asthma
1 固有免疫
1.1 上皮细胞
气道上皮是肺内环境与外界环境之间的第一道防线,其通过物理屏障、黏液纤毛清除等功能来抵御外界过敏原和其他有害物质的侵袭[2]。上皮细胞不仅是身体和外界之间的物理屏障,而且还被认为是免疫活性细胞,可以协调由过敏原引起的炎症反应[3]。上皮细胞表达跨膜或细胞内模式识别受体,识别入侵的过敏原并激活触发警报素细胞因子白介素25(interleukin-25,IL-25)、白介素33(IL-33)和胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)的释放,这些细胞因子诱导下游Th2型细胞因子产生。IL-25、IL-33和TSLP均与过敏性哮喘的严重程度有关[3]。
IL-25(又称为IL-17E)是IL-17家族中一种细胞因子,大部分的IL-25由上皮细胞产生,也可由树突状细胞、T细胞、2型固有淋巴细胞等免疫细胞产生。IL-25与更严重的哮喘表型有关。IL-25水平更高的患者,AHR更强,血中的Eos更多,血清IgE更高,气道上皮增厚更明显,Th2特征基因表达也更高[4]。另外,IL-25在气道重塑中发挥作用。IL-25通过IL-13间接影响组织重塑而IL-13与病理相关的纤维化密切相关[5]。
IL-33是一种IL-1超家族的细胞因子,正常情况下,IL-33主要来源于上皮细胞、内皮细胞和成纤维细胞的细胞核内[1]。其同源受体白细胞介素-1受体样1(IL1RL1或ST2)基因是儿童过敏性哮喘的易感基因[6]。到目前为止,至少有130个不同的IL-1RL1单核苷酸多态性位点已被确定与哮喘有关[6]。2018年Scott等[7]首次报道了外源性和内源性蛋白酶可以增强IL-33活性,进而导致巨噬细胞、2型固有淋巴细胞(ILC2)增加,Eos浸润增加,气道反应性增高。IL-33可增加CD146的表达,从而促进哮喘上皮-间质转化,加快哮喘气道重塑[8]。
TSLP属于白介素家族,是一种造血B细胞的增殖和分化因子。过敏原刺激呼吸道之后,TSLP表达上调,同时TSLP也会促进嗜碱性粒细胞和肥大细胞活化。TSLP能明显增强Eos的炎症,通过延迟Eos的凋亡促进Eos的活性和趋化[9]。虽然传统上认为TSLP是与Th2相关的细胞因子,但TSLP在支气管肺泡灌洗液中的表达也被证明了与中性粒细胞炎症相关[10]。儿童过敏性哮喘受TSLP风险基因型(rs2289277和rs11466750)和鼻腔上皮细胞中的表达的TSLPmRNA综合影响[11]。在评估哮喘风险时,考虑这两种生物标志物尤为重要。TSLP基因rs2289276(C/T)3个基因型与儿童过敏性哮喘发病相关,TSPL rs2289276 CC基因型在患有哮喘的儿童中可能导致患者Th1/Th2失衡,导致异常的炎性细胞因子的分泌[12]。
在一项临床随机对照试验中,中重度哮喘控制不佳的患者经抗IL-25单克隆抗体治疗12周后ACQ评分没有改善,FEV1的改变未达统计学意义,抗IL-25单克隆抗体对受试者没有产生治疗效果[13]。目前全球有关IL-25单克隆抗体的临床试验均已停止。抗IL-33或TSLP可控制哮喘症状或改善生活质量(表1)。在小鼠模型中,联合阻断IL-25、IL-33和TSLP后可能会抑制炎症细胞向气道和肺实质浸润、Th2细胞因子的表达,以及气道重塑从而来改善气道病理变化[14]。基于此项研究结果,联合阻断这些警报素比单独阻断任何一个更有效,这可能适用于治疗严重的哮喘患者[14]。但是,到目前为止,尚无关于哮喘患者体内警报素之间的潜在作用和联合阻断IL-25、IL-33和TSLP后对哮喘患者的影响的研究。

表1 生物制剂在过敏性哮喘治疗中的作用Table 1 Role of biological agents in the treatment of allergic asthma
1.2 固有淋巴细胞
固有淋巴细胞(innate lymphoid cells,ILCs)是一类非T、B细胞,与适应性免疫细胞平行的一类细胞。ILCs分为五类:自然杀伤细胞、ILC1s、ILC2s、ILC3s和淋巴组织诱导细胞。其中,ILC2s现已明确是参与过敏性哮喘中Th2型免疫应答的主要细胞[24]。ILC2s主要存在于黏膜屏障中,参与防御病原体、组织修复和维持局部平衡,被认为是第一道防线的细胞,也是固有免疫细胞(如巨噬细胞、树突状细胞、粒细胞)和适应性淋巴细胞(B细胞和T细胞)之间交叉影响的关键枢纽[25]。ILC2s是强大的细胞因子生产者,主要产生IL-4、IL-5、IL-9和IL-13。同时ILC2s还产生双调蛋白可以促进损伤后的修复[26]。
ILC2s在解剖部位上与肺神经内分泌细胞(pulmonary neuroendocrine cells,PNECs)相毗邻,均位于气道交叉处,研究者发现PNECs在黏膜屏障处识别过敏原或其他信号,而后分泌γ-氨基丁酸和降钙素基因相关肽,γ-氨基丁酸可导致杯状细胞增生,继而导致气道粘液分泌增多;降钙素基因相关肽可刺激ILC2s分泌IL-5,从而引起Eos在气道内聚集[27]。在体外用维甲酸刺激时,人ILC2s可获得产生IL-10的能力[28]。ILC2s产生的IL-10与过敏有关,并对慢性过敏有抑制作用[28]。IL-10可抑制CD4+T细胞和ILC2s激活[29]。在对患者进行尘螨特异性免疫治疗中发现外周血中产生IL-10的ILC2s增加与过敏性鼻炎的改善有关[29]。
ILCs2的发现为过敏性哮喘的发病机制研究,提供了新思路。但是目前仍有许多问题有待解决,如调控ILC2s活化的调控因子、哮喘发生过程中ILC2与其他免疫细胞的功能是否重叠等[25]。
1.3 树突状细胞
树突状细胞(dendritic cells,DCs)是免疫系统中最有力的抗原呈递细胞,是固有免疫和适应性免疫之间的桥梁。DCs包括常规DC(cDCs)和浆细胞DC(pDC),其中肺部cDC是异质性的细胞群,可分为1型(cDC1s)和2型cDCs(cDC2s)[9]。与其他DC亚群相比,cDC1s吸收过敏原的能力较弱,并且与免疫耐受有关[30]。在暴露于过敏原后,Ⅰ型干扰素会诱导一个非常特殊的炎症性cDC2s亚群,它具有cDC1s(IRF8表达)和单核细胞来源细胞(CD64表达)的混合特征[31]。在过敏性哮喘的发病和进程中,不同DC亚群的功能非常复杂,并且高度依赖于吸入过敏原的性质和量、局部微环境的组成、DC在气道中的定位以及免疫反应的阶段[30]。由于难以从哮喘发作患者身上获取肺部组织样本,因此难以对DC亚群进行功能研究,每个亚群在哮喘中的作用仍然需要进一步进行研究。
1.4 嗜酸性粒细胞
Eos是过敏性哮喘的主要效应细胞,它含有细胞毒性颗粒。哮喘患者外周血Eos被募集到气道,并由IL-5活化。IL-5是介导骨髓中Eos成熟的关键细胞因子,参与Eos的分化、增殖、生存、激活、粘附、外渗和脱颗粒。目前已经开发出2种抗IL-5抗体(美泊利单抗和瑞利珠单抗),抗体与IL-5结合阻止促进Eos活化。贝那利珠单抗可阻断IL-5Rα的表达,从而使IL-5Rα的表达降低。抗IL-5治疗目前已在多个国家上市,并有大量证据表明有良好的效果(表1)。Eos通过脱颗粒释放大量有毒物质发挥效应,如嗜酸性粒细胞过氧化物酶、Eos衍生的神经毒素、Th2细胞因子、急性促炎症细胞因子(如肿瘤坏死因子[TNF]-a、IL-1b、IL-6和IL-8)、趋化因子和脂质介质(如半胱氨酸白三烯)等,这些物质与AHR和杯状细胞化生有关[32]。活化的Eos在气道神经附近的定位和颗粒内容的释放也可以改变副交感神经和感觉神经的张力来促进AHR[33]。另外,Eos相关的碱性因子(如转化生长因子β)会导致气道重塑[34]。
嗜酸性粒细胞胞外诱捕网(eosinophil extracellular traps,EETs)由组蛋白、DNA及Eos游离颗粒组成,在哮喘的发生发展中发挥重要的作用。外周EETs形成的Eos在严重的哮喘患者中升高,并能激活肺上皮细胞产生IL-33和TSLP[35]。EETs的形成也与夏科-莱登晶体(charcot-Leyden crystals,CLCs)的产生密切相关,CLCs具有免疫原性,促进Th2免疫反应[36]。在哮喘人源化小鼠模型(humanized mouse model of asthma)中发现,使用特定的抗体溶解CLCs可以防止Th2免疫反应、IgE合成和粘液分泌[36]。EET的释放、CLCs的产生和黏稠液体的增加共同导致粘液栓形成,并导致气道阻塞和哮喘患者的粘膜清除功能受损[37]。CLCs在过去几年中受到越来越多的关注,但是它们具体的功能和进化发展仍不明确。CLCs在哮喘中的作用还需更多探索。
如图1所示:(1)吸入抗原接触气道上皮后,引发释放警报素IL-25、IL-33、TSLP,刺激周围的DCs和ILC2;(2)ILC2表达IL-4、IL-5、IL-9、IL-13,并释放双调蛋白,促进损伤上皮的修复。其中TSLP和IL-33之间的相互正反馈回路进一步放大了炎症。IL-33激活岩藻糖基转移酶(Fut2),该酶诱导BEC的岩藻糖基化,这对于持续的ILC2激活至关重要;(3)IL-5活化Eos,Eos脱颗粒释放大量有毒物质发生作用;(4)DCs捕获吸入过敏原,将其提呈给CD4+T细胞,诱导CD4+T细胞增殖活化为Th2细胞,Th2细胞诱导产生大量的细胞因子IL-4、IL-5、IL-13,IL-4参与B细胞的活化,产生IgE抗体;(5)IgE交联在肥大细胞上,活化后的肥大细胞释放大量的炎症介质参与哮喘疾病。
2 适应性免疫
2.1 T淋巴细胞
T细胞在哮喘的发病机制中起核心作用。T细胞受体的识别对适应性免疫反应的启动和特异性至关重要,而T细胞衍生的细胞因子则决定了免疫反应的类型[38]。CD4+T细胞在哮喘的发病机制中的作用是无可争议的,但是有证据表明,CD8+T细胞也可能参与其中,直接介入或辅助CD4+T细胞[39]。
CD4+T细胞在IL-4的诱导下分化为Th2细胞。Th2细胞可产生多种细胞因子参与过敏性哮喘的发病机制,其中研究最多的是IL-4、IL-5和IL-13,这些细胞因子是过敏性哮喘的主要驱动因素,并与疾病的活动度、症状评分、气道Eos和AHR有关[3]。IL-4可以上调在幼稚辅助T细胞中的Th2转录因子GATA-3,对Th0向Th2分化和IL-5、IL-9、IL-13、CCL17和Eos趋化因子的合成具有重要作用[38]。IL-5负责骨髓中Eos的成熟和释放,促进B细胞合成IgE,促进嗜碱性粒细胞分化和组胺释放。IL-13与IL-4有一些共同的功能,IL-13诱导产生IgE的B细胞,并促进内皮细胞增殖和黏液分泌[40]。单独抗IL-4或IL-13生物制剂的临床试验结果令人失望,但IL-4和IL-13的双重阻断已显示出前景(表1)。
调节性T细胞(regulatory T cells,Tregs)是CD4+T细胞的亚群,主要表达转录因子叉头框蛋白3(Foxp3)、CD4和CD25。Tregs可抑制抗原呈递细胞来激活效应性T细胞,同时增强耐受性DCs的功能,抑制效应性T细胞(包括Th1、Th2和Th17细胞)的迁移和功能。除此之外,Tregs还抑制浆细胞分泌过敏原特异性IgE[40]。Tregs在哮喘患者中的作用尚未明确。在哮喘儿童中观察到肺Tregs数量减少,同时抑制肺Th2反应的能力降低[41]。然而一些研究表明,与轻度哮喘患者和健康人相比,中重度哮喘病人的气道内Tregs数量增加[42]。这些发现之间的差异可能是因为研究队列和Tregs分析方法的差异造成的。最近一项研究进一步表明,Tregs数量少和功能缺陷可能使儿童和年轻人更容易患哮喘,而老年患者的Tregs与哮喘风险或严重程度之间的关系相对较弱[43]。
Th9细胞、Th17细胞和滤泡辅助T细胞也在哮喘的发病机制中发挥了作用。Th9细胞是能产生大量的IL-9。IL-9能增强Th2细胞因子的产生,活化气道中的Eos、嗜碱性粒细胞和肥大细胞,促进粘液分泌。另外,IL-9可抑制IFN-γ的产生,并协同促进IL-4诱导的IgE分泌[44]。IL-9可能与激素抵抗型哮喘有关,但目前未发现抗IL-9单克隆抗体对控制哮喘症状和减少哮喘加重有好处[45]。Th17细胞在过敏性哮喘中的作用尚未完全阐明。其分泌的IL-17可能发挥双重作用:在过敏原致敏过程中,它是必不可少的,然而一旦致敏之后,IL-17就会削弱过敏反应,可能减少哮喘的发生[46]。以IL-17通路作为靶点,治疗哮喘未能获得成功。滤泡辅助T细胞(follicular helper T cells,Tfhs)是CD4+T细胞的一个独立亚群,这种细胞具有独特的能力,能进入B细胞滤泡中的生发中心,辅助B细胞分化产生浆细胞和记忆B细胞。起初认为IL-13不参与刺激IgE类别的转换,但最近在小鼠和人体中发现了一个产生IL-13的Tfh亚群(Tfh13),可以促进IgE产生[47]。在人体中,Tfh细胞的数量与血液中的总IgE水平相关,而且哮喘病人的Tfh细胞可以刺激IgE的产生,该作用在体外试验中证实是IL-4依赖性的[48]。目前对Tfh在过敏性疾病发病机制中的作用尚未阐明,尤其是Tfh产生的IL-4和IL-21分别能促进和阻止IgE的类别转换重组。
2.2 B淋巴细胞
在Th2型细胞因子作用下,B细胞成熟分化为浆细胞并产生IgE抗体,后者与肥大细胞和嗜碱性粒细胞上的高亲和力FcεRI结合,形成致敏。当过敏原再次进入机体后,与IgE结合形成复合物,激活这些细胞表面的FcεRI,使其迅速脱颗粒释放介质,如组胺、白三烯、前列腺素等,导致支气管平滑肌痉挛、粘液水肿、粘液分泌增加,进而出现哮喘的急性发作。虽然IgE的产生主要发生在二级淋巴器官,但有证据表明这一事件也可能发生在哮喘患者的肺黏膜(所谓的局部IgE)[49]。局部IgE是肥大细胞激活过程中的重要媒介[49]。奥马珠单抗可与IgE的第三恒定区结合,阻止游离IgE与高亲和力和低亲和力FcεR1受体相互作用。大量临床研究表明,奥马珠单抗可改善哮喘患者的肺功能,降低哮喘发作率等(表1)。
在小鼠过敏性气道炎症模型中发现B细胞也作为抗原提呈细胞发挥作用[50]。尘螨小鼠哮喘模型中,发现调节性B细胞在控制肺功能和气道重塑方面的核心作用[51]。在过敏性哮喘患者中,IgE主要是由记忆性IgG阳性B细胞池产生,这些B细胞在Tfh细胞来源的IL-4和/或IL-13的作用下合成IgE并成为长寿的浆细胞[52]。
3 其他
3.1 细胞外囊泡
多种细胞参与了哮喘的发病机制,包括DCs、T和B淋巴细胞、单核细胞、Eos等。在这种情况下,潜在的细胞间交流是关键,主要由可溶性介质如细胞因子、趋化因子和其他可溶性因素来完成。近年来发现细胞外囊泡(extracellular vesicles,EVs)也参与了细胞间交流。EVs是指细胞释放的纳米级别的囊泡状小体,其内包含了许多不同种类的生物活性分子,比如DNA、RNA、长链非编码RNA和蛋白质、脂质等[53]。目前,国际细胞外囊泡协会提供了对EVs进行分类的指南,根据其特征可分为外泌体、微囊泡和凋亡小体3类[54](表2)。

表2 细胞外囊泡分类Table 2 Classification of extracellular vesicles
对于气道上皮细胞来说,EVs携带生物活性物质向受体传递生物信息是一种重要的细胞间沟通方式。在小鼠实验中发现肺中细胞外miRNA库的组成与气道上皮细胞非常相似,在支气管肺泡灌洗液中检测到的80%的EVs来自上皮细胞[55]。在诱导过敏性气道炎症后免疫细胞选择性表达的miRNA数量(包括miR-223和miR-142a)以及造血细胞来源的EVs明显增加,表明EV miRNA库的改变对于过敏性炎症的发展非常重要[55]。抗原提呈细胞可以通过EVs与参与哮喘发展的其他类型的细胞进行交流。来自巨噬细胞和DCs的外泌体含有白三烯生物合成的酶,可通过参与白三烯生物合成和粒细胞募集而导致慢性炎症[56]。此外,由哮喘患者的Eos分泌的外泌体可通过自分泌方式改变与哮喘发病机制有关的几个特定的Eos功能,包括增加活性氧和一氧化氮的合成,以及Eos迁移和粘附[57]。另外,Eos分泌的外泌体可增强原发性气道上皮细胞的凋亡、延迟上皮细胞损伤的修复,以及增加初级支气管平滑肌细胞增殖,使气道炎症持续存在[55]。
EVs通过激发促炎反应在哮喘的发病中发挥重要作用。对从哮喘患者和健康对照组的肺泡灌洗液中分离出的EVs的脂质组进行表征,确定哮喘患者中独特的脂质EV谱,发现改变脂质组可能会导致慢性炎症[58]。除此之外,血浆Eos增多和EV颗粒计数以及IgE 滴度和颗粒计数之间存在正相关[58]。
已有研究表明,基于细胞外囊泡诊断哮喘的方法,主要针对miRNA、蛋白质或脂质,可以在不同的标本中进行,比如肺泡灌洗液、痰液、血清和洗鼻液。考虑到标本的获取和方法学上的合理性,miRNA分析可能成为更精确地识别哮喘表型,特别是通过非侵入性或微侵入性的诊断采样技术[59]。
3.2 微生物组
微生物组是指细菌、真菌、病毒等微生物以及其产物和编码基因的总和[60]。长期以来,人们认为微生物组在哮喘中发挥作用,也可能形成哮喘的异质性[61]。
生命早期暴露于微生物丰富的环境会影响儿童哮喘易感性[61]。哮喘与上下呼吸道均有关,但是大多的微生物研究只集中在上呼吸道,因为通过支气管镜来获取下呼吸道的样本较困难,尤其是对于儿童来说更是如此。研究发现下咽部的分泌物中有肺炎链球菌、流血嗜血杆菌、卡他莫拉菌和混合感染的婴儿出现复发性喘息和哮喘的风险更大[62]。Howard等[63]对285名儿童进行随访至18岁,研究发现鼻咽部样本中获得的以葡萄球菌为主的微生物组与儿童复发性喘息和患哮喘的风险增加有关。
气道微生物组学与哮喘的控制有关。卡他莫拉菌为主的鼻腔微生物组与秋季哮喘加重有关,而那些以葡萄球菌或柯氏杆菌为主的患者则不太容易出现病情加重[64]。分析有严重喘息的学龄前儿童的纤维支气管镜和肺泡灌洗液,发现下气道有两组不同的微生物群:一个是与气道中性粒细胞增多有关的莫氏菌群失调,另一个是由链球菌、普雷沃氏菌和奈瑟菌组成的一个类似于健康肺部的微生物集群,但是后者仍然与巨噬细胞和淋巴细胞为主的炎症有关[65]。
综上所述,气道内的微生物组不是固定不变的,而且年龄和外部因素(如病毒感染)可能影响疾病的发展。肺部微生物甚至可能对哮喘有保护作用。研究证明,在农场长大并饮用生牛奶的儿童过敏性疾病的发病率比非农场长大的孩子约低2倍[66]。室内微生物也可能有保护作用,在非农场长大的孩子患哮喘的风险随家庭微生物组成与农场家庭的相似度增加而降低[67]。农场中的过敏原主要包括细菌、酵母和真菌,它们可以激活固有免疫,其中内毒素,即脂多糖(lipopolysaccharide,LPS),是一种来自革兰阴性细菌的化合物。在一项小鼠实验中,内毒素被证明可以减少过敏原对气道上皮细胞和树突状细胞的激活,在体外也可以通过诱导泛素修饰酶A20而减少人类支气管上皮细胞的激活[68]。
越来越多的证据表明,呼吸道免疫功能和肠道微生物群的免疫调节活动有关,被称为“肠-肺轴”。许多研究表明,生命早期是肠道微生物群失调可能导致许多呼吸系统疾病发展的最重要时期,因为肠道微生物群对免疫细胞的成熟和对病原体的抵抗有重要影响[62]。有趣的是,新的研究证明“肠-肺轴”是双向的,LPS刺激小鼠肺脏可以导致肠道内细菌数量显著增多,而且肺炎会诱发肠道损伤,并减少肠道上皮细胞的增殖[69]。
肺部和肠道微生物群对哮喘的发展、表型和严重程度都有影响,但分子机制还没有被完全描述清楚,这将是今后研究的热点。此外,关于益生菌对儿童哮喘的预防和治疗已经有文献报道,但是应用益生菌进行哮喘治疗的有效性仍需要深入研究。
综上,过敏性哮喘的发病机制涉及固有免疫和适应性免疫应答机制。此外,包括细胞外囊泡和微生物组学也参与其中。过去的十几年间,相关研究取得了很大的进步。随着精准医学概念的提出,越来越多的人开始关注如何做到疾病的精确诊断和治疗。深入研究过敏性哮喘的发病机制,对疾病的精确诊断具有重要意义,未来有望开发出新型治疗哮喘的药物。