基于两亲性超分子的共价水凝胶辅助蛋白折叠
2023-11-24王嘉鑫刘佳秦金梅NYVMondeleMbola孟子晖薛敏
王嘉鑫, 刘佳, 秦金梅, NYV Mondele Mbola, 孟子晖, 薛敏
基于两亲性超分子的共价水凝胶辅助蛋白折叠
王嘉鑫, 刘佳, 秦金梅, NYV Mondele Mbola, 孟子晖, 薛敏
(北京理工大学化学与化工学院, 北京 100190)
采用2-氨基-4-羟基-6甲基嘧啶(MIS)和1,6-己二异氰酸酯(HDI)合成了中间体2-(6-异氰酸酯己基脲)- 6-甲基-4[1]嘧啶酮(UPy-C6-NCO), 并引入4-羟基丁基丙烯酸酯(HBA), 合成了一种新型单体2-{6-[3-(6-甲基-4-氧代-1,4-二氢嘧啶-2-基)脲基]己烷氨甲酰氧基}丙烯酸丁酯(UPy-C6-HBA). 通过紫外光引发自由基聚合, 使UPy-C6-HBA和丙烯酰胺(AM)、,-亚甲基双丙烯酰胺(Bis)进行共聚, 制备了具有均匀多孔结构和高度溶胀性的物理化学双交联水凝胶. 将溶菌酶包埋在含UPy-C6-HBA单体的水凝胶基质中, 通过疏水作用辅助溶菌酶进行体外折叠复性研究. 结果表明, UPy-C6-HBA含量、 凝胶用量、 溶菌酶浓度和复性温度对复性效果均有影响. 当环境温度为25 ℃时, 含UPy-C6-HBA单体15%(质量分数)的水凝胶可以使0.25 mg/mL溶菌酶的复性率提高41%. 研究结果表明, 向凝胶体系中加入UPy-C6-HBA单体显著提高了溶菌酶的复性率, 对于高浓度变性溶菌酶的复性具有重要意义.
2-{6-[3-(6-甲基-4-氧代-1,4-二氢嘧啶-2-基)脲基]己烷氨甲酰氧基}丙烯酸丁酯; 超分子水凝胶; 蛋白质折叠; 溶菌酶
蛋白质的空间结构是由多肽长链通过分子内氢键和疏水作用主导, 在水中由线性自发折叠而成, 蛋白质的空间构型往往决定了其性质和功能[1,2]. 通过高浓度变性剂使蛋白质保持溶剂化防止其折叠, 当变性条件不剧烈时, 在适当条件下可以使变性的蛋白质恢复其天然构象和生物活性, 这一过程被称为蛋白质折叠或蛋白质复性[3]. 目前蛋白质的复性方法有透析复性、 化学试剂复性、 天然分子伴侣以及人工分子伴侣辅助复性等[4,5]. 由于大部分天然分子伴侣对折叠态蛋白具有特异性, 且辅助机制复杂, 因此生物友好、 结构可控的人工分子伴侣应运而生. 人工分子伴侣主要是通过模拟天然分子伴侣, 抑制蛋白质折叠中间体之间的不可逆聚集来促进蛋白质折叠. 有机硅介孔材料具有良好的生物相容性以及尺寸、 性质可控的孔道结构, 已经广泛应用于生物医药的研究[6]. Lu等[7]利用有机硅介孔材料独特的孔隙结构将溶菌酶封装到介孔通道内减少蛋白聚集, 通过聚乙烯醇诱导溶菌酶释放实现溶菌酶的折叠与复性. 然而这种有机硅材料制备流程复杂, 其孔道以及尺寸辅助折叠的机理并不明确, 多用于小分子蛋白质. 此外, 通过硅表面硅醇基团与溶菌酶氨基酸残基的静电相互作用捕获蛋白对环境的pH值和蛋白的种类有一定限制. 两亲性分子对和自组装纳米凝胶通过捕捉变性蛋白暴露出的疏水位点可以防止蛋白质产生聚集, 可用于辅助蛋白质折叠[8]. Hoshino等[9]以-异丙基丙烯酰胺(NIPAm)为骨架, 制备了一种表面易于官能化、 制备过程简便的纳米水凝胶颗粒, 其与变性溶菌酶具有强亲和力, 从而对其包封, 辅助其正确折叠, 释放低亲和力的天然溶菌酶, 实现了溶菌酶折叠的简单有效控释. 生物友好的两亲性超分子聚合物具有表面易于官能化、 结构可设计的特点, 能在溶剂中自组装构建胶束, 使其辅助蛋白质折叠成为可能[10]. Kameta等[11]通过两亲性超分子自组装纳米管水凝胶成功包封变性天然荧光绿色蛋白(GFP), 辅助其折叠. 该工作证明了超分子水凝胶因子作为有效的共佐剂在促进蛋白质折叠和增强蛋白质稳定性方面的潜力.
脲基嘧啶酮(UPy)是一种具有多个质子供体和受体的多功能超分子单元. 独特的结构使得UPy可以通过氢键作用与不同功能化分子组装成强可调控性和多功能性水凝胶[12,13]. UPy水凝胶具有易于官能团化、 高稳定性、 孔径可控制及生物相容性好等优点, 可以作为载体将药物等生物活性物质包封在水凝胶孔隙中, 并通过控制孔径及调节水凝胶结构等手段实现对药物的可控释放[14~16]. Muthuvijayan等[16]报道了一种氧化藻酸盐和明胶-脲基嘧啶酮(G-UPy)制备的自修复水凝胶用于软组织再生支架, 该水凝胶中具有UPy四重氢键阵列, 能够在界面处无缝自愈合. 基于UPy及其衍生物的超分子聚合物可以在不同的溶剂中通过氢键及疏水相互作用等非共价相互作用驱动自组装, 形成不同空间结构的材料, 已经被应用于药物传递、 组织修复和细胞培养等领域的研究[17,18].
溶菌酶能够破坏细菌细胞壁, 因此被广泛用于医药领域的抗菌药物研发中. 但溶菌酶的工业化生产一直受到折叠不完整和纯化困难等问题的制约. 本文旨在探究UPy超分子水凝胶对溶菌酶蛋白质折叠的辅助作用, 并优化辅助折叠的条件, 以提高其工业化生产效率和纯度. 本文使用不同浓度的UPy超分子水凝胶辅助溶菌酶蛋白质的折叠, 并研究其对蛋白质折叠和稳定化的影响. 基于UPy功能化单体制备的物理化学双交联水凝胶网络中含有丙烯酰胺(AM)主链、 四重氢键偶联UPy单元及疏水碳链, 与变性蛋白质有较强的结合力, 可以抑制其聚集, 因此适合用于协助蛋白质体外复性.
1 实验部分
1.1 试剂与仪器
丙烯酰胺(AM, A.R.级),,-亚甲基双丙烯酰胺(Bis, A.R.级)、 三羟甲基氨基甲烷(Tris, A.R.级)、 二硫苏糖醇(DTT)、 溶菌酶(20000 U/mg)、 磷酸(A.R.级, 质量分数85%)、 二月桂酸二丁基锡(DBTDL, 97.5%)、 2-氨基-4-羟基-6甲基嘧啶(MIS, A.R.级)、 1,6-己二异氰酸酯(HDI, A.R.级)和丙烯酸羟丁酯[HBA, A.R.级, 油水分配系数(lg)为0.68], 北京百灵威科技有限公司; 2-羟基-4'-(2-羟乙氧基)-2-甲基苯丙酮(Irgacure 2959, 纯度≥98%), 阿拉丁试剂(上海)有限公司; 二甲基亚砜(DMSO, A.R.级)、 十二水合磷酸氢二钠及考马斯亮蓝G-250, 江苏艾康生物医药研发有限公司; 尿素(A.R.级)和浓盐酸, 北京市通广精细化工公司; 乙二胺四乙酸(EDTA, A.R.级)、 谷胱甘肽还原型(GSH)、 谷胱甘肽氧化型(GSSG)以及溶壁微球菌, 生工生物工程(上海)股份有限公司.
CL-1000L型紫外交联仪, 美国UVP公司; AutoPore Ⅳ 9500型高性能全自动压汞仪, 麦克默瑞提克(上海)仪器有限公司; UV-2450型紫外-可见分光光度计(UV-Vis), 岛津国际贸易(上海)有限公司; J-1500型圆二色谱仪(CD), 佳斯科仪器(北京)有限公司; Zeiss Supra55型扫描电子显微镜(SEM), 蔡司(德国)集团; JASCO J-1500型圆二色谱仪, 日本分光株式会社; Thermo IS5型傅里叶变换红外光谱仪(FTIR), 美国赛默飞世尔科技公司; Bruker Ascend 700M型核磁共振波谱仪(NMR), 美国布鲁克公司.
1.2 2-{6-[3-(6-甲基-4-氧代-1,4-二氢嘧啶-2-基)脲基]己烷氨甲酰氧基}丙烯酸丁酯(UPy-C6-HBA)单体的合成
将2.77 g MIS和2.5 g HDI加入100 mL三口圆底烧瓶中, 在氮气氛围下于100 ℃搅拌24 h. 冷却至室温后, 加入50 mL正戊烷, 沉淀, 抽滤, 用过量正戊烷洗涤滤饼. 在50 ℃真空干燥箱中干燥16 h, 得到中间体2-(6-异氰酸酯己基脲)-6-甲基-4[1]嘧啶酮(UPy-C6-NCO)白色粉末, 产率为97%.
将2.3 g HBA和2.5 g UPy-C6-NCO加入500 mL三口烧瓶中. 加入200 mL干燥过的三氯甲烷, 以 约0.1 mL DBTDL为催化剂, 在氮气氛围下于60 ℃搅拌反应24 h. 过滤除去残余固体后, 旋转蒸发滤液至约50 mL. 将滤液滴入过量丙酮中, 静置沉淀, 抽滤. 用过量丙酮洗涤, 于50 ℃真空干燥16 h, 得到UPy-C6-HBA白色粉末, 产率为89%.
1.3 超分子水凝胶的制备
将一定量AM和UPy-C6-HBA溶于DMSO中, 加入光引发剂Irgacure 2959和交联剂Bis后通氮气除氧20 min, 以400 r/min的速度常温搅拌20 min. 将混合均匀的溶液转移至模具中, 用365 nm 紫外光照射1 h, 引发单体共聚形成凝胶网络. UPy-C6-HBA占总单体(UPy-C6-HBA+AM+Bis)的质量分数分别为0, 5%, 10%, 15%和20%. 将凝胶取出, 于纯水中进行溶剂置换5 d, 于-30 ℃冷冻干燥12 h, 凝胶分别命名为UCHG, 5%UCHG, 10%UCHG, 15%UCHG, 20%UCHG.
1.4 溶菌酶的变性和复性
配制含0.1 mol/L Tris、 8 mol/L尿素和30 mmol/L DTT, 且pH=8.5的还原变性缓冲液. 将一定量的天然溶菌酶溶于变性缓冲液中, 在37 ℃、 100 r/min摇床中孵育4 h, 制备还原变性溶菌酶. 配制含有0.1 mol/L Tris、 1 mmol/L EDTA、 10 mmol/L GSH和1 mmol/L GSSH的复性缓冲液, 用盐酸调节pH值为8.5. 将变性溶菌酶缓慢加入复性缓冲液中, 并加入一定量干燥的水凝胶, 置于一定温度、 转速为 100 r/min的摇床中复性.
1.5 超分子水凝胶辅助溶菌酶复性
固定复性温度为25 ℃、 变性溶菌酶浓度为0.25 mg/mL、 加入水凝胶与溶菌酶的质量比为20∶1.
使用考马斯亮蓝法测定溶菌酶的含量. 将100 mg考马斯亮蓝G-250溶解于50 mL 95%的乙醇中, 加入100 mL 85%的磷酸, 用去离子水定容至1 L. 用滤纸过滤试剂中沉淀的染料后储存于棕色瓶中. 配制100 μg/mL的天然溶菌酶溶液, 稀释成体积为1 mL的不同浓度(10, 20, 30, 40, 50和60 μg/mL)的蛋白溶液, 分别加入5 mL考马斯亮蓝G-250试剂, 充分混合后于20 min内在595 nm的检测波长下测定吸光度, 平行测试3次, 结果取平均值, 得到溶菌酶含量标准曲线. 使用比浊法测定溶菌酶的活性. 将20 mg溶壁微球菌溶解于50 mL 0.1 mol/L、 pH值为6.2的磷酸盐缓冲溶液(PBS)中, 于25 ℃水浴加热30 min, 得到底物溶液. 以PBS为参比溶液, 稀释底物溶液至吸光度为0.6~0.7. 取3 mL底物溶液, 用紫外-可见分光光度计测试450 nm处的吸光度, 记为0. 加入20 μL酶溶液, 充分混合1 min后测试吸光度, 记为. 平行测试3次, 结果取平均值. 根据下式计算溶菌酶比活力(, U/mg):

式中,(μg)为所加入酶液中酶的质量.
以复性后溶菌酶比活力与天然溶菌酶比活力的比值, 即复性率(AR, %)来表征复性效果, 按下式计算复性率:

式中,0(U/mg)和(U/mg)分别为天然溶菌酶及复性后溶菌酶的比活力.
2 结果与讨论
2.1 Upy衍生物的合成与表征
Scheme 1为单体的合成步骤示意图. MIS与HDI在100 ℃下进行亲核加成得到中间体UPy-C6-NCO. 在催化剂的作用下, HBA上的羟基进攻—NCO上的C原子, 得到UPy-C6-HBA.
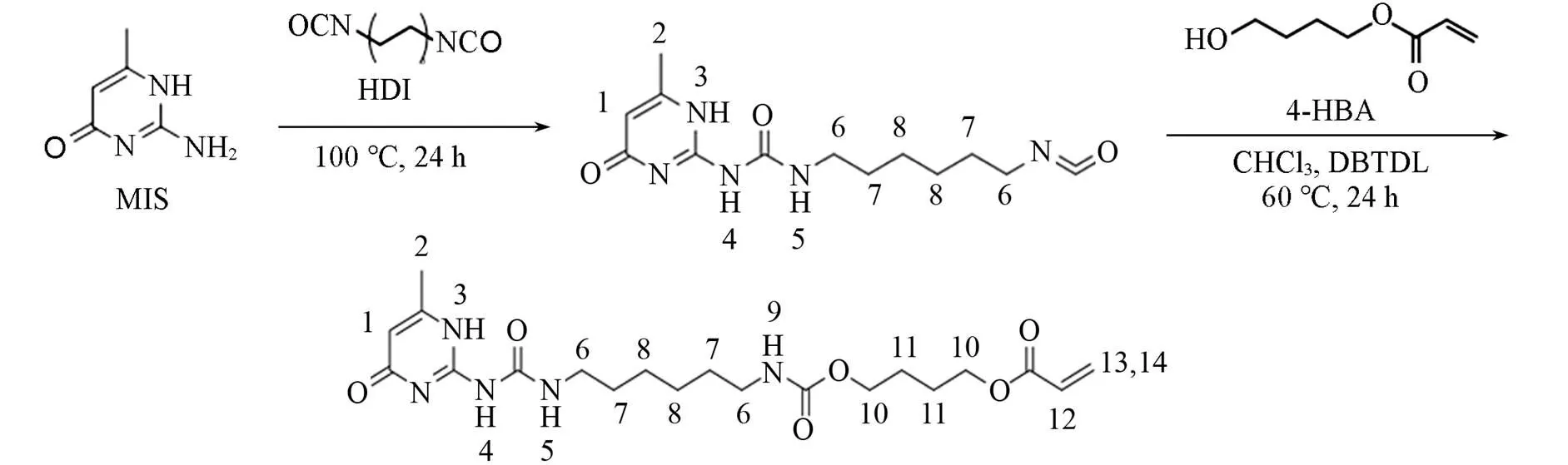
Scheme 1Synthesis route of UPy⁃C6⁃HBA
图1(A)为UPy-C6-NCO的核磁共振氢谱, 其中7.26处为氘代氯仿溶剂峰;13.10, 11.85和10.16处为UPy基团的特征峰. 图1(B)为UPy-C6-HBA的核磁共振氢谱, 其中13.06, 11.79和10.06处为UPy基团的特征峰. 在氘代氯仿溶剂中, UPy结构主要以二聚体的形式存在. 当分子形成氢键时, 氢键中质子周围的电子云密度降低, 使质子的信号明显地移向低场, 化学位移变大, 因此UPy-C6-HBA的核磁共振氢谱显示出低场的特征峰.

Fig.1 1H NMR spectra of UPy⁃C6⁃NCO(A) and UPy⁃C6⁃HBA(B)
图2为UPy-C6-NCO和UPy-C6-HBA的红外光谱图. 谱线中, 2283 cm-1处为UPy-C6-NCO中—NCO的特征峰; 在谱线中没有该吸收峰, 说明UPy-C6-NCO完全反应; 谱线在3319 cm-1处出现了一个新的吸收峰, 为—NHCOO—中N—H的伸缩振动, 说明成功合成了UPy-C6-HBA.

Fig.2 FTIR spectra of UPy⁃C6⁃NCO(a) and UPy⁃C6⁃HBA(b)
2.2 Upy-C6-HBA双交联水凝胶的表征
AM因其良好的溶解性以及可调控性, 已经被广泛用于多种水凝胶的制备[19]. AM与UPy-C6-HBA中的官能团进行反应, 形成稳定的交联结构. UPy是一种合成路线简单、 可提供自互补四重氢键实现聚合的结构单元. UPy与HDI通过亲核加成反应, 得到具有C6长链的UPy-C6-NCO, 引入具有碳碳双键以及羟基的4-HBA既可以提供化学交联的位点, 又增加了UPy衍生物的亲水性, 有利于增强水凝胶的溶胀性能. 由Scheme 2可见, 以Bis为化学交联剂, AM和UPy-C6-HBA为单体, 通过光引发聚合制备了一种双交联水凝胶. 在该结构中, UPy-C6-HBA之间通过形成四重氢键实现了物理交联.

Scheme 2Synthesis of UPy⁃C6⁃HBA hydrogel
由图3可看出, 本文制备的5%UCHG和10%UCHG水凝胶均具有大量松散、 均一的微米级孔径.

Fig.3 SEM images of 5%UCHG(A) and 10%UCHG(B)
图4给出不同UPy-C6-HBA含量的水凝胶的总孔体积和总孔表面积(A)以及平均孔径和孔隙率(B). UPy-C6-HBA质量分数为5%的水凝胶孔径约为6.9 μm, 当UPy-C6-HBA质量分数增加到10%时, 水凝胶孔径下降到约4.9 μm. 这是因为UPy-C6-HBA提供了分子间四重氢键作用(Scheme 2内插图), 作为凝胶网络的物理交联点, 随着UPy-C6-HBA含量增加, 水凝胶形成交联更加紧密的结构, 从而导致更小的凝胶孔隙与总孔体积以及更大的总孔表面积.

Fig.4 Cumulative pore volume, total pore area(A) and pore diameter, porosity(B) of UPy⁃C6⁃HBA hydrogel containing 5%, 10%, 15% and 20% UPy⁃C6⁃HBA
2.3 Upy-C6-HBA水凝胶辅助溶菌酶复性
溶菌酶变性后三维结构被破坏, 暴露出大量疏水残基, 经过一系列的中间态, 缓慢折叠为天然态结构. 复性过程主要涉及蛋白分子内相互作用. 同时溶菌酶折叠中间体显示出很强的聚集倾向, 这一过程主要涉及分子间疏水作用. 溶菌酶的聚集与正确折叠互相竞争, 阻碍了溶菌酶的复性, 因此有效地抑制溶菌酶分子间的疏水相互作用是促进溶菌酶正确折叠、 提高复性率的关键. UPy经过烷基修饰引入凝胶结构中后, UPy具有氨基, 亲水性强, 可形成四重氢键, 而烷基链具有疏水性, 两者在凝胶结构中形成双亲微环境. 在复性过程中加入冷冻干燥的水凝胶, 变性溶菌酶随着水凝胶的溶胀进入凝胶网络内部. 由于凝胶网络中的疏水链段与变性溶菌酶的疏水作用比变性溶菌酶之间的疏水作用更强, 变性溶菌酶优先与凝胶网络中的疏水链段结合, 抑制了溶菌酶分子间的聚集. 同时, 变性溶菌酶的亲水部分可在UPy附近得到稳定, 超分子UPy有效地阻止了被吸附变性溶菌酶之间的相互作用, 为变性溶菌酶实现重新折叠提供了微环境. Hoshino等[9]证明以具有合适疏水作用的凝胶材料辅助变性溶菌酶复性, 有利于降低其复性的能垒, 使蛋白重新恢复到具有较低能量的自然状态. 与疏水链段结合的变性溶菌酶在分子内相互作用下折叠为天然态溶菌酶, 其疏水残基位于分子内部, 与水凝胶的疏水作用减弱, 因此可以自动脱离. 同时, 一部分变性溶菌酶进入凝胶网络使得复性缓冲液中的变性溶菌酶浓度降低, 有利于提高溶菌酶的复性率. 由Scheme 3可见, 超分子水凝胶吸水溶胀后, 内部凝胶网络通过疏水相互作用捕获变性溶菌酶, 防止其聚集. 溶菌酶复性时疏水链向内折叠, 蛋白与水凝胶网络的相互作用减弱而被释放到溶液中.

Scheme 3Proteins refolding by UPy⁃C6⁃HBA hydrogel
图5是水凝胶在25 ℃下的溶胀曲线, 反映了水凝胶在微观层面的高分子链段变化. 由图5可见, 水凝胶的溶胀过程整体较为缓慢. 开始时由于水凝胶内外渗透压的差异, 水分子快速向水凝胶网络渗透, 水凝胶快速溶胀, 4 min时达到了平衡溶胀倍率的一半. 之后溶胀速率放缓, 55 min后达到溶胀平衡. 这是因为高分子链段的伸展引起凝胶的弹性变形, 伸展到一定程度时会产生弹性收缩力使水凝胶网络收缩, 当溶剂分子的渗透引起的伸展和弹性变形引起的收缩这两种趋势抵消时, 水凝胶就达到了溶胀平衡状态. 在相同条件下, 水凝胶中UPy-C6-HBA含量越高, 水凝胶的溶胀倍率越低, 相应的平衡含水量也越低. 与不含UPy-C6-HBA的对照样品相比, 当UPy-C6-HBA质量分数提高到20%时, 水凝胶的溶胀倍率由20.2倍降低为8.4倍, 平衡含水量也随之降低. 这是因为UPy-C6-HBA分子间通过氢键作用形成二聚体提供物理交联, 同时分子上的疏水链段间产生疏水作用, 使水凝胶形成交联更加致密的网络, 阻碍水分子向凝胶内部的扩散.

Fig.5 Swelling curves of different hydrogels with different mass fraction of UPy⁃C6⁃HBA
对溶菌酶进行圆二色谱分析, 实验扫描速度为200 nm/min, 扫描步长为0.5 nm. 在图6中, 200~250 nm为远紫外区, 信号峰主要是由C—N键的→跃迁和C=O键的→跃迁引起的, 可用于表征蛋白质二级结构中肽键的排布信息. 208和222 nm处的负峰为-螺旋的特征峰, 216 nm处 的负峰为-折叠的特征峰. 可见, 稀释复性和Upy-C6-HBA水凝胶协助复性后的溶菌酶螺旋的含量降低,折叠的含量升高. 但与稀释复性相比, 加水凝胶协助复性后的溶菌酶的二级结构更接近天然态溶菌酶.

Fig.6 CD spectra of lysozymes
2.4 UPy-C6-HBA含量和水凝胶加入量对复性效果的影响
UPy-C6-HBA含量对水凝胶的孔隙大小有显著影响, 探究了不同UPy-C6-HBA含量水凝胶对于溶菌酶复性的影响. 固定复性温度25 ℃、 变性溶菌酶浓度为0.25 mg/mL、 加入水凝胶与溶菌酶质量比为 20∶1的条件不变, 制备了UPy-C6-HBA质量分数分别为0, 5%, 10%, 15%和20%的水凝胶, 探究了水凝胶中UPy-C6-HBA含量对复性效果的影响.
由图7(A)可见, 溶菌酶的复性率随水凝胶中UPy-C6-HBA含量的增加先升高后降低, 在UPy-C6-HBA质量分数为15%时复性率最大. 疏水作用[20]是蛋白质折叠的主要驱动力, 溶菌酶折叠中间体的疏水残基通过疏水作用与UPy-C6-HBA的疏水碳链结合, 从而阻止变性的溶菌酶分子之间相互作用形成聚集体, 促进折叠向正确方向进行. 但当水凝胶的疏水性太强时, 不利于溶菌酶折叠中间体进一步折叠为天然态[21]; 当UPy-C6-HBA的添加量为20%时, 凝胶孔径约为0.3 μm[图4(B)], 而变性溶菌酶聚集体的水力学直径大于1 μm[9], 此时变性溶菌酶聚集体并不能通过孔隙进入凝胶内部与其进行充分的相互作用, 两者作用只发生在凝胶表面, 故复性率有所下降. 当水凝胶中不含UPy-C6-HBA时, 溶菌酶的复性率接近相同条件下稀释复性方法的复性率, 说明在加水凝胶协助复性过程中凝胶网络中的疏水性UPy-C6-HBA起主要作用.

Fig.7 Effects of UPy⁃C6⁃HBA content on lysozyme renaturation(A) and effect of addition amount of 15%UPy⁃C6⁃HBA hydrogel on lysozyme renaturation(B)
由图7(B)可知, 随着水凝胶加入量的增加, 溶菌酶的复性率逐渐增加, 当水凝胶加入量达到溶菌酶的20倍时复性率最大, 之后继续增加水凝胶的量, 溶菌酶的复性率趋于平稳. 这是因为水凝胶网络中的疏水链段聚集形成疏水区域, 通过与暴露在外的疏水残基的疏水作用捕获溶菌酶折叠中间体, 从而抑制溶菌酶分子间通过疏水作用而聚集, 促进溶菌酶的正确折叠. 凝胶加入量较少时, 可提供的疏水位点也较少, 随着水凝胶加入量的增加, 疏水位点增加, 溶菌酶的复性率也随之增加. 当水凝胶加入量达到一定值时, 水凝胶已经提供了足够的疏水位点与变性溶菌酶结合, 继续增大水凝胶加入量不会对复性产生太大影响.
2.5 溶菌酶复性条件优化
固定变性溶菌酶的初始浓度为10 mg/mL, 分别用复性缓冲液稀释10, 12.5, 20和40倍得到终浓度为1.00, 0.80, 0.50和0.25 mg/mL的溶菌酶溶液, 在25 ℃、 加入水凝胶(UPy-C6-HBA质量分数为15%)与溶菌酶质量比为20∶1的条件下探究溶菌酶浓度对复性效果的影响, 以纯稀释复性作为对照组, 实验结果如图8所示.

Fig.8 Influence of lysozyme concentration on the renaturation effect
Different lowercase letters mean significant diffe-rences among different concentration of lysozyme in the same treatment(<0.01), asterisks indicate significant differences between different treatment methods at the same concentration(<0.01).
由图8可见, 随着溶菌酶浓度的增加, 其复性率降低. 这是因为溶菌酶浓度越高, 分子间发生碰撞的几率也越高, 溶菌酶折叠中间体之间的聚集反应加快, 不利于蛋白质的正确折叠. 与稀释复性相比, 溶菌酶的浓度越高, 加入水凝胶对复性效果的提升越大. 加水凝胶协助复性方法对高浓度变性蛋白的复性有重要意义. 同时对结果进行显著性差异统计分析, 在相同辅助折叠的条件下, 不同溶菌酶浓度的复性率结果具有统计学差异(<0.01); 不同辅助折叠方法对应的复性率结果也存在非常显著的统计学差异(<0.01), 说明采用凝胶辅助蛋白复性的方法会对复性率结果产生显著的提升.
固定溶菌酶浓度为0.25 mg/mL、 加入水凝胶(UPy-C6-HBA质量分数15%)与溶菌酶质量比为20∶1的条件不变, 分别在不同温度下进行溶菌酶复性实验, 探究复性温度对复性效果的影响.

Fig.9 Effect of temperature on lysozyme renaturation
由图9可见, 溶菌酶的复性率随复性温度的升高先升高后降低, 在25 ℃时复性效果最佳. 蛋白质的正确折叠与聚集是两个竞争反应, 当温度升高时, 两个反应都会加速. 由于蛋白质的正确折叠遵从一级反应动力学, 而蛋白质的聚集过程遵从二级或更高级宏观反应动力学, 因此聚集反应速率增加得更快, 从这一角度来说低温更利于蛋白质的复性. 但当温度较低时, 溶菌酶分子的扩散速度减慢, 不利于其与水凝胶的结合和解离, 反而导致复性率的降低.
3 结 论
首先合成了一种具有Upy四重氢键结构单元、 疏水碳链和双键端基的新型单体UPy-C6-HBA. 将该单体以不同比例加入聚丙烯酰胺(PAM)水凝胶配方中, 制备了具有均匀多孔结构、 高度溶胀的物理化学双交联网络水凝胶, 用以辅助溶菌酶进行体外折叠复性. 使用UPy-C6-HBA的水凝胶通过疏水作用将溶菌酶包埋在凝胶基质中, 重新折叠的溶菌酶具有天然构象和酶活性. 考察了UPy-C6-HBA含量、 凝胶用量、 溶菌酶浓度、 复性温度对复性效果的影响, 得到最佳复性条件. UPy-C6-HBA水凝胶使溶菌酶的复性率得到了较大提升, 特别是对于高浓度变性溶菌酶的复性有重要意义.
[1] Bolen D. W., Rose G. D.,, 2008,(1), 339—362
[2] Su L. L., Shao X. G., Cai W. S.,, 2023,(4), 20220745(粟李醴, 邵学广, 蔡文生. 高等学校化学学报, 2023,(4), 20220745)
[3] Curtis R., Austerberry J., Holloway L.,, 2019,, 860—878
[4] Yamaguchi H., Miyazaki M.,, 2014,(1), 235—251
[5] Wang Y., Oosterwijk N. V., Ali A. M., Adawy A., Anindya A. L., Dömling A. S. S., Groves M. R.,, 2017,(1), 9345—9355
[6] Wang X., Lu D., Austin R., Agarwal A., Mueller L. J., Liu Z., Wu J., Feng P.,, 2007,, 5735—5739
[7] Lu J., Liong M., Li Z., Zink J. I., Tamanoi F.,, 2010,(16), 1794—1805
[8] Singh N., Nisha V.,, 2013,, 271—276
[9] Nakamoto M., Nonaka T., Shea K. J., Miura Y., Hoshino Y.,, 2016,(13), 4282—4285
[10] Tandon S., Horowitz P. M.,, 1987,(10), 4486—4491
[11] Kameta N., Masuda M., Shimizu T.,, 2012,(6), 5249—5258
[12] Skopinska W., Flor J. S., Kozlowska J.,, 2021,(14), 7402
[13] Shi Z., Wang Q., Li G. F., Shou Y. F., Zong H. J., Yan S. F., Zhang K. X., Yin J. B.,, 2021,(3), 327—336
[14] Lim J. Y. C., Lin Q., Xue K., Loh X. J.,, 2019,, 100021
[15] Mol E. A., Lei Z., Roefs M. T., Bakker M. H., Goumans M. J., Doevendans P. A., Dankers P. Y. W., Vader P., Sluijter J. P. G.,, 2019,(20), e1900847
[16] Balavigneswaran C. K., Muthuvijayan V.,, 2021,(6), 5362—5377
[17] Mes T., Serrero A., Bauer H. S., Cox M. A. J., Bosman A. W., Dankers P. Y. W., Meijer E. W.,, 2022,, 175—187
[18] Webber M. J., Dankers P. Y. W.,, 2019,(1), e1800452
[19] Gao T. T., Li Z. Y., Gao G., Liu F. Q.,., 2016,(9), 1744—1749(高婷婷, 李志英, 高歌, 刘凤岐. 高等学校化学学报, 2016,(9), 1744—1749)
[20] Ma S. H., An Y. L., Wang J. Z., Song Y. Q., Liu Y., Shi L. Q.,, 2017,(10), 10549—10557
[21] Takeda S., Takahashi H., Sawada S., Sasaki Y., Akiyoshi K.,., 2013,, 25716
Protein Folding Assisted by Covalent Hydrogel Based on Amphiphilic Supramolecular
WANGJiaxin, LIUJia, QINJinmei, NYVMondele Mbola, MENGZihui, XUEMin*
(,,100190,)
A novel monomeric species, 2-{6-[3-(6-methyl-4-oxo-1,4-dihydropyrimidin-2-yl)ureido]hexylcarbamoyloxy} butyl acrylate(UPy-C6-HBA), was synthesized while 4-hydroxybutyl acrylate(HBA) was introduced to the intermediate compound 2-(6-isocyanatohexyl ureido)-6-methyl-4[1] pyrimidinone(UPy-C6-NCO) which was obtained through the reaction of 2-aminomethyl-4-hydroxy-6-methylpyrimidine(MIS) with 1,6-hexane diisocyanate(HDI). UPy-C6-HBA together with acrylamide(AM) and,'-methylenediacrylamide(Bis) was polymerized by UV-induced free radical polymerization method, yielding physically crosslinked hydrogels that possessed a homogenous porous architecture and pronounced swelling capacity. Lysozyme was incorporated within the hydrogel matrix containing UPy-C6-HBA monomer whichrefolding was facilitatedhydrophobic interactions. The effects of UPy-C6-HBA concentration, hydrogel dosage, lysozyme concentration and refolding temperature on the refolding rate of lysozyme were meticulously investigated. Remarkably, the supramolecular hydrogel comprising UPy-C6-HBA at a mass fraction of 15% exhibited a remarkable 41% enhancement in the refolding rate of lysozyme at 25 ℃ compared with the control. These findings unequivocally demonstrate the addition of UPy-C6-HBA monomer to the hydrogel matrix significantly improved the refolding rate of lysozyme, which is of great significance for the refolding of high concentration denatured lysozyme.
2-{6-[3-(6-Methyl-4-oxo-1,4-dihydropyrimidin-2-yl)ureido]hexylcarbamoyloxy}butyl acrylate; Supramolecular dual-crosslinked hydrogels; Protein folding; Lysozyme
2023-05-25
薛 敏, 女, 博士, 副教授, 主要从事功能高分子材料和纳米水凝胶“人工抗体”材料方面的研究. E-mail: minxue@bit.edu.cn
国家自然科学基金(批准号: 21874009)资助.
O633
A
10.7503/cjcu20230250
2023-07-29.
Supported by the National Natural Science Foundation of China(No.21874009).
(Ed.: W, K, M)
