瘀血痹胶囊联合托法替布治疗类风湿关节炎的临床研究
2023-11-24张艳王明杰徐风金薛燕
张艳,王明杰,徐风金*,薛燕
1.衡水市人民医院 风湿免疫科,河北 衡水 053000
2.衡水市人民医院 全科医学科,河北 衡水 053000
类风湿关节炎是可发生于各年龄段、以侵蚀性关节炎为特征、在我国发病率约为0.42%的自身免疫性疾病[1]。该病女性与男性患者比例约为4∶1,典型症状为关节疼痛、发僵、肿胀等,随着病程延长,由骨破坏和关节畸形导致的残疾率可达60%以上,同时还会累及心血管、血液、神经、呼吸系统和肝肾、眼部等全身多个组织和器官,并常伴有不同程度的焦虑、抑郁情绪,严重降低患者社会参与度及生活质量[2]。目前类风湿关节炎难以治愈,主要通过应用抗炎药、改善风湿病情药物(DMARDs)等,以达到最大程度降低疾病活动度和骨损伤、减少全身并发症的治疗目标[3]。传统DMARDs 治疗能获得的临床缓解比例仍有限,近年来随着新作用机制抗风湿药的研发,靶向合成DMARDs 应用于本病的治疗成为研究热点。作为Janus 激酶(JAK)抑制剂,托法替布能抑制免疫炎症效应、缓解关节疼痛和肿胀等症状,是治疗类风湿关节炎的新型靶向合成DMARDs[4]。同时考虑长期使用靶向合成DMARDs 的安全性,联合使用中药以减少前者的使用量及提高整体达标率是当前重要的治疗策略。瘀血痹胶囊为中药制剂,有活血化瘀、通络止痛之效,对瘀血阻络型类风湿关节炎有良效[5]。故而本研究将瘀血痹胶囊与托法替布联用治疗类风湿关节炎,取得了较好的临床疗效。
1 资料与方法
1.1 一般资料
选取2021 年1 月—2022 年12 月衡水市人民医院收治的112 例类风湿关节炎患者,其中男29 例,女83 例;年龄26~65 岁,平均(47.53±9.11)岁;病程0.7~9 年,平均(3.47±1.05)年;疾病活动度:中度74 例,重度38 例。
纳入标准:(1)纳入患者均符合类风湿关节炎的诊断标准[6];(2)1 年内无生育要求;(3)自愿签订知情同意书;(4)以C 反应蛋白(CRP)计算的28 个关节疾病活动度(DAS28-CRP)>2.6,即疾病处于活动期;(5)年龄20~65 岁;(6)近期无抗炎、止痛药物及生物制剂等相关用药史;(7)无托法替布使用禁忌证。
排除标准:(1)合并系统性红斑狼疮、系统性血管炎等其他自身免疫性疾病;(2)伴有心肝肾等重要脏器功能障碍;(3)确诊为痛风性关节炎、银屑病关节炎等有类似症状的其他疾病;(4)存在血液系统疾病或感染性疾病;(5)关节严重畸形或生活不能自理;(6)对瘀血痹胶囊中任何成分过敏;(7)存在恶性肿瘤或精神疾病。
1.2 药物
瘀血痹胶囊由辽宁上药好护士药业(集团)有限公司生产,规格0.4 g/粒,产品批号2011158、2108096、2 204037;枸橼酸托法替布片由正大天晴药业集团南京顺欣制药有限公司生产,规格5 mg/片,产品批号20201043、20210714、20220509。
1.3 分组和治疗方法
按随机数字表法将患者分为对照组和治疗组,每组各56 例。其中对照组男13 例,女43 例;年龄27~65 岁,平均(47.88±9.32)岁;病程0.7~9 年,平均(3.32±1.01)年;疾病活动度:中度35 例,重度21 例。治疗组男16 例,女40 例;年龄26~63岁,平均(46.96±8.85)岁;病程0.7~9 年,平均(3.63±1.12)年;疾病活动度:中度39 例,重度17例。两组资料比较差异无统计学意义,有可比性。
患者均采取禁烟、指导功能锻炼、加强营养、心理干预、注意休息等相同的一般措施。对照组口服枸橼酸托法替布片,5 mg/次,2 次/d。治疗组在对照组基础上口服瘀血痹胶囊,6 粒/次,3 次/d。两组疗程均为12 周。
1.4 临床疗效判定标准[7]
以美国风湿病学会(ACR)制定的ACR20、50、70 标准进行临床疗效评估,评价标准为:(1)压痛关节数改善率;(2)肿胀关节数改善率;(3)5 项重要指标[医生对疾病活动度的评分、健康评估问卷评分、CRP 和动态红细胞沉降率(ESR)数值、患者对疼痛和疾病活动度的评价]中≥3 项的改善率;各项指标改善率以“治疗前后差值/治疗前值×100%”计算。ACR20:以上3 条评价标准的改善率均≥20%;ACR50:以上3条评价标准的改善率均≥50%;ACR70:以上3 条评价标准的改善率均≥70%。
达标率=达标例数/总例数
1.5 观察指标
1.5.1 相关积分 视觉模拟量表(VAS):评分范围0~10 分,随评分增加表示关节疼痛越强烈[8]。DAS28-CRP:用以评价疾病活动度,数值越高则活动度越高;计算公式为0.56×sqrt(TJC28)+0.28×sqrt(SJC28)+0.36×ln(CRP+1)+0.014×GH+0.96,其中TJC28、SJC28、GH 分别表示压痛关节数、肿胀关节数、总体健康评分[9]。多维健康评估问卷(MDHAQ):共包含患者自评关节疼痛数、躯体功能、整体健康评估、心理状态、疼痛等10 个维度,完成问卷后计算受试者数据指标常规评估值,组成维度包括躯体功能(10 个条目,采用4 点李克特式评估)、整体健康评估和疼痛(各含1 个条目,采用VAS 评估),评分范围0~50 分,分值愈高则患者病情愈重[10]。影像学Sharp 评分标准:根据患者双手X 线片检查结果,将每只手与腕的17 个评分点(即骨侵蚀评分)和18 个评分点(即关节间隙狭窄评分)分别计0~5 分和0~4 分,评分越高则关节破坏越严重[11]。
1.5.2 主要症状、体征情况 统计两组治疗前后晨僵时间、压痛及肿胀关节数。
1.5.3 ESR 治疗前后运用ESR-2040 型血沉分析仪(重庆天海医疗)测定患者ESR 水平。
1.5.4 血小板与淋巴细胞比值(PLR)治疗前后选用HA-360 型血细胞分析仪(杭州艾康生物)对患者行血常规检查,根据结果计算PLR。
1.5.5 血清细胞因子水平 采集两组患者治疗前后5 mL 空腹静脉血,离心分离血清;使用AU5800 型生化分析仪(美国Beckman Coulter 公司),以免疫比浊法(试剂盒购自浙江东瓯诊断)检测血清CRP水平;运用MR-96T 型酶标仪(深圳迈瑞生物),以酶联免疫法(试剂盒购自上海江莱生物)测定血清白细胞介素-8(IL-8)、血管生成素样蛋白 4(ANGPTL4)水平,操作均按试剂盒说明书进行。
1.6 不良反应观察
记录患者在治疗过程中发生的药物相关不良反应情况。
1.7 统计学分析
使用SPSS 27.0 统计软件包处理数据,计量资料、计数资料分别以、百分比表示,分别行t、χ2检验。
2 结果
2.1 两组临床疗效比较
治疗后,治疗组患者ACR20、ACR50 达标率分别为82.14%、48.21%,较对照组的64.26%、28.57%均显著提高(P<0.05);治疗组ACR70 达标率为19.64%,高于对照组的12.5%,但差异无统计学意义,见表1。
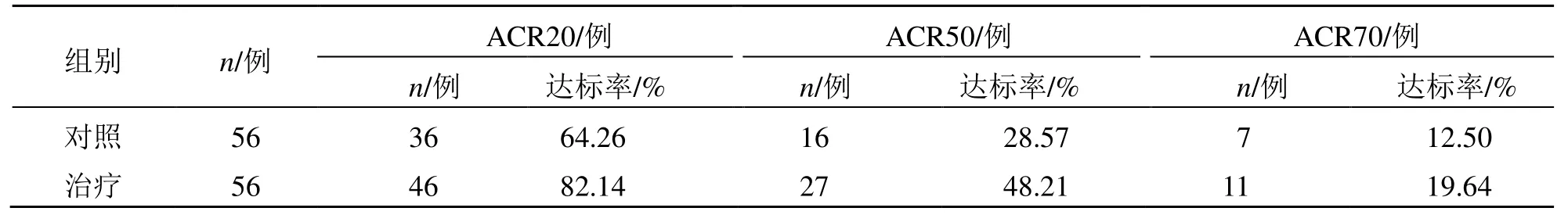
表1 两组临床疗效比较Table 1 Comparison on clinical efficacy between two groups
2.2 两组主要症状、体征情况比较
治疗后,两组关节疼痛VAS 评分、压痛和肿胀关节个数均较治疗前显著降低,晨僵时间显著缩短(P<0.05);且均以治疗组改善更显著(P<0.05),见表2。
表2 两组主要症状、体征情况比较()Table 2 Comparison on main symptoms and signs between two groups ()

表2 两组主要症状、体征情况比较()Table 2 Comparison on main symptoms and signs between two groups ()
与同组治疗前比较:*P<0.05;与对照组治疗后比较:▲P<0.05*P <0.05 vs same group before treatment;▲P <0.05 vs control group after treatment
2.3 两组DAS28-CRP、MDHAQ 和影像学Sharp评分比较
治疗后,两组DAS28-CRP 评分、MDHAQ 评分均显著降低,而Sharp 评分显著升高(P<0.05);治疗后,治疗组DAS28-CRP 评分、MDHAQ 评分、Sharp 评分低于对照组(P<0.05),见表3。
表3 两组DAS28-CRP、MDHAQ 和影像学Sharp 评分比较()Table 3 Comparison on DAS28-CRP,MDHAQ,and imaging sharp scores between two groups ()
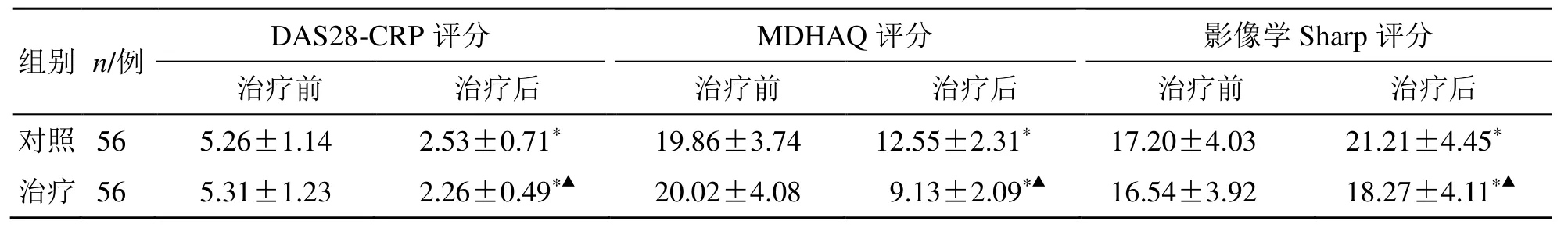
表3 两组DAS28-CRP、MDHAQ 和影像学Sharp 评分比较()Table 3 Comparison on DAS28-CRP,MDHAQ,and imaging sharp scores between two groups ()
与同组治疗前比较:*P<0.05;与对照组治疗后比较:▲P<0.05*P <0.05 vs same group before treatment;▲P <0.05 vs control group after treatment
2.4 两组全血ESR、PLR 和血清CRP、IL-8、ANGPTL4 水平比较
治疗后,两组全血ESR、PLR 和血清CRP、IL-8、ANGPTL4 水平均显著下降(P<0.05);且治疗后,治疗组全血ESR、PLR 和血清CRP、IL-8、ANGPTL4水平均显著低于对照组(P<0.05),见表4。
表4 两组全血ESR、PLR 和血清CRP、IL-8、ANGPTL4 水平比较()Table 4 Comparison on whole blood ESR,PLR,and serum CRP,IL-8,and ANGPTL4 levels between two groups ()
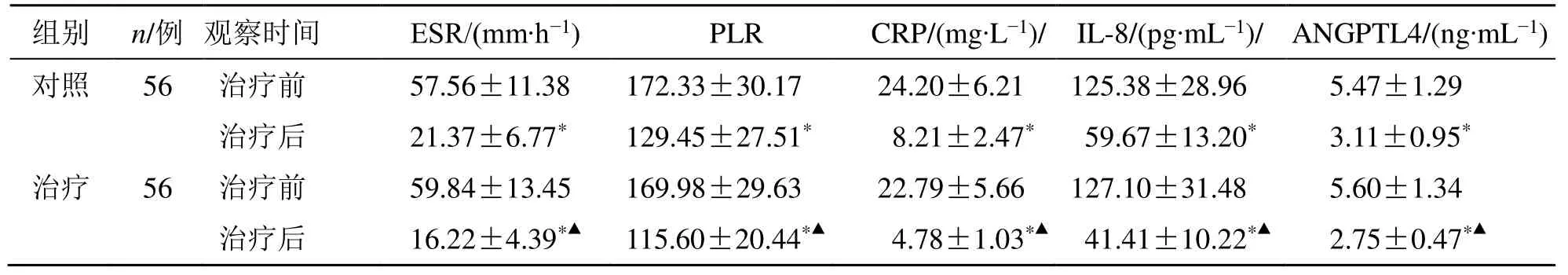
表4 两组全血ESR、PLR 和血清CRP、IL-8、ANGPTL4 水平比较()Table 4 Comparison on whole blood ESR,PLR,and serum CRP,IL-8,and ANGPTL4 levels between two groups ()
与同组治疗前比较:*P<0.05;与对照组治疗后比较:▲P<0.05*P <0.05 vs same group before treatment;▲P <0.05 vs control group after treatment
2.5 两组不良反应比较
对照组患者发生头痛2 例,上呼吸道感染、血压轻度升高、鼻咽炎各1 例,不良反应发生率是8.93%;治疗组发生上呼吸道感染、腹泻各2 例,头痛、血压轻度升高、鼻咽炎各1 例,不良反应发生率是12.50%,两组不良反应发生率比较差异无统计学意义。
3 讨论
类风湿关节炎是造成巨大社会与家庭经济负担的常见疾病,其以关节滑膜炎症为主要病理基础,目前病因尚处于探索阶段,可能与免疫、遗传、感染等因素有关。该病的病理机制具备自身免疫性疾病的共同特点,即由多种免疫细胞和炎症因子介导,长期的慢性炎症累及关节软骨和骨骼,导致滑膜衬里细胞增生、微血管和血管翳形成、间质炎性细胞浸润等病理改变,最终引起关节畸形和功能丧失[12]。目前针对类风湿关节炎的治疗主要依赖药物,总体目标为改善关节肿痛症状、降低致残率、延缓疾病进展及改善患者生活质量,早期治疗与达标治疗是临床最重要的治疗策略。近年来,该病治疗药物突飞猛进的发展不仅给患者提供了更多选择,亦较大程度促进了患者病情控制和预后改善。托法替布是靶向JAK 的小分子药物,主要通过干扰细胞外促炎症细胞因子向核内传导炎性信号的重要通路JAK/信号转导与转录激活因子信号通路,作用于细胞因子网络的核心部分,从而抑制免疫和炎性反应,发挥干预类风湿关节炎的作用[13]。本品相较传统DMARDs 起效更快、疗效更佳,与生物制剂疗效相当却具有可口服的优势。然而托法替布对JAK亚型的选择性较差,可引发等血脂异常、感染等严重不良反应;且在现有治疗方案下,我国类风湿关节炎患者的病情有效控制率仍不甚理想。
中医药治疗类风湿关节炎较西药方案虽无突破性优势,但二者联合不仅可促进症状改善和疗效提升,还能减少药物不良反应,利于长期维持治疗[14-15]。中医学将类风湿关节炎归为“痹病”等范畴,认为该病多由素体亏虚、风寒湿等外邪侵袭,正气不足无力驱邪外出,以致血行不畅,瘀血流注痹阻关节经络所引起。治疗应以“活血通络、化瘀定痛”为主。瘀血痹胶囊属于理血剂,主要是由乳香、红花、威灵仙、香附、当归等11 味中药材精制而成,具有祛风除湿、活血养血、破血行气、化瘀通络、消肿止痛等功效,恰中类风湿关节炎瘀血阻络证之中医核心病机要点。现代药理学研究表明,瘀血痹胶囊含有槲皮素、木犀草素、β-谷甾醇等多种活性成分,可通过作用于炎症、激素分泌、脂质氧化、中枢神经系统等相关通路,发挥良好的抗炎、抑制滑膜增生、调节破骨/成骨平衡、干扰滑膜基质降解及镇痛等效果[16]。邬亚军等[17]报道显示,瘀血痹胶囊能有效提高类风湿关节炎瘀血痹阻证患者的中医证候疗效,改善临床症状、握力及ESR、类风湿因子等实验室指标,且无明显不良反应。本研究利用瘀血痹胶囊治疗类风湿关节炎,结果显示,其与托法替布联合的治疗组ACR20、ACR50 达标率分别为82.14%、48.21%,较单用托法替布的对照组(64.26%、28.57%)均显著提高;且治疗后治疗组关节疼痛、晨僵等主要症状、体征及DAS28-CRP、MDHAQ 评分的改善效果均显著优于对照组,治疗后治疗组影像学Sharp 评分的增加幅度明显小于对照组。另外,从安全性方面分析,治疗组不良反应发生率无明显增加,表明瘀血痹胶囊联合托法替布治疗类风湿关节炎是安全有效的,能有效延缓患者关节破坏、改善整体功能。
类风湿关节炎是由炎性细胞浸润及其释放的炎性介质所引起,炎性反应发挥了重要作用,贯穿疾病始终。ESR 是反映炎症活动的重要指标,类风湿关节炎患者机体中γ-巨球蛋白、纤维蛋白原等带电荷分子可引起ESR 水平上升,病变活动度越高,ESR 增幅也越大[18]。作为新型炎症标志物,PLR 可从血常规检查中方便、快速获取,其中血小板除止血作用外,还可释放各种炎症因子而加重滑膜炎症,在炎症活动期其水平反射性增高;同时此类患者外周血淋巴细胞数量减少可能与T 淋巴细胞向受累滑膜部位聚集有关,T、B 淋巴细胞可分别通过与其他炎症细胞相互作用和产生类风湿因子而诱发炎症、导致滑膜损伤;故PLR 对评估疾病活动度及全身炎性状态具有一定价值[19]。CRP 是临床广泛使用的炎症指标,其上升速度、持续时间、幅度与类风湿关节炎病情及组织损伤严重程度密切相关,能较为灵敏可靠的反映疾病活动、关节功能及治疗情况[20]。IL-8 主要由巨噬细胞和滑膜细胞分泌,属趋化因子家族的细胞因子之一,可通过趋化和激活中性粒细胞并促使其产生呼吸爆发,从而加强关节炎炎症的循环、加重全身血管炎病变[21]。ANGPTL4 是与血管生成素有相似结构的分泌性蛋白,主要表达于白色脂肪组织、骨骼肌、肝脏等,其在类风湿关节炎活动期水平明显上升,可能通过诱导内皮细胞增殖、增强巨噬细胞活性、拮抗成骨细胞增殖分化、刺激破骨细胞活化等途径,参与滑膜炎和血管翳的病理过程及介导骨破坏,ANGPTL4 可作为判断疾病活动与骨破坏的新指标[22]。本研究对类风湿关节炎患者治疗前后全血ESR、PLR 和血清CRP、IL-8、ANGPTL4 水平变化进行观察,结果显示经治疗两组以上指标均显著降低,但以治疗组为甚;提示瘀血痹胶囊联合托法替布在抑制类风湿关节炎患者体内炎症状态及骨破坏方面优势更显著。
综上所述,瘀血痹胶囊联合托法替布治疗类风湿关节炎具有较好的临床疗效,能有效促进主要症状、体征好转及病情缓解,减轻机体炎性反应,延缓骨破坏和关节功能损害,改善整体功能状态,安全性较好,值得临床推广应用。
利益冲突所有作者均声明不存在利益冲突
