西红花苷抑制NFATc3 活性促进与肿瘤成纤维细胞共培养的结直肠癌细胞放射敏感性
2023-11-24如桂牙阿不力孜薛青芳加依娜提热马赞
如桂牙·阿不力孜,薛青芳,加依娜提·热马赞
新疆医科大学第一附属医院 药学部,新疆 乌鲁木齐 830054
结直肠癌已成为全球癌症相关死亡的第2 大原因,术前新辅助放化疗和放化疗后进行全直肠系膜切除术是晚期局部结直肠癌的标准治疗方法[1]。然而,只有大约20%的患者达到肿瘤完全消退的效果,其余患者仍有病理残留或对治疗无反应,甚至在放疗后出现不良反应,如放射诱发的继发性肿瘤和放射性肠炎[2]。因此,阐明结直肠癌耐放射性的潜在机制并开发安全有效的放射增敏方案是临床上治疗结直肠癌的重要环节。
肿瘤微环境由细胞外基质和间充质细胞类型组成,包括成纤维细胞、炎症细胞、周细胞和内皮细胞,其中,肿瘤相关成纤维细胞(CAFs)是肿瘤微环境中的主要基质细胞类型,具有独特的致瘤特性,CAFs 以及原发灶周围的其他肿瘤基质细胞能够通过分泌各种细胞因子来促进肿瘤细胞的生长、侵袭和转移,并增强肿瘤细胞耐药性[3-4]。已有研究表明,从CAFs 中分离的外泌体能够促进结直肠癌细胞的干性,从而提高其抗放射性,该机制可能与激活转化生长因子-β(TGF-β)信号通路有关[5]。
西红花苷是水溶性类胡萝卜素,是西红花的主要成分和主要的暗红色色素。西红花具有多种用途,包括排汗、助消化、镇静、祛痰以及治疗呕吐、心血管疾病和肿瘤等[6-7]。近年来,西红花苷的抗肿瘤作用也被多项研究证实并报道,其能够抑制胃癌、胰腺癌、前列腺癌、白血病等多种肿瘤发生与进展[8-10]。此外,已有研究表明使用西红花苷可增加头颈部癌恶性肿瘤的放射敏感性,促进肿瘤细胞凋亡[11]。但在与CAFs 共培养下,西红花苷能否发挥增加肿瘤细胞放射敏感性,目前尚未见报道。活化T 细胞核因子(NFAT)是一种与人T 细胞中白细胞介素-2(IL-2)启动子结合的转录因子,目前已揭示NFAT 的5 种亚型,包括NFATc1、NFATc2、NFATc3、NFATc4、NFAT5,肿瘤细胞的增殖、侵袭、转移、耐药性和肿瘤微环境均受到NFAT 所调控[12-13]。基于此,本研究通过将结直肠癌细胞与CAFs 共培养下给予西红花苷处理,检测结直肠癌细胞的放射敏感性变化,探究其分子机制。
1 材料与方法
1.1 主要材料与试剂
CAFs 由本实验室前期从人结直肠癌组织中分离、鉴定并培养,人正常结肠上皮细胞NCM460 和人结直肠癌细胞系SW480、SW620、HCT116、LOVO均购于中科院细胞研究所,添加含1%青-链霉素双抗和10%胎牛血清的DMEM 培养基,于37 ℃、5% CO2培养箱内常规培养,每2 天传代1 次。
西红花苷(质量分数≥98%,批号111588-201704)购于上海源叶生物科技有限公司,总RNA 抽提试剂盒(批号15596-026)和M-MLV 逆转录酶(批号C28025)购于美国Invitrogen 公司,SYBR Premix Ex Taq 荧光定量检测试剂盒(批号DRR041S)购于日本Takara 公司,高效RIPA 细胞裂解液(批号R0010)购于北京索莱宝科技有限公司,BCA 蛋白浓度测定试剂盒(批号AC13858)购于上海吉至生化科技有限公司,ECL 显影液(批号P0018M)和PVDF 膜(批号FFP20)购于上海碧云天生物研究所,Transwell 小室(批号3422)购于美国Corning公司,Giemsa 染液(批号SH-1921)购于北京凯诗源生物科技有限公司,MTT 细胞增殖及细胞毒性检测试剂盒(批号R20228)购于上海源叶生物科技有限公司,Annexin V-FITC/PI 荧光双染细胞凋亡检测试剂盒(批号E-CK-A211)购于武汉伊莱瑞特生物科技股份有限公司,Hoechst 33258 荧光染料(批号A1371)购于北京康瑞纳生物科技有限公司,辣根过氧化物酶标记的山羊抗兔 IgG 抗体(批号ab205719)与兔多抗 GAPDH 抗体(批号ab181602)购于英国Abcam 公司,兔多抗NFATc3抗体(批号104857-T34)购于美国Abnova 公司。
1.2 方法
1.2.1 实时荧光定量聚合酶链式反应(qRT-PCR)测定NFATc3mRNA 表达 Trizol 法提取细胞的总RNA,按照总RNA 抽提试剂盒操作,1%凝胶电泳检测RNA 完整性,紫外分光光度计检测RNA 浓度与纯度。取浓度、纯度符合要求的RNA 样品,通过M-MLV 逆转录酶合成cDNA,-20 ℃保存备用。设计NFATc3的上、下游引物进行定量扩增,以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参,引物序列:NFATc3正向5’-TT CGCACATCTTCATTACCTCC-3’;反向5’-CCTCG GCTACCTTCAGTTTCAT-3’;GAPDH正向5’-GAC AAGCTTCCCGTTCTCAG-3’,反向5’-GAGTCAA CGGATTTGGTCGT-3’。根据实时荧光定量PCR 试剂盒说明书配制反应体系,在ABI 7900 型荧光定量PCR 系统上设置反应程序为:95 ℃ 10 min 预变性,循环1 次;95 ℃10 s,60 ℃ 30 s,循环40 次。重复3 次,扩增结束后,进行溶解曲线分析,读取Ct值,采用2-ΔΔCt法计算NFATc3mRNA 的相对表达量。
1.2.2 蛋白质免疫印记(Western blotting)测定NFATc3 蛋白表达 RIPA 裂解液提取细胞的总蛋白,BCA 法测量浓度。将等量上样缓冲液与蛋白混合,100 ℃水浴加热变性。将40 μg 变性后的蛋白上样至胶孔内,通过10% SDS-PAGE 凝胶分离,并转至PVDF 膜上。以5%脱脂奶粉作为封闭液,将膜浸入封闭液后室温静置1 h。再将膜与稀释后的特异性一抗(1∶1 000)共置于4 ℃孵育过夜。次日,TBST 洗膜后,再将膜与对应稀释后的二抗(1∶5 000)在室温下共孵育2 h,TBST 再次洗膜,避光环境下利用ECL 显影,凝胶成像仪采集图像,Image J 软件分析各蛋白灰度值,以GAPDH 作为内参,目的蛋白相对表达量以目的蛋白与内参蛋白的灰度值比值来表示。
1.2.3 细胞共培养体系建立与处理 将培养的CAFs 以每孔 1×104个的密度种植于 6 孔板Transwell 上室,将HCT116 细胞以每孔3×104个的密度种植于6 孔板Transwell 下室,构建非接触共培养体系,在37 ℃、5% CO2培养箱静置共培养48 h。此外,以Transwell 下室为HCT116 细胞、上室为基础培液作为对照,记为HCT116。收集与CAFs 共培养的HCT116 细胞,分为两部分,一部分为单纯与CAFs 共培养的HCT116 细胞,记为CAFs/HCT116;另一部分与CAFs 共培养的HCT116细胞再采用200 μmol/L 西红花苷处理12 h,记为CAFs/HCT116+西红花苷,其中西红花苷给药依据参考文献报道剂量[14]。
1.2.4 细胞克隆形成实验分析细胞存活分数 收集1.2.3 项下处理后的3 组HCT116 细胞,在37 ℃、5% CO2培养箱过夜培养后,分别给予0、2、4、6、8 Gy 剂量的X 射线照射(剂量率为2 Gy/min)。照射完毕后,将各组细胞置于培养箱内培养,14 d 左右出现肉眼可见菌落,弃去培养基,PBS 洗涤,加入细胞固定液固定,再加入Giemsa 染液染色30 min,PBS 再冲洗,自然晾干,在光学显微镜下计数含50 个细胞以上形成的集落数目,统计集落形成率,根据集落形成率计算细胞存活分数(SF)。
SF=实验组集落形成率/对照组集落形成率
1.2.5 实验分组与处理 将培养的HCT116 细胞分为4 组进行实验,具体分组与处理如下:(1)对照组,HCT116 细胞正常培养;(2)6 Gy 组,HCT116细胞经6 Gy 剂量的X 射线照射(剂量率为2 Gy/min);(3)CAFs/HCT116+6 Gy 组,与CAFs 共培养的HCT116 细胞经6 Gy 剂量的X 射线照射(剂量率为2 Gy/min);(4)CAFs/HCT116+西红花苷+6 Gy 组,与CAFs 共培养的HCT116 细胞采用200 μmol/L 西红花苷处理12 h,再经6 Gy 剂量的X 射线照射(剂量率为2 Gy/min)。处理结束后,收集4 组HCT116 细胞。
1.2.6 MTT 法检测细胞活性 将HCT116 细胞按照1×105个/孔的密度接种于96 孔培养板中,置于37 ℃、5% CO2培养箱培养24 h。按照1.2.5 项下进行分组处理后,每孔加20 μL MTT,处理4 h 后,终止培养。每孔再加入150 μL DMSO,摇床振荡直至结晶物充分溶解,采用全自动酶标仪测定每孔在490 nm 处的吸光度(A)值,检测细胞存活率。
细胞存活率=(A实验-A空白)/(A对照-A空白)
1.2.7 流式细胞术检测细胞凋亡率 收集处理后的4 组HCT116 细胞,采用0.25%胰蛋白酶消化,通过4 000 r/min 离心5 min,PBS 清洗沉淀,加入1×binding buffer 重悬,细胞密度为1×106个/mL。在流式检测管中加入100 μL 细胞悬液,接着依次加5 μL Annexin V-FITC、10 μL PI,涡旋混匀,立即上流式细胞仪检测各组HCT116 细胞凋亡率。
细胞凋亡率=Q2 象限百分率+Q3 象限百分率
1.2.8 Hoechst 33258 染色观察细胞凋亡形态 将处理后的4 组HCT116 细胞进行爬片,加入细胞固定液,置于4 ℃下固定过夜。次日,弃原液,PBS洗涤细胞,吸除多余液体,滴加Hoechst 33258 工作液,室温下染色10 min,PBS 漂洗后,用抗荧光淬灭封片液封片,自然晾干,在荧光显微镜观察各组HCT116 细胞凋亡形态并摄取图像。
1.3 统计学分析
2 结果
2.1 NFATc3 人正常结肠上皮细胞与结直肠癌细胞系中的差异表达
qRT-PCR 与Western blotting 测定结果显示,相较于人正常结肠上皮细胞NCM460,人结直肠癌细胞系SW480、SW620、HCT116、LOVO 中的NFATc3mRNA 和蛋白相对表达量均显著上调(P<0.05),见图1。且HCT116 细胞中NFATc3mRNA 和蛋白相对表达量上调水平较高,因此,后续选择该细胞系进行实验。

图1 人正常结肠上皮细胞与结直肠癌细胞系中NFATc3 表达比较(,n=6)Fig.1 Comparison of NFATc3 expression in human normal colon epithelial cells and colorectal cancer cell lines(,n=6)
2.2 西红花苷对与CAFs 共培养的结直肠癌细胞存活分数的影响
克隆形成实验检测并分析各组HCT116 细胞SF,与HCT116 细胞比较,经过4、6、8 Gy 剂量的X 射线照射后,与CAFs 共培养的HCT116 细胞SF显著增高(P<0.05)。而与CAFs 共培养的HCT116细胞比较,与CAFs 共培养的HCT116 细胞经西红花苷处理、再通过4、6、8 Gy 剂量的X 射线照射后,细胞SF 显著降低(P<0.05),见图2。

图2 不同处理下HCT116 细胞存活分数比较(,n=6)Fig.2 Comparison of HCT116 cell survival fraction under different treatments (,n=6)
2.3 西红花苷对与CAFs 共培养的结直肠癌细胞存活率的影响
MTT 检测结果显示,与对照组比较,6 Gy 组HCT116 细胞存活率显著下降(P<0.05)。与6 Gy组比较,CAFs/HCT116+6 Gy 组HCT116 细胞存活率显著升高(P<0.05)。与CAFs/HCT116+6 Gy 组比较,CAFs/HCT116+西红花苷+6 Gy 组HCT116细胞存活率显著降低(P<0.05),见图3。

图3 各组HCT116 细胞存活率比较(,n=6)Fig.3 Comparison of HCT116 cell survival rate among all groups (,n=6)
2.4 西红花苷对与CAFs 共培养的结直肠癌细胞凋亡率的影响
流式细胞术测定结果显示,与对照组比较,6 Gy组HCT116 细胞凋亡率显著升高(P<0.05)。与6 Gy 组比较,CAFs/HCT116+6 Gy 组HCT116 细胞凋亡率显著下降(P<0.05)。与CAFs/HCT116+6 Gy 组比较,CAFs/HCT116+西红花苷+6 Gy 组HCT116 细胞凋亡率显著升高(P<0.05),见图4。
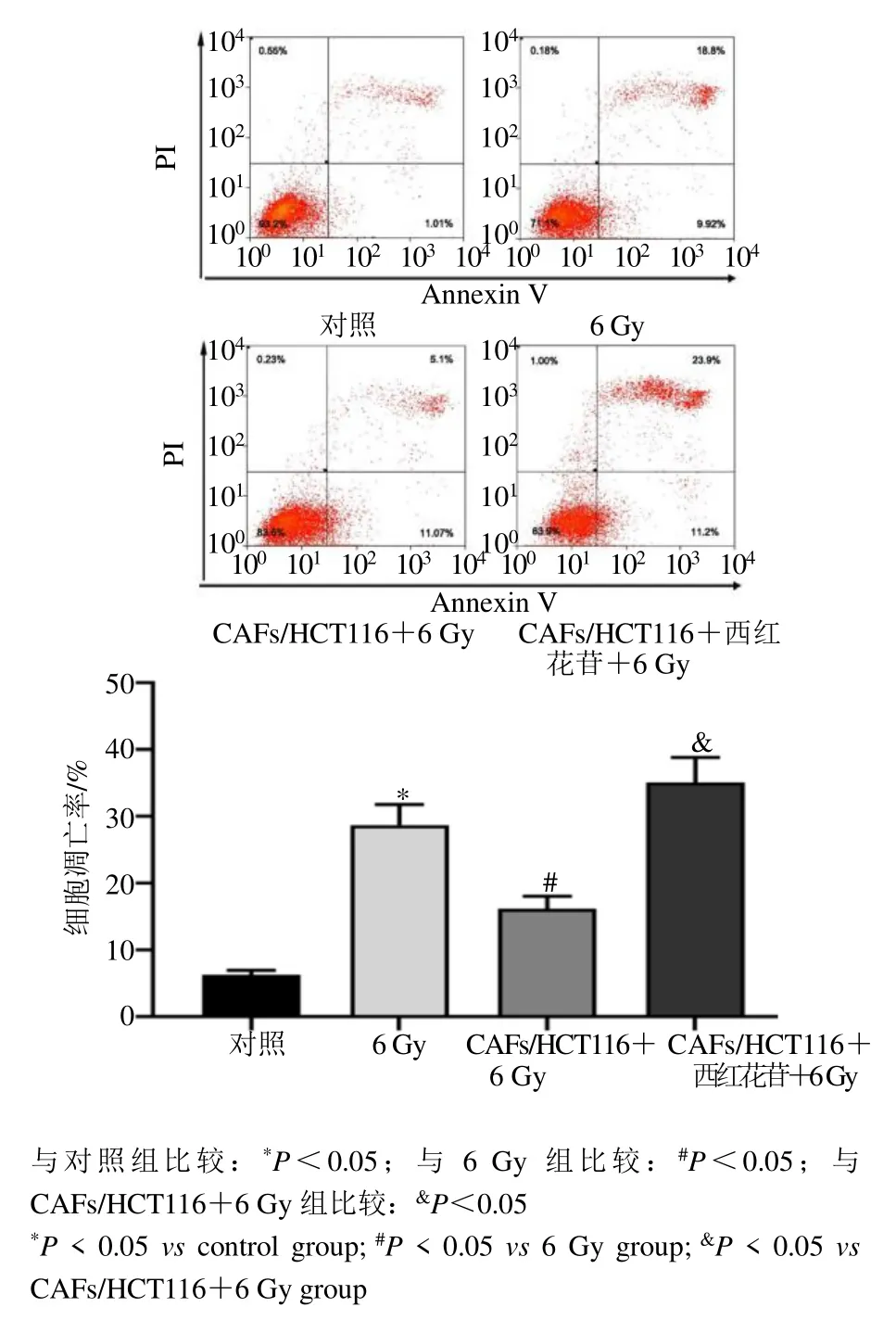
图4 各组HCT116 细胞凋亡率比较(,n=6)Fig.4 Comparison of apoptosis rate of HCT116 cells in each group (,n=6)
2.5 西红花苷对与CAFs 共培养的结直肠癌细胞凋亡形态的影响
Hoechst33258 染色结果如图5 所示,对照组HCT116 细胞内呈弥散均匀的染色,代表细胞未发生凋亡;6 Gy 组HCT116 细胞可见致密浓染的颗粒块状荧光,代表细胞发生凋亡;CAFs/HCT116+6 Gy 组HCT116 细胞内染色也较为均匀,未见致密浓染荧光;而CAFs/HCT116+西红花苷+6 Gy 组HCT116 细胞有较多致密浓染、碎裂荧光块,代表细胞发生凋亡。

图5 各组HCT116 细胞凋亡形态观察(Hoechst33258染色,×200)Fig.5 Observation of apoptosis morphology of HCT116 cells in each group (Hoechst33258 staining,×200)
2.6 西红花苷对与CAFs 共培养的结直肠癌细胞中NFATc3 mRNA 和蛋白表达水平的影响
qRT-PCR 与Western blotting 测定结果显示,与对照组比较,6 Gy 组HCT116 细胞中NFATc3mRNA和蛋白相对表达量均未发生统计学变化。而与6 Gy组比较,CAFs/HCT116+6 Gy 组HCT116 细胞中NFATc3mRNA 和蛋白相对表达量均显著上调(P<0.05)。与CAFs/HCT116+6 Gy 组比较,CAFs/HCT116+西红花苷+6 Gy 组HCT116 细胞中NFATc3mRNA 和蛋白相对表达量显著下调(P<0.05),见图6。
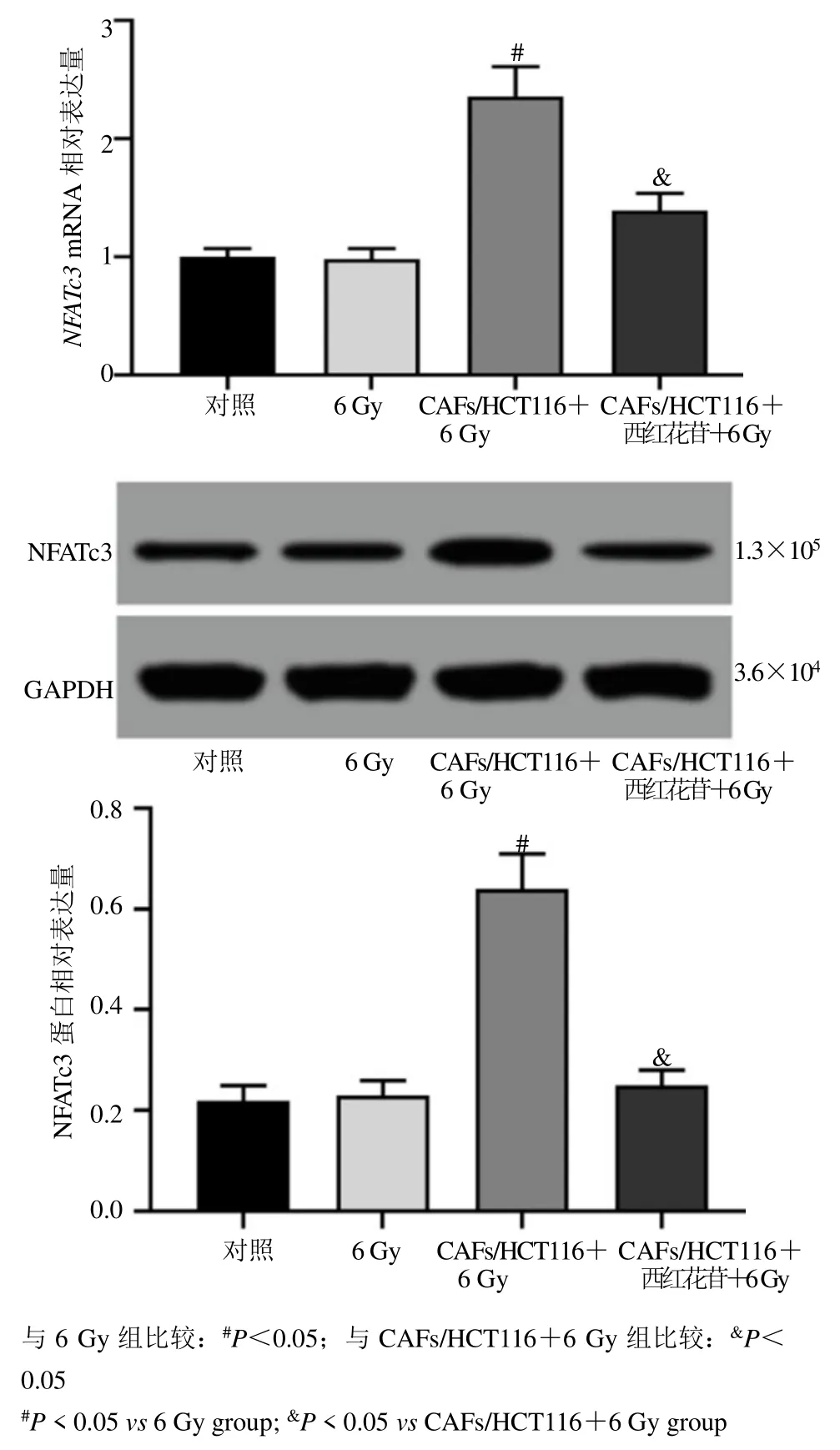
图6 各组HCT116 细胞中NFATc3 表达水平比较(,n=6)Fig.6 Comparison of NFATc3 expression levels in HCT116 cells in each group (,n=6)
3 讨论
近年来,人们对中医药的兴趣日益浓厚,引发了在抗肿瘤领域的广泛研究。中药能减轻化疗不良反应,调节免疫功能,抑制肿瘤生长并预防复发,不仅提高了患者的生活质量,而且延长了患者的生存期。随着中药抗肿瘤作用研究的日益加深,研究显示其还可以提高肿瘤细胞的放射敏感性,这对于临床上提高肿瘤放射治疗效果来说意义重大。以往多项研究表明,西红花苷可以抑制多种肿瘤细胞增殖并诱导细胞凋亡,说明西红花苷在肿瘤治疗中极具潜力。目前,关于西红花苷在肿瘤放射治疗中的作用也已有报道,Vali 等[15]研究表明西红花苷对放射处理下的人乳腺癌MCF-7 细胞具有协同作用,能够促使细胞凋亡,改善乳腺癌的治疗效果;Bakshi等[16]研究发现西红花苷不仅能够降低放射下胰腺癌细胞的活力,并对放射诱导的肝脏氧化损伤具有显著的保护作用。由此可见,西红花苷对于提高肿瘤细胞放射敏感性方面也具有积极作用。
作为实体瘤中主要的基质细胞亚型之一,CAFs占肿瘤体积的50%~70%,相较于正常未激活的成纤维细胞,CAFs 有助于肿瘤细胞的多种恶性行为进展,包括增殖、迁移、侵袭、血管生成、诱导化学抵抗和逃避免疫介导的杀伤。除此之外,CAFs 还与放疗治疗失败以及患者不良临床结局有关[17]。一方面,CAFs 通过分泌趋化因子、细胞因子、生长因子及调控相关信号途径,保护肿瘤细胞免受放射造成的DNA 损伤,进而抑制细胞凋亡;另一方面,活化的CAFs 可以重新编程肿瘤细胞代谢以维持肿瘤细胞存活并保护其免受药物或放射诱导的细胞凋亡[18]。Huang 等[19]研究发现CAFs 诱导鼻咽癌细胞放射抗性的形成,通过白细胞介素-8(IL-8)/核转录因子κB(NF-κB)途径在放射后促进鼻咽癌细胞存活,以减少照射诱导的DNA 损伤;Meng 等[20]研究表明CAFs 通过蛋白酪氨酸激酶/信号传导子和转录激活子(JAK/STAT)途径促进非小细胞肺癌细胞增殖和放射抗性形成,而靶向诱导CAFs 凋亡显著提高了放射治疗效果,并缓解了放射诱导的肺纤维化;Kitamura 等[21]研究报道指出CAFs 分泌肝细胞生长因子(HGF)以激活c-Met 信号通路,诱导乳腺癌细胞的上皮到间充质转化,促进乳腺癌细胞的放射抗性。在本研究中,将结直肠癌HCT116 细胞与CAFs 共培养后,再经过4、6、8 Gy 剂量的X射线照射,HCT116 细胞的SF 显著增高;进一步的实验结果显示,相较于单独经6 Gy 剂量X 射线照射的HCT116 细胞,与CAFs 共培养后再经6 Gy 剂量X 射线照射的HCT116 细胞存活率较高,细胞凋亡率下降,未见典型的细胞凋亡形态,该结果同样表明,CAFs 能够降低HCT116 细胞对放射的敏感性,抑制细胞凋亡。而与CAFs 共培养的HCT116细胞经西红花苷处理再通过4、6、8 Gy 剂量的X射线照射后,细胞SF 显著降低,其中,在6 Gy 剂量的X 射线照射下细胞SF 接近于50%,因此后续选择该剂量进行研究。此外,本研究还显示,HCT116 细胞与CAFs 共培养后,采用西红花苷处理HCT116细胞再经6 Gy剂量X射线照射,HCT116细胞存活率下降,细胞凋亡率升高,出现较多致密浓染、碎裂的凋亡状细胞,这说明西红花苷能够促进与CAFs 共培养的HCT116 细胞放射敏感性,从而提高结直肠癌的放疗效果。
NFATc3 作为NFAT 的重要亚型之一,研究表明,NFATc3 参与溃疡性结肠炎和溃疡性结肠炎相关结直肠癌的发生发展,下调NFATc3 可以抑制溃疡性结肠炎相关结直肠癌细胞的增殖和上皮间质转化,降低促炎细胞因子的水平,减少中性粒细胞和巨噬细胞的结肠浸润,改善黏膜损伤,并抑制肿瘤形成与生长[22]。此外,NFATc3 在替莫唑胺耐药胶质母细胞瘤U87 细胞中的表达水平要显著高于替莫唑胺敏感胶质母细胞瘤U87 细胞[23]。但关于NFATc3 与放射敏感性之间的关系尚未报道。本研究检测结果显示,相较于单独经6 Gy 剂量X 射线照射的HCT116 细胞,与CAFs 共培养后再经6 Gy剂量X 射线照射的HCT116 细胞中NFATc3 表达显著上调,而HCT116 细胞与CAFs 共培养后,经西红花苷处理再以6 Gy 剂量X 射线照射的HCT116细胞中NFATc3 表达显著下调,由此推测,西红花苷提高与CAFs 共培养的HCT116 细胞放射敏感性的作用可能与抑制NFATc3 表达有关。
综上所述,西红花苷能够提高与CAFs 共培养下的结直肠癌HCT116 细胞的放射敏感性,诱导细胞发生凋亡,该作用可能与抑制NFATc3 水平有关。
利益冲突所有作者均声明不存在利益冲突
