康力欣胶囊联合紫杉醇(白蛋白结合型)治疗Her-2 阴性晚期乳腺癌的临床研究
2023-11-24王高兴谭鑫吕雨桐刘睿
王高兴,谭鑫,吕雨桐,刘睿
广安门医院南区 肿瘤科,北京 102600
乳腺癌是女性常见恶性肿瘤,全球每年新发病例达226 万例,死亡例数达68 万例[1]。目前乳腺癌的治疗包括手术、化疗及内分泌治疗等,但对于晚期乳腺癌,临床预后较差,5 年生存率仅26%[2]。目前Her-2 阴性晚期乳腺癌患者以姑息化疗为主,但传统紫杉烷类和(或)蒽环类药物治疗过程中可出现治疗耐药,导致治疗失败[3]。因此,对于该类患者治疗方案的选择,是目前临床关注的问题。白蛋白紫杉醇是以纳米微粒白蛋白为载体的新型紫杉醇制剂,能够相对靶向性将药物经血管内皮细胞转运至肿瘤组织,发挥肿瘤杀伤作用,并在临床实验中证实能够显著改善晚期乳腺癌患者的客观缓解率和无进展生存时间[4-5]。康力欣胶囊是一种中药复方制剂,由阿魏、大黄、姜黄、九香虫、木香、丁香,诃子及冬虫夏草共8 味药组成,具有软坚散结,扶正固本等功效,可用于治疗非小细胞肺癌[6]、胃癌[7]等恶性肿瘤。本研究旨在研究在Her-2 阴性晚期乳腺癌患者中应用康力欣胶囊联合白蛋白紫杉醇治疗的临床疗效及安全性。
1 资料与方法
1.1 一般临床资料
选取自2020 年2 月—2022 年1 月广安门医院南区收治的96 例晚期乳腺癌患者为研究对象。本研究经中国中医科学院广安门医院南区伦理委员会审核批准通过(批件号2021-192-KY-01)。其中年龄<45 岁者37 例,≥45 岁者59 例;绝经前51例,绝经后45 例;ECOG 评分:0 分49 例,1 分40 例,2 分7 例;病理类型:浸润性导管癌53 例,浸润性小叶癌22 例,特殊类型浸润癌21 例;组织学分级:1 级27 例,2 级32 例,3 级37 例;TNM分期:Ⅲ期43 例,Ⅳ期53 例;ER/PR 状态:ER或(和)PR 阳性49 例,ER 和PR 均阴性47 例;Ki-67 阳性率:<30%者54 例,≥30%者42 例;受累器官:单发24 例,多发72 例;内脏转移:有61 例,无35 例。
1.2 纳入与排除标准
纳入标准:(1)均为女性患者,TNM 分期为Ⅲ期或Ⅳ期乳腺癌;(2)乳腺癌原发灶免疫组化染色HER-2 阴性或免疫组化染色HER-2(+),但荧光原位杂交证实HER-2(-);(3)既往至少接受2 个解救化疗方案后出现肿瘤进展;(4)ECOG 评分≤2 分,估计生存期≥3 个月;(5)有能够通过影像学等检查测量的复发或转移灶;(6)患者及家属对本研究知情同意并签订知情同意书。
排除标准:(1)既往接受过白蛋白紫杉醇、康力欣胶囊治疗;(2)合并严重肝肾心肺等脏器功能障碍;(3)血象异常,包括中性粒细胞<1.5×109/L,血小板计数<100×109/L,血红蛋白<90 g/L;(4)合并中枢神经系统转移;(5)合并其他恶性肿瘤;
1.3 药物
注射用紫杉醇(白蛋白结合型)由湖南科伦制药有限公司生产,规格 100 mg/支,产品批号20190912、20201024、20 210918;康立欣胶囊由云南名扬药业有限公司生产,规格0.5 g/粒,产品批号20191102、20200612、20210841。
1.4 分组及治疗方法
采用随机数字表法,将96 例患者分为对照组(48 例)和治疗组(48 例)。对照组年龄<45 岁者20 例,≥45 岁者28 例;月经状况:绝经前25 例,绝经后23 例;ECOG 评分:0 分23 例,1 分21 例,2 分4 例;病理类型:浸润性导管癌26 例,浸润性小叶癌12 例,特殊类型浸润癌10 例;组织学分级:1 级15 例,2 级16 例,3 级17 例;TNM 分期:Ⅲ期21 例,Ⅳ期27 例;ER/PR 状态:ER 或(和)PR阳性22 例,ER 和PR 均阴性26 例;Ki-67 阳性率:<30%者28 例,≥30%者20 例;受累器官:单发13 例,多发35 例;内脏转移:有31 例,无17例。治疗组年龄:<45 岁者17 例,≥45 岁者31例;月经状况:绝经前26 例,绝经后22 例;ECOG评分:0 分26 例,1 分19 例,2 分3 例;病理类型:浸润性导管癌27 例,浸润性小叶癌10 例,特殊类型浸润癌11 例;组织学分级:1 级12 例,2 级16 例,3 级20 例;TNM 分期:Ⅲ期22 例,Ⅳ期26例;ER/PR 状态:ER 或(和)PR 阳性27 例,ER 和PR 均阴性21 例;Ki-67 阳性率:<30%者26 例,≥30%者22 例;受累器官:单发11 例,多发37 例;内脏转移:有30 例,无18 例。两组患者在年龄、月经状况、ECOG 评分、病理类型、组织学分级、TNM 分期、ER/PR 状态、Ki-67 阳性率、受累器官及是否合并内脏转移之间比较,差异无统计学意义,具有可比性。
对照组静脉滴注注射用紫杉醇(白蛋白结合型),260 mg/m2,1 次/3 周为1 个周期,共3 个周期。治疗组在对照组治疗基础上,口服康立欣胶囊,1.5 g/次,3 次/d,治疗3 个周期。
1.5 疗效评估标准
治疗过程中所有研究对象每周复查血常规、血生化及肝肾功能等检查,每1 个月复查通过超声、CT 或核磁共振等影像学检查对肿瘤靶病灶进行评估。在治疗结束时参考RECIST 1.1 标准评估治疗疗效[8]。完全缓解为病灶完全消失。部分缓解为靶病灶长径之和缩小≥30%。疾病稳定为靶病灶长径之和缩小<30%或增加<20%。疾病进展为靶病灶长径之和增加≥20%,或者出现新的转移病灶。
客观有效率(ORR)=(完全缓解例数+部分缓解例数)/总例数
疾病控制率(DCR)=(完全缓解例数+部分缓解例数+疾病稳定例数)/总例数
1.6 观察指标
患者疼痛程度评估采用视觉模拟评分(VAS)法[9],根据患者主观感觉进行评分,评分范围0~10分,分值越高,疼痛程度越重。留取所有研究对象治疗前后清晨空腹静脉血约5 mL,3 500 r/min 分离离心15 min,分离上层血清,采用电化学发光法检测血清癌胚抗原(CEA)和糖类抗原153(CA153)。
1.7 随访
所有研究对象开始治疗后每月随访1 次,通过门诊、电话或住院随诊方式,连续随访时间1 年,观察并记录患者生存情况,不良反应发生情况及疾病进展情况。不良反应主要包括白细胞下降、肝功能异常、恶心呕吐、腹痛腹泻等。无进展生存期(PFS)为自随访开始到发生肿瘤进展的时间或患者死亡的时间。随访截至2023 年2 月1 日。随访终点为出现肿瘤进展或随访时间结束。
1.8 统计学分析
应用SPSS 26.0 分析数据。经K-S 正态性检验符合正态分布的计量资料以表示,两组间比较采用独立样本的t检验。计数资料以率表示,组间比较采用χ2检验。Kaplan-Meier 生存分析(Log-Rank 检验)分析两组无进展生存期的差异。
2 结果
2.1 两组疗效比较
治疗后,治疗组ORR、DCR 分别为62.50%和89.58%,均明显高于对照组的41.67%和72.92%,两组比较差异具有统计学意义(P<0.05),见表1。

表1 两组临床疗效比较Table 1 Comparison on clinical efficacy between two groups
2.2 两组VAS 评分及肿瘤标志物比较
治疗后,两组患者VAS 评分及血清CEA 和CA153 水平较治疗前均明显降低(P<0.05),且治疗组治疗后VAS 评分及血清CEA 和CA153 水平明显低于对照组(P<0.05),见表2。
表2 两组VAS 评分和肿瘤标志物水平比较()Table 2 Comparison on VAS scores and tumor marker levels between two groups ()
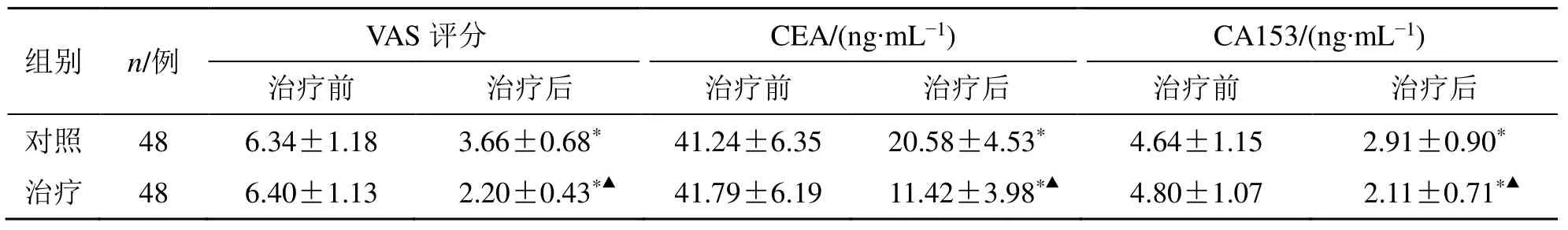
表2 两组VAS 评分和肿瘤标志物水平比较()Table 2 Comparison on VAS scores and tumor marker levels between two groups ()
与同组治疗前比较:*P<0.05;与对照组治疗后比较:▲P<0.05*P <0.05 vs same group before treatment;▲P <0.05 vs control group after treatment
2.3 两组无进展生存期比较
本研究98 例患者中,随访12 个月,总体中位无进展生存期为4.04 个月(95%CI:2.733~5.267)。治疗组患者中位无进展生存期分别为5.23 个月(95%CI:4.37~6.09),长于对照组患者2.85 个月(95%CI:2.29~3.42),两组比较差异具有统计学意义(P<0.05),见图1。

图1 两组无进展生存期比较Fig.1 Comparison on progression free survival between two groups
2.4 两组不良反应比较
两组无化疗相关死亡病例。治疗组白细胞下降、肝功能异常、恶心呕吐、腹痛腹泻不良反应发生率分别低于对照组,差异具有统计学意义(P<0.05),见表3。
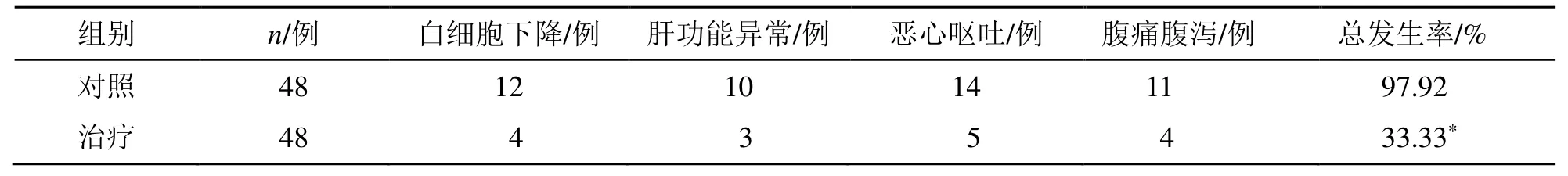
表3 两组不良反应比较Table 3 Comparison on adverse reactions between two groups
3 讨论
乳腺癌是女性常见的恶性肿瘤,发病率有逐渐升高的趋势[2]。乳腺癌的临床治疗包括手术治疗、化疗、内分泌治疗等。但部分早期乳腺癌患者术后易复发[10],同时约10%的初诊乳腺癌患者即为晚期,即使经积极综合治疗临床预后依然较差[11]。目前Her-2 阴性晚期乳腺癌患者经蒽环类、传统紫杉烷类药物治疗后,可出现治疗耐药、内脏危象,疾病快速进展导致治疗失败[12]。
紫杉醇是从红豆杉树皮分离提纯的化疗药物,能够使微管蛋白二聚体失去动态平衡,防止微管解聚,抑制癌细胞有丝分裂及细胞增殖,发挥抗肿瘤作用[13]。但临床治疗中发现相当一部分患者接受过紫杉醇治疗的患者存在过敏反应及治疗耐药的问题,导致治疗失败[14]。白蛋白紫杉醇是纳米颗粒白蛋白荷载紫杉醇。白蛋白紫杉醇能够在较短的输注时间(30 min)内达到最大耐受剂量,而紫杉醇输注时间需要3 h,并且无需药物预防超敏反应。此外,白蛋白紫杉醇能够通过gp60 受体介导的白蛋白转运机制,增强紫杉醇在血管内皮细胞中的转运,也可以通过增强的渗透和滞留效应,提高肿瘤组织内部紫杉醇药物浓度,增强肿瘤杀伤效应[15]。中医药在改善恶性肿瘤治疗疗效,提高恶性肿瘤患者生存质量方面发挥重要作用。中医治疗并非直接杀伤肿瘤细胞,消除瘤体,而是在中医辨证理论指导下,调整脏腑功能,纠正气血失衡状态,提高恶性肿瘤患者抗肿瘤免疫能力,达到清除肿瘤细胞,预防肿瘤复发转移、提高生活治疗及延长生存时间的目的。康力欣胶囊具有扶正祛邪、活血化瘀,改善微循环,提高机体免疫能力,提高恶性患者生命质量,延长生存时间[16]。
血清肿瘤标志物等具有价格低廉、检测方便快捷等优点。CEA 是一种广谱肿瘤标志物,目前也应用于乳腺癌的诊断级术后随访,是监测化疗疗效及预测乳腺癌复发和转移的重要指标[17]。CA153 是相对分子质量为4×104的糖蛋白,细胞恶变时能够脱落进入血循环,有助于乳腺癌诊断及化疗疗效评价[18]。本研究中,观察组治疗后VAS 评分及血清肿瘤标志物CEA、CA153 水平降低更为明显,说明康力欣胶囊联合白蛋白紫杉醇治疗方案相比于单一应用白蛋白紫杉醇治疗,能够进一步提高Her-2 阴性晚期乳腺癌的临床治疗效果。此外,观察组患者ORR、DCR及无进展生存期明显高于对照组,提示康力欣胶囊联合白蛋白紫杉醇治疗方案能够延长患者无进展生存期,改善患者生存预后,临床效果明确。
本研究中,观察组患者细胞下降、肝功能异常、恶心呕吐、腹痛腹泻各不良反应的发生率低于对照组,可提示康力欣胶囊联合白蛋白紫杉醇治疗可有效减少患者不良反应,两者联合用药具有较高的安全性,值得临床推广应用。康力欣胶囊中的阿魏、木香等成分能够通过清热解毒、理气化瘀等,促进骨髓造血,改善血液高凝状态,减轻白蛋白紫杉醇化疗的毒性,而冬虫夏草等成分能够益气养血、滋阴温阳,增强机体免疫力,提高体质,减轻化疗的毒副作用,从而降低化疗不良反应的发生率[19-20]。因此,康力欣胶囊联合白蛋白紫杉醇能够降低Her-2 阴性晚期乳腺癌不良反应发生率。
综上所述,康力欣胶囊联合白蛋白紫杉醇对Her-2 阴性晚期乳腺癌具有较好的临床效果,能够延长Her-2 阴性晚期乳腺癌患者无进展生存期,降低VAS 评分及血清CEA 和CA153 肿瘤标志物水平,降低化疗不良反应的发生率,具有较好的安全性。但本研究也存在一定的不足,本研究样本量有限,有待今后设计多中心临床试验,扩大样本量进一步验证。
利益冲突所有作者均声明不存在利益冲突
