普通白菜PRR5的克隆、表达及功能验证
2023-11-23侯瑞泽鲍悦陈启亮毛桂玲韦博霖侯雷平李梅兰
侯瑞泽 鲍悦 陈启亮 毛桂玲 韦博霖 侯雷平 李梅兰
(山西农业大学园艺学院,晋中 030800)
普通白菜(Brassica rapa ssp. chinensis Makino)是典型的种子春化型蔬菜,属十字花科芸薹属,感受低温后容易抽薹开花,但春季过早抽薹影响其品质和产量,会造成重大经济损失。因此,阐明其成花机理以防止过早抽薹至关重要。
植物的成花过程可分为花的诱导、成花转变和花器官的发育3个阶段,此过程关系到植物的开花时间、开花数量、开花质量和花期长短[1]。在过去的几十年里,拟南芥开花的生理和分子机制已经得到了研究,发现光周期途径、春化途径和环境温度途径主要传递光和温度等外部信号;内源性信号是自主途径、赤霉素途径和年龄通路的主要途径[1-8]。这些途径既相互独立又相互作用,形成一个复杂而独立的调控网络,共同调控抽薹和开花。开花决定了植物生长周期的长短,也直接关系到植物的产量和品质,因此,成花机理成为了人们研究的重点[9]。
PRR5(PSEUDO‑RESPONSE REGULATOR 5)编码一个伪响应调节器,其突变影响各种与昼夜节律相关的生物事件,例如长日光周期条件下的开花时间、早期光形态发生期间幼苗的红光敏感性以及某些时钟控制基因的自由运行节律周期。PRR基因之所以如此命名,是因为它们编码类似于“响应调节蛋白”的蛋白质,在细菌、酵母和植物的磷酸化信号转导中发挥输出作用[10]。前人研究发现,拟南芥PRR5是一种转录抑制因子,但如果VP16这一强转录激活域与PRR5(PRR5‑VP)串联融合,则PRR5‑VP将充当转录激活因子。超表达PRR5‑VP的转基因拟南芥具有晚开花和长下胚轴表型,这与超表达PRR5的拟南芥相反[11]。PRRs通过控制CDF来调节CO/FT从而调控开花时间[12]。在至少2个途径中,拟南芥PRR诱导FT并促进开花[11,13],但是在普通白菜中未见相关报道。
本研究以普通白菜‘75#’品系为试验材料,克隆PRR5的同源基因Bra009768,分析其序列、蛋白结构和在不同器官及不同发育时期的表达情况,最后构建超表达载体,转化拟南芥进行功能验证,以明确其在普通白菜中的功能,为了解PRR5对普通白菜成花转变的影响奠定基础。
1 材料与方法
1.1 材料
普通白菜‘75#’和拟南芥哥伦比亚野生型为实验室保存种质资源。参照Shang等[14]方法进行材料处理,选取籽粒饱满的种子均匀播种在含有双层滤纸的培养皿中,催芽3 d后置于4℃低温处理20 d,将幼苗移栽至50孔穴盘,进行常规管理。
1.2 方法
1.2.1 RNA提取和cDNA的合成 选取移栽后10 d的植株茎尖生长点,记作DAV10,用体视显微镜观察花芽分化情况[15],取花芽分化0级(S0)和1级(S1)时的茎尖生长点,以及根、茎、叶、花和果荚进行RT‑qPCR分析,将上述样品参照试剂盒说明书提取RNA并反转录为cDNA进行基因克隆和表达量分析。
1.2.2 过表达载体的构建 利用大白菜数据库(http://brassicadb.org)查找Bra009768的序列,用NCBI中的 Primer‑BLAST(https:// www.ncbi.nlm.nih.gov/tools/primer‑blast/)设计特异性引物(表1)。以S0 cDNA为模板,用引物C‑Bra009768‑F/R进行PCR扩增,电泳检测、回收。将回收产物用同源臂引物G‑Bra009768‑F/R扩增,再回收,用无缝克隆试剂盒与线性化pBI121载体重组,并转化至DH5α,待菌液浑浊后进行PCR验证(引物为N‑YZ),将条带大小正确且无杂带的菌液送至北京擎科生物科技有限公司进行测序。将测序正确的菌液,参照天根质粒小提试剂盒说明书步骤进行质粒提取,使用NanoDrop 2000检测质粒溶液浓度,‑20℃保存,备用。

表1 Bra009768引物列表Table 1 Primers of Bra009768
上述过程反应体系为(共20 μL):2×Phanta Max Master Mix 10 μL、Reverse/Forward Primer(10 μmol/L)各0.8 μL、cDNA 1 μL和RNase Free dH2O 7.4 μL。反应程序为:94℃ 5 min;94℃ 30 s,54℃ 30 s,72℃ 90 s,35个循环;72℃ 10 min,4℃保存。
1.2.3 基因序列的生信分析 使用DNAMAN软件对Bra009768进行蛋白质翻译,以NCBI数据库为基础,利用MEGA 7.0软件对Bra009768蛋白序列进行比对并构建进化树。利用在线软件ExPASy(https://www.expasy.org/)进行蛋白序列的理化性质分析。利用在线软件SOPMA(https://npsa‑prabi.ibcp.fr/cgi‑bin/npsa_automat.pl?page=npsa_sopma.html)预测二级结构,SWISS‑MODEL(https://swissmodel.expasy.org/interactive)预测三级结构。利用在线分析工具Plant‑mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/plant‑multi/)进行亚细胞定位预测分析。
1.2.4 基因的表达分析 为了解Bra009768在普通白菜中的功能,取普通白菜‘75#’的根、茎、叶、花和果荚进行RT‑qPCR检测该基因在不同部位的表达情况,以DAV10、S0和S1三个时期的cDNA为模板,测定该基因在不同发育时期的表达情况,以大白菜ACTIN作为内参基因,相对定量使用内参基因的2-△△CT算法计算[16]。特异性引物见表2。

表2 RT-qPCR验证引物Table 2 Primers of real time quantitative PCR
1.2.5 蘸花法转化拟南芥
1.2.5.1 菌株准备 将1.2.2提取的pBI121‑Bra0097 68质粒转化至农杆菌感受态GV3101菌株,扩繁至菌液浑浊后使用特异性引物N‑YZ‑F/R进行菌液PCR验证,用琼脂糖凝胶电泳验证PCR产物,将条带大小正确且无杂带的GV3101‑pBI121‑Bra009768菌液‑80℃保存备用。
1.2.5.2 植物材料准备 将野生型拟南芥种子用消毒液消毒后均匀播种至MS固体培养基中,先置于黑暗环境下4℃春化2 d,随后移至光照16 h/黑暗8 h、温度25℃、相对湿度55%的组培室中生长5-7 d。待植株两片真叶展开后移栽至营养钵中进行常规管理。
1.2.5.3 拟南芥花序侵染 侵染菌液制备:将培养至OD600≈0.9的GV3101‑pBI121‑Bra009768菌体离心后重悬沉淀菌体至OD600≈0.8,加入0.05%Silwet‑77,充分混匀后备用。
转化植株准备:当野生型拟南芥移栽6周后,选择长势良好、抽薹期基本一致的野生型拟南芥进行花序侵染,然后将植株避光培养24 h后取出,进行常规管理。
1.2.6 转基因拟南芥植株筛选及分子鉴定 将收获的T0种子于MS固体选择培养基上筛选获得T1转基因植株,观察T1转基因植株生长状况,单株收种并继续筛选得到T2植株。
使用DNA提取试剂盒提取野生型植株,T1和T2转基因植株总DNA,以野生型拟南芥DNA为阴性对照,pBI121‑Bra00976质粒为阳性对照,阳性转基因植株总DNA为模板,引物为N‑YZ‑F/R,进行PCR分子鉴定。
1.2.7 转基因拟南芥表达量分析 切取野生型、T1和T2转基因拟南芥莲座叶片,参照说明书提取莲座叶片总RNA。使用NanoDrop 2000检测RNA浓度,琼脂糖凝胶电泳检测RNA完整性,质检合格且完整性良好的RNA使用反转录试剂盒构建cDNA文库,以拟南芥ACTIN基因为内参基因(表2),Bra009768为目标基因,以T1和T2转基因株系cDNA文库为模板进行RT‑qPCR验证。
2 结果
2.1 基因克隆及过表达载体的构建
经琼脂糖凝胶电泳验证PCR扩增产物,发现目的条带大小约为1 700 bp,与目的片段大小一致(图1‑A),可进行后续的试验。对pBI121‑Bra009768的大肠杆菌菌液进行PCR验证(图1‑B),该基因所对应条带大小约2 000 bp且没有杂带,与目的基因大小相同,说明该基因已成功转入大肠杆菌,可进行基因测序。
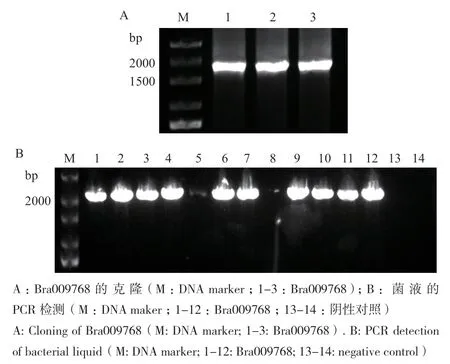
图1 Bra009768的克隆及其菌液检测结果Fig. 1 Cloning of Bra009768 and detection results of its broth
2.2 序列分析
2.2.1 基因序列分析 克隆片段经测序后得到核苷酸序列,片段大小为1 701 bp,使用DNAMAN软件对Bra009768进行蛋白质翻译,结果表明,Bra009768共编码566个氨基酸,将该基因命名为BrcPRR5,GenBank ID: OQ715277。
2.2.2 氨基酸多重序列比对 BrcPRR5与BpPRR5(大白菜,Brassica pekinensis)、BnPRR5(欧洲油菜,Brassica napus)、AtPRR5(拟南芥,Arabidop‑sis thaliana)、CsPRR5(亚麻芥,Camelina sativa)、RsPRR5(萝卜,Raphanus sativus)、GaPRR5(棉花,Gossypium arboreum)、CsPRR5(欧洲栗,Castanea sativa)、FaPRR5(草莓,Fragaria ananassa)和Cc‑PRR5(山核桃,Carya cathayensis Sarg)同源性分别为99.29%、98.41%、73.06%、71.19%、61.65%、38.81%、35.57%、34.44%和34.26%,同源性高,说明克隆片段是普通白菜的PRR5基因片段(图2‑A)。
2.2.3 蛋白质亲缘关系分析 为进一步了解Bra009768编码蛋白与其同源蛋白在不同植物之间的进化关系,用DNAMAN软件构建该蛋白在不同植物物种间的系统进化树。与Bra009768编码蛋白亲缘关系最近的是大白菜(Brassica pekinensis),其次是欧洲油菜(Brassica napus),它们同属一个分支。与欧洲栗(C. sativa)、草莓(F. ananassa)和山核桃(C.cathayensis Sarg)亲缘关系较远(图2‑B)。
2.2.4 蛋白质理化性质分析 Bra009768蛋白由566个氨基酸组成,分子量为62 788.90 Da,理论等电点为6.98,脂肪指数为62.86,亲水性总平均值为‑0.792;带负电荷的残基总数为70,带正电荷的残基总数为69,不稳定指数为58.62,此类蛋白质为不稳定蛋白质。
2.2.5 二、三级结构及亚细胞定位预测 使用SOPMA预测蛋白质的二级结构,Bra009768编码蛋白(图2‑C)的二级结构主要包括25.44%的α-螺旋、57.42%的无规则卷曲和13.25%的延伸链。使用SWISS‑MODEL预测蛋白质的三级结构(图2‑D),二者结果相吻合。使用Plant‑mPLoc对Bra009768进行亚细胞定位发现,其定位在细胞核上。
2.3 基因表达分析
为了解Bra009768在普通白菜不同器官与不同生育期中的表达情况,使用RT‑qPCR方法对其进行定量分析(图3‑A),发现该基因在茎中的表达量最高,花中次之,在叶和果夹中的表达量最低,对比该基因在DAV10、S0和S1时期茎尖生长点的相对表达量(图3‑B),发现该基因在S0时表达量最高,这与RT‑qPCR中茎和花表达量高相吻合,说明其对成花转变有促进作用,有利于植株提早开花。
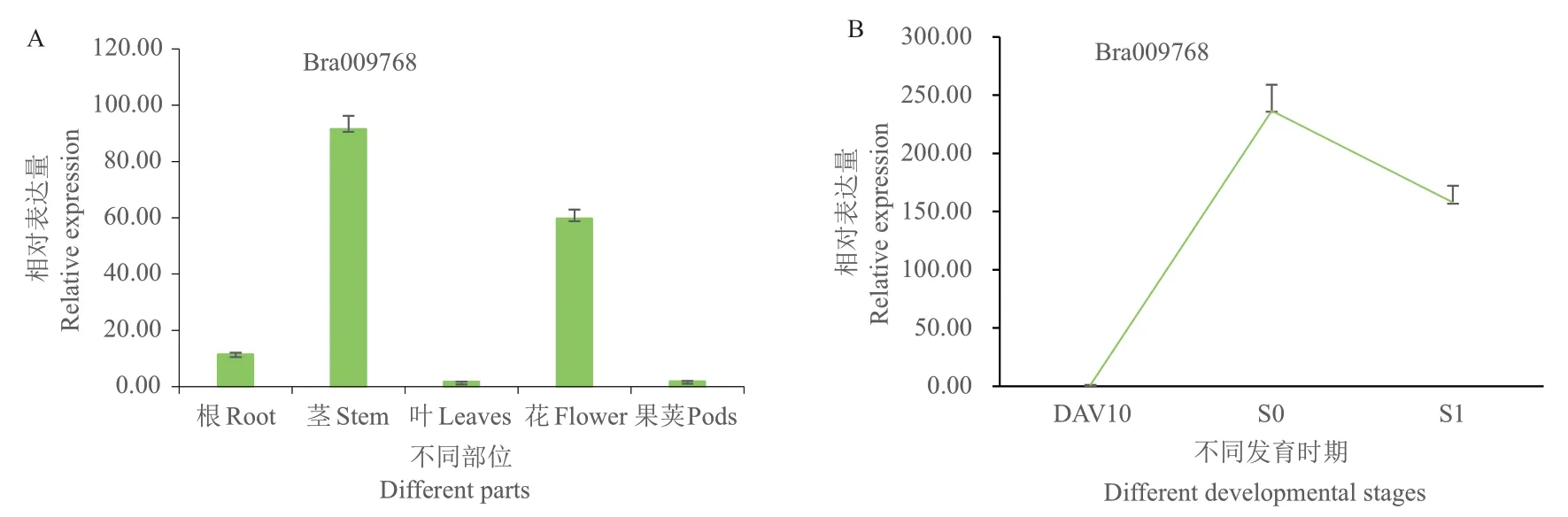
图3 Bra009768在普通白菜不同器官(A)及不同发育时期(B)的表达Fig. 3 Expressions of Bra009768 in different organs(A)and different developmental stages(B)of pakchoi
2.4 抗性转基因植株的获得及PCR鉴定
将拟南芥T1、T2代转基因种子播种于MS固体筛选培养基上,10 d后观察种子发芽及植株生长情况。此时,抗性植株两片真叶展开且叶片及根系发育良好,长势健壮,而非抗性植株整株表现为黄化,叶片与根系生长发育停滞(图4‑A, B)。
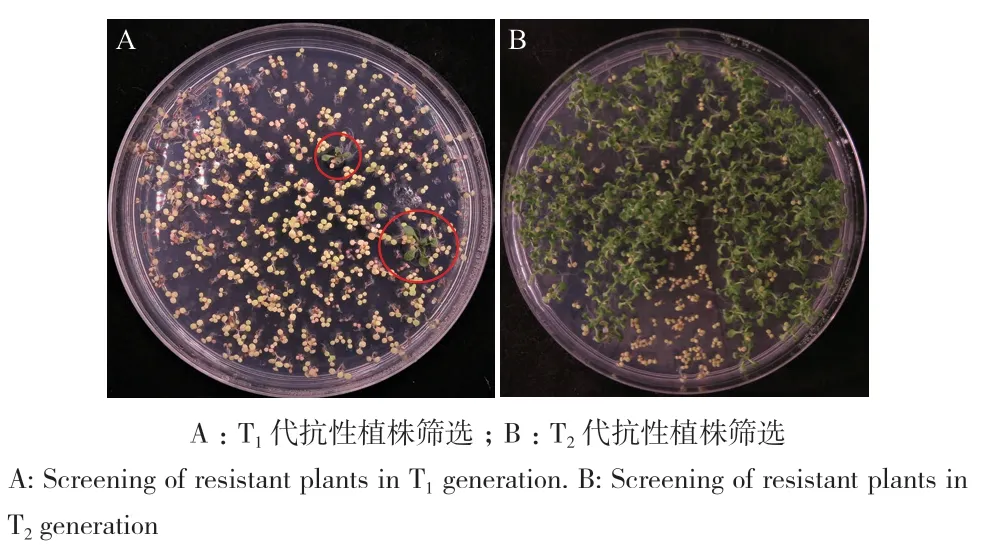
图4 转基因拟南芥抗性植株筛选Fig. 4 Selection of transgenic Arabidopsis thaliana resistant plants
T0植株收种后进行T1转基因植株筛选继而进行T2植株筛选,均于生长室中进行常规管理,提取T1和T2转基因植株的莲座叶片总DNA作为模板,以同期生长的野生型拟南芥莲座叶片总DNA为阴性对照,以pBI121‑Bra009768质粒为阳性对照,以引物N‑YZ‑F/R进行PCR扩增,对抗性株系进行转基因植株鉴定。结果表明,电泳条带大小为2 000 bp,与阳性对照大小一致,阴性对照未检测到条带,说明BrcPRR5已经成功整合至拟南芥基因组中且能够稳定遗传。
将T1抗性植株收种后再次播种于MS固体筛选培养基以获得T2转基因植株,进行后续试验。共筛选获得T1抗性植株4株,T2抗性植株40株。
2.5 转基因植株表型分析
通过表型观察和统计学分析发现T1植株个体间存在差异,平均抽薹时间约为移栽后(12.50±2.38)d,早于野生型植株,莲座叶片数明显多于野生型植株,但是侧薹数、株高和茎粗无明显区别(表3,图5‑A-C)。
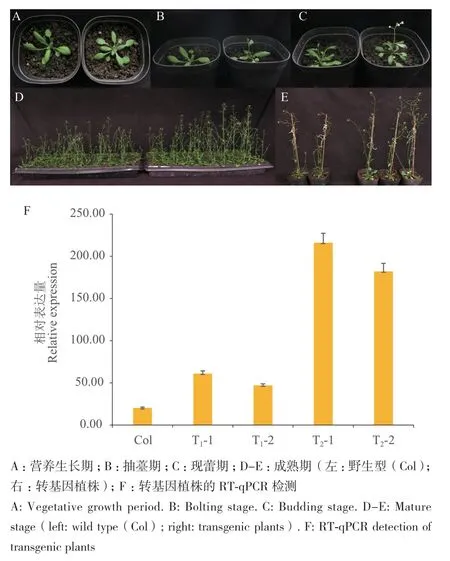
图5 转基因植株的表型观察及BrcPRR5的RT-qPCR验证Fig. 5 Phenotypic observation of transgenic plants and RT-qPCR validation of BrcPRR5
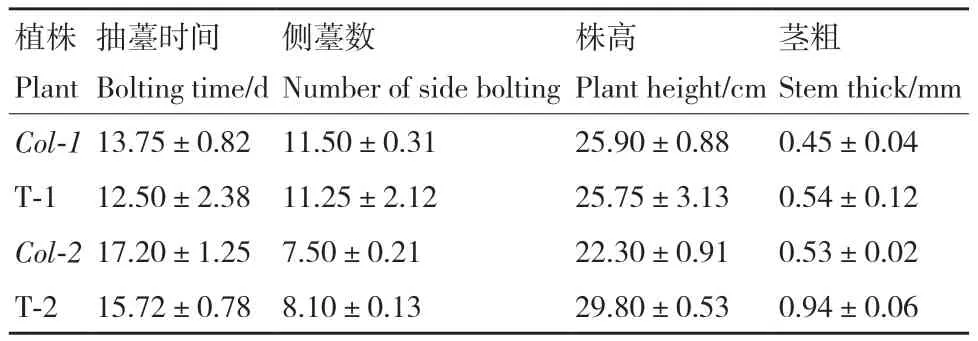
表3 T1、T2转基因植株表型统计Table 3 Phenotypic statistics of T1 and T2 transgenic plants
观察T2转基因植株,发现其抽薹时间平均为(15.72±0.78)d,早于野生型约1.5 d;株高、茎粗均显著高于野生型;与T1相比个体间差异明显缩小,但是侧薹数与野生型无显著差别(表3,图5‑D-E)。
综上所述,与野生型相比,转基因植株的开花时间提前,株高和茎粗增加,说明在拟南芥中过表达BrcPRR5可以使拟南芥提早抽薹,花期提前,表明该基因具有促进开花的功能。
2.6 转基因拟南芥表达量分析
为了进一步验证BrcPRR5在拟南芥转基因植株中的表达情况,提取经PCR分子鉴定的T1和T2转基因植株和野生型拟南芥莲座叶片的总RNA,以反转录总RNA获得的cDNA为模板,进行RT‑qPCR检测,鉴定T1和T2转基因株系中BrcPRR5的相对表达量(图5‑F)。结果表明,T1和T2转基因株系中BrcPRR5表达量显著高于野生型株系,说明BrcPRR5在拟南芥转基因早花株系中过表达,从而促进开花,增加植株高度和茎粗。
3 讨论
在拟南芥中,PRR蛋白由5个基因家族编码,被定义为生物钟的核心组成部分(TIMING OF CAB EXPRESSION 1(TOC1)、PRR3、PRR5、PRR7和PRR9)[17-21]。在长日照植物中,TOC1(也称PRR1)的衰减会导致晚花并增加生物量[22],在PRR7/PRR3亚组中,拟南芥prr7突变体和PRR7过表达品系的开花时间表明PRR7促进开花[23-24]。但PRR3的过度表达导致开花晚[20]。
前人研究表明,在长日照条件下,CO转录受时钟控制的蓝光感光器FLAVIN‑BINDING、KELCH REPEAT、F‑BOX1(FKF1)、时钟控制的循环自由因子CYCLING DOF FACTOR(CDF)和时钟蛋白GIGANTEA(GI)控制。在这种机制中,FKF1‑GI蛋白复合物通过以光依赖性方式结合并启动CD(CO转录抑制因子)的降解来促进CO的转录[25-27]。CO通过其激活“成花素”基因FLOWERING LOCUS T(FT)转录的能力直接促进花的转变[28],也就是说,CO与FT结合可促进植株提早开花。
在PRR9/PRR5亚群中,拟南芥PRR蛋白被称为开花启动子[29],PRR介导的CO与FT启动子结合,可增加其稳定性,使FT增强转录和早花。此外,PRR将光照信息直接耦合到计时院并允许识别长日照[30]。PRR9/PRR5亚组基因可以控制短日照水稻的开花时间,促进长日照拟南芥开花(图6)[11,23]。
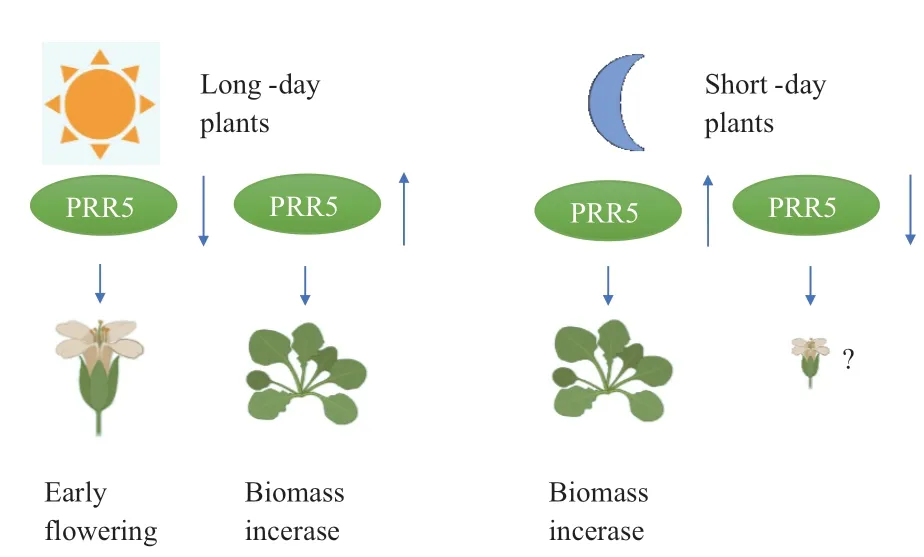
图6 PRR9/PRR5亚群对开花时间和植株生物量影响的模型Fig. 6 Model for the effect of the PRR9/PRR5 sub-group on flowering time and plant biomass
在转录组数据中,通过GO注释分析差异表达基因发现,PRR5的差异倍数较高,由此推断这可能会造成普通白菜花芽分化提前,因此,对该基因进行了克隆,并将克隆得到的1 701 bp开放阅读框,编码566个氨基酸,然后进行氨基酸序列多重比对、亲缘关系分析、蛋白结构预测等生物信息学分析,确定克隆得到的基因为普通白菜PRR5基因。对于该基因在不同部位的RT‑qPCR结果发现,该基因在花中、茎中都有高表达,这和PRR5在2个部位上的作用有关,除却其在开花时间上发挥的作用,其对于植物茎粗也有一定的影响。之后进行超表达载体构建及转基因功能验证,通过统计植株生长指标,转基因植株的茎粗要明显高于野生植株,这印证了之前的结论,同时发现转基因植株确实会使花期提前,这与前人研究的结果一致。研究结果为深入研究普通白菜成花机理奠定基础。
4 结论
普通白菜BrcPRR5在茎和花蕾中的表达量高于叶和果荚。在S0时表达量最高,说明其对成花转变有促进作用,有利于植株提早抽薹开花。
