基于TRV病毒的工业大麻(Cannabis sativa L.)VIGS体系的优化
2023-11-22刘俊飞杨晓娟潘根郑建树黄思齐
刘俊飞,杨晓娟,潘根,郑建树,黄思齐*
(1.中国农业科学院麻类研究所,湖南长沙 410221;2.中国农业科学院深圳农业基因组研究所,广东深圳 518100)
大麻(Cannabis sativaL.)是大麻科(Cannabinaceae)大麻属(Cannabis)一年生植物,别名火麻、汉麻、线麻等[1]。工业大麻是人类栽培利用最早的古老作物之一,原产于中亚和东亚,分布于世界各地,在我国有着悠久的栽培史,也是具有高附加值的特种经济作物。其种子、纤维和花叶中的天然活性成分被广泛应用于食品、纺织、材料、化妆品和医药等领域[2]。
目前,工业大麻的遗传转化体系不稳定、转化效率低,这制约了对其抗逆性、基因功能验证的研究。病毒诱导的基因沉默(virus-induced gene silencing,VIGS)是一种不依赖转基因技术的基因功能缺失研究方法[3]。转基因法研究基因功能不仅试验周期长、成本高且需要遗传转化,相比于传统的转基因技术,VIGS 技术具有沉默效率高、周期短、操作简单、经济实惠等优点,而且不需要事先知道并克隆基因全长,也无须建立遗传转化体系,只需要一段300~500 bp 的基因片段就能快速获得表型,进行基因功能的验证[4],其应用范围也更加广泛,被越来越多地应用于不同作物的基因功能研究中。
VIGS 是利用病毒载体携带植物目的基因片段,通过各种方式侵染植物,重组病毒在植物中复制产生双链RNA(double strand RNA,dsRNA),在植物自身防卫反应转录后基因沉默(post transcriptional gene silencing,PTGS)的机制作用下,dsRNA 进一步产生siRNA(small interference RNA,siRNA),该产物能够诱导与其具有同源性的植物内源目的基因mRNA 的降解,根据表型变异来进行基因功能分析,实现植物基因功能的快速鉴定[5]。VIGS体系不仅在烟草和拟南芥等模式植物上成功建立,而且也广泛应用于木薯[6]、苹果[7]、玉米[8]、棉花[9]、葡萄[10]等作物中。烟草脆裂病毒(Tobacco Rattle Virus,TRV)具有基因组较小、可以侵染植物生长点、不产生典型病毒性状、便于改造等优点,是目前在植物中应用最广泛、效果最好的VIGS 病毒载体[11],对包括烟草[12]、辣椒[13]等在内的植物均有较好的侵染效果。
目前已有在工业大麻中构建VIGS体系的相关报道,其中采用了棉花皱叶病毒(Cotton leaf crumple virus,CLCrV)作为载体,在侵染试验中,尝试了3 种不同农杆菌菌株LBA4404、GV3101 和AGL1,结果发现只有使用AGL1 转化的幼苗表现出了预期的表型效果[14]。本研究以烟草脆裂病毒(TRV)为基础研制的VIGS 载体,其TRV 介导的VIGS 技术具有沉默株率高、病毒症状温和、沉默持续性强等优点,但在不同宿主植物中,其沉默效率和成功率均有一定的差别[15]。研究显示,VIGS 系统的沉默株率受多种因素的影响。第一,插入基因序列与靶基因序列的同源性越高,其沉默效率就越高[16]。第二,基因片段的长度、方向和折叠方式对沉默的效果也有一定的影响。有研究[17]显示,在病毒载体中,基因片段的长度存在一个有效的区间,其最佳长度为200~350 bp。第三,环境因子对病毒载体的复制有一定的影响,沉默后的植物生长环境对沉默载体的沉默效果也有明显的影响。研究[18]显示,当培养温度提高时,VIGS 病毒的效果会明显减弱。第四,VIGS 的沉默株率受接种方式的影响,应针对不同的植物选择最佳的接种方式。目前的接种方式有:注射法[19]、灌根法[20]和真空浸润法[21]。VIGS 技术虽得到了广泛的应用,但工业大麻植物的再生体系和遗传转化体系尚不完善,且工业大麻VIGS 沉默株率和沉默效率存在一定的差别。
本研究以工业大麻品种云麻7 号为材料,以工业大麻八氢番茄红素脱氢酶基因为报告基因(CsPDS),利用TRV 介导的VIGS 技术沉默工业大麻CsPDS基因,当出现植株白化现象即可表明PDS基因沉默,配合通过实时荧光定量PCR 检测,验证基因表达量沉默,在此基础上,研究侵染时苗龄、不同注射方法、不同工作液OD值、不同工作液菌液比例、不同PDS片段、不同农杆菌、侵染后不同生长温度对工业大麻基因沉默株率的影响,以期建立并优化出工业大麻最适的VIGS 沉默条件,为后续工业大麻的兴趣基因功能研究奠定技术基础。
1 材料与方法
1.1 试验材料
云麻7 号种子由中国农业科学院麻类研究所原一年生麻类作物遗传育种团队提供。将云麻7号种子用4% NaClO 灭菌消毒10 min,用无菌去离子水冲洗,于培养箱中萌发2 d。将发芽2 d 的幼苗转移至m(营养土)∶m(蛭石)=3∶1 的土壤中。幼苗在昼夜温度为24 ℃/16 ℃,光周期为16 h/8 h(明/暗),相对湿度为60%,光强度为700 μmol/m2的培养箱中生长,一周龄后用于试验。
pTRV 病毒载体购自长沙天楚生物公司;大肠杆菌(Escherichia coli)菌株为DH5α,根癌农杆菌(Agrobacterium tumefaciens)菌株为GV3101、EHA105、AGL1。
1.2 病毒载体的构建
已知的工业大麻CsPDS全长1728 bp,从中选择一个300 bp 的片段,并利用同源重组方法将该片段插入pTRV2 载体中。在筛选过程中,选择抗卡那霉素(Kanamycin)作为筛选基因,同时选择EcoR1 和BamH1 作为酶切位点。
首先将工业大麻CsPDS基因的DNA 提取出来,并使用适当的引物扩增出300 bp 的CsPDS基因片段。接下来,准备pTRV2 载体,并通过EcoR1 和BamH1 酶对PCR 产物和pTRV2 载体进行酶切。这一过程会生成互补的黏性末端,然后进行同源重组,将回收的目标片段与pTRV2 载体连接,形成重组产物。最后,将重组产物导入适当的细菌宿主中,进行转化过程,使其扩增。最终,利用抗生素筛选确认带有目标插入片段的细菌克隆。
1.3 侵染液的制备
将经过正确克隆和测序的质粒载体转化到农杆菌中(包括GV3101、EHA105 和AGL1 菌株)。在含有卡那霉素(Kan 50 mg/mL)和利福平(Rif 100 mg/mL)双重抗性的LB 固体培养基上挑选单个克隆,并使用10 mL 含有卡那霉素和利福平两种抗性的LB 液体培养基来活化农杆菌。
当菌液OD600=1.0 后,在4000 r/min 的条件下,室温离心10 min 收集菌液。将收获的菌块用10 mmol/L 的MgCl2悬浮至指定浓度(OD600=0.5/1.0),确保悬浊液中含有10 mmol/L 的MES-KOH和100 μmol/L 的Acetosyringone(乙酰丁香酮)。将悬浊液在室温下黑暗环境静置3~6 h,即可得到侵染工作液。
侵染时试验组为TRV1 空载体工作液与TRV2 工作载体工作液按1∶1 的体积比进行混合,同时设置TRV1 与TRV2 空载体对照。
1.4 沉默体系优化探索
1.4.1 侵染方法的探索
选择1 周龄的云麻7 号进行叶背注射法试验。叶背注射法是使用去针头的1 mL 一次性注射器,将含有PDS基因的病毒载体侵染液(农杆菌菌种为GV3101、工作液浓度OD600=0.8、接种后温度24 ℃)通过去针注射器压迫的方式将混合液注入试验材料的第一片真叶。同时,在本试验中还尝试了真空渗透法进行侵染,具体步骤为将试验材料的真叶完全浸没于含有PDS基因的病毒载体的工作液中,然后在真空压强为0.07 MPa 的条件下进行真空处理,处理时间分别设置为5、10、15 min。
1.4.2 高效PDS片段的探索
将工业大麻PDS基因的CDS 序列输入VIGS 预测网站(https:/ /vigs.solgenomics.net/),并以拟南芥、川桑和甜瓜作为模板植物,选择3 个大小为300 bp 的片段构建载体TRV2::PDS1、TRV2::PDS2、TRV2::PDS3。其引物分别为:PDS1F:GTGAGTAAGGTTACCGAATTCCTGTATGCCCATAGT;PDS1R:AGGTGATCATATGTGCTCGGTACCGGATCC;PDS2F:GTGAGTAAGGTTACCGAATTCTTTGGCTTTTGGGTCT;PDS2R:TGGACGAGGAGAGCCCTCGGTACCGGATCC;PDS3F:GTGAGTAAGGTTACCGAATTCTCTGCCAGCTCCCTT;PDS3R:CCATGCTTCTCCTGACTCGGTACCGGATCC(定量为采用叶背注射法,农杆菌菌株为GV3101,接种后在24 ℃条件下进行,工作液浓度设定为OD600=0.8。)
1.4.3 高效工作液浓度的探索
TRV 作为载体的VIGS 工作液由TRV1 空载体菌液和搭载目的基因的TRV2 载体菌液混合而成,工作液OD600的数值对农杆菌侵染有重要的影响。本研究采用叶背注射法,选择工业大麻PDS基因的960~1259 bp 片段作为目标片段。农杆菌菌株为GV3101,在接种后保持温度为24 ℃。通过调节工作液的浓度来探索不同OD600值(包括0.5 和1.0)下VIGS 对PDS基因沉默效果的影响。
1.4.4 高效农杆菌菌种的探索
采用叶背注射法将携带pTRV2::CsPDS1 的农杆菌菌株GV3101、EHA105 和AGL1 分别用于侵染工业大麻的第一片真叶。定量试验中,选择工业大麻PDS基因的960~1259 bp 片段作为目标区域,工作液的浓度设定为OD600=1.0,接种后保持温度为24 ℃。
1.4.5 侵染苗龄的探索
将1 周龄和3 周龄的云麻一号叶片使用叶背注射法进行注射。1 周龄叶片较厚且柔软,易于注射;3 周龄叶片变薄且坚硬,难以进行注射。
1.5 数据处理
以白化植株出现的百分率标记为VIGS 的沉默株率,计算方法为:植株沉默株率=(白化株数/转化总株数)×100%。
1.6 侵染后白化基因表达量变化
选择出现白化表型的工业大麻植株,取其第一对真叶作为注射叶片(机械损伤)。随后,分别采集第二对和第三对真叶进行取样。使用预冷的剪刀迅速剪下叶片,并将其放入液氮中进行冷冻处理,随后储存在-80 ℃冰箱备用。接下来,采用Trizol 方法提取RNA,并使用HisScript III RT SuperMix for qPCR(南京诺维赞生物公司)将其反转录成cDNA。最后,利用实时荧光定量PCR(RTqPCR)检测目标基因的表达情况。RT-qPCR 引物为F:GCCCCAGACAAAGATCTCCT,R:AAATTCTCTGACCCCGAGCA;工业大麻内参基因ACTIN 为F:CCAATAGCCTTGCATTCCAT,R:TCGATTGGAAAGCCGAATAC。
2 结果与分析
2.1 工业大麻沉默体系优化
由图1 可以看出,PDS基因沉默后,植株都出现了不同程度的白化现象。

图1 PDS 基因沉默后植株表型Fig.1 Plant phenotypes after PDS gene silencing
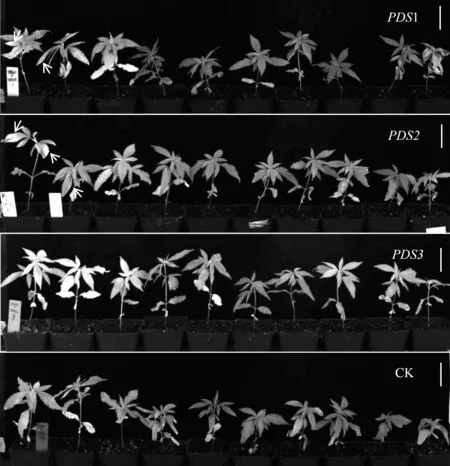
图2 注射PDS1、PDS2、PDS3 及空载体(CK)片段后两周的植株Fig.2 Plants injected with PDS1, PDS2, PDS3 and empty vector(CK)fragments for two weeks

图3 两个不同OD600工作液的侵染效果Fig.3 Infection effects of working solutions at two different OD600

图4 3 种不同农杆菌侵染效果Fig.4 Infection effects of three Agrobacterium strains

图5 不同真空时间抽真空法侵染后的植株Fig.5 Plants infected by vacuum pumping method at different vacuum time

图6 白化后的工业大麻叶片Fig.6 Cannabis leaves after albinism
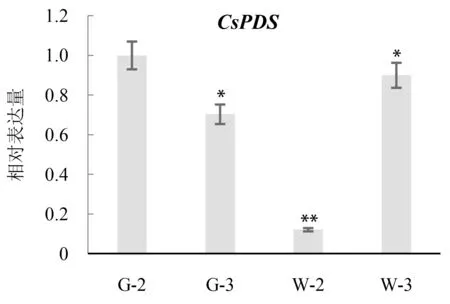
图7 两株VIGS 处理后工业大麻出现白化和未出现白化的真叶中PDS 基因表达量Fig.7 The expression levels of PDS genes in the albino and non albino true leaves of two VIGS treated cannabis plants
2.1.1 侵染苗龄的确定
VIGS 侵染的效率与病毒感染的细胞数量有直接关系,感染细胞数越多,沉默效率越高。采用注射法侵染时,当苗龄超过3 周,叶片逐渐变薄变硬,叶背注射难以实现,细胞感染数量变少,而在1 周龄时叶片最容易注射,故选用1 周龄作为注射时间。
2.1.2 不同PDS片段注射后的表型
使用叶背注射法进行侵染试验,工作液的浓度设定为OD600=0.8。农杆菌菌株采用GV3101,TRV2 载体分别携带PDS基因的不同片段,包括TRV2::PDS1(960~1259 bp)、TRV2::PDS2(126~425 bp)、TRV2::PDS3(618~917 bp)。每个组分别侵染了15 株植株。结果显示,PDS1 和PDS2 组的白化率均为13.3%,而PDS3 组没有出现白化现象。

表1 不同PDS 片段注射后的白化效率Table 1 Albinism efficiency after injection of different PDS fragments
2.1.3 不同OD值工作液注射后的表型
采用叶背注射法,在使用工业大麻PDS的960~1259 bp 片段、农杆菌菌种为GV3101 的情况下,工作液OD600=0.5 以及OD600=1.0 组分别侵染一周龄工业大麻10 株。当工作液OD600=1.0 时,有5 株样品出现白化现象,沉默株率为50%,当工作液OD600=0.5 时有1 株样品出现白化现象,沉默株率为10%。

表2 不同浓度工作液注射后的白化效率Table 2 Albinism efficiency after injection of working solution at different concentrations
2.1.4 不同农杆菌菌株注射后的表型
在定量为叶背注射法、使用工业大麻PDS的960~1259 bp 片段、工作液OD600=1.0 的情况下,分别用GV3101、EHA105、AGL1 3 种携带TRV2::PDS的农杆菌菌株侵染工业大麻,每组分别侵染一周龄工业大麻10 株。侵染3 周后,注射GV3101 菌株的有3 株出现白化,注射EHA105 菌株的未出现白化,注射AGL1 菌株的有1 株出现白化。

表3 不同农杆菌注射后的白化效率Table 3 Albinism efficiency after injection of different Agrobacterium strains
2.1.5 抽真空法真空时间的探索
采用真空渗透法侵染1 周龄工业大麻,在真空压力为0.7 MPa 条件下,分别抽真空5、10、15 min。每组各设10 株重复,在生长3 周后发现3 组样品均无白化现象,表明抽真空法在云麻7 号上较难实现。
2.1.6 叶片的侵染效果
在侵染后2~3 周,植株出现白化现象,可以观察到第一对真叶由于注射引起机械损伤及老化,出现干枯坏死现象,靠近注射叶的第二对真叶出现白化,且仅接种植株的新生叶片局部白化,表明感染是局部性的,TRV 在细胞间和植物体全身的运动都受到限制,尤其是在整个植物体中的运动受限。
2.2 沉默后基因表达量分析
选取两株VIGS 处理后的工业大麻植株,分别为出现(W)和未出现(G)白化的植株。取其第二对(W-2、G-3)及第三对真叶(W-3、G-3)进行RT-qPCR 检测。根据结果可知,出现白化的植株,第二对真叶(W-2)的PDS基因表达量相比其他叶片明显降低,可证明白化现象是由PDS基因沉默导致。
3 讨论
人们常通过沉默或敲除八氢番茄红素脱氢酶(PDS)基因,观察是否获得白化表型植株,以此验证沉默体系是否工作。以TRV 病毒为基础的VIGS 系统具有寄主范围广、沉默效率高、持续时间长、病毒症状轻、分生感染等优势,是VIGS 中应用最为广泛的一种系统[22]。但是,VGIS 载体的使用受宿主的限制,大多数只能用于烟草和番茄。
有报道使用棉花皱叶病毒(CLCrV)为载体[14],并以AGL1 作为侵染农杆菌,得到的沉默效率高于使用GV3101 农杆菌的。但在不同宿主植物中,同样的载体选择,其沉默效率和成功率都有一定的差别。TRV 载体沉默株率高,病毒症状温和,沉默持续性强。本研究以烟草脆裂病毒(TRV)为基础探索VIGS 载体,结果表明,当使用TRV 时,GV3101 农杆菌侵染会得到预期的结果。
目前,VIGS 沉默的主要途径有机械、金属离子轰击和农杆菌等,其中农杆菌介导技术相对于其他途径更加简便、有效,因而得到了广泛的应用[23]。农杆菌介导的途径有多种,如:牙签刺伤法、真空渗透法、叶背注射法、高压喷枪法等。本试验采用叶背注射法进行侵染,得到了沉默效果,采用真空浸透法未出现沉默,可能是菌液进入植株的数量不足,可以探讨是否可将两种方法结合使用。保证带有重组载体的菌液进入植株,是确保VIGS 技术成功的关键因素。
本研究使用了叶背注射法和抽真空法使菌液进入植物体内,其中抽真空法适用于叶片较窄且较硬的植物,注射法适用于叶片较厚且软的植物[24]。工业大麻在3 周龄前叶片较厚而柔软,使用注射法可将菌液顺利注射进入植物体内,但此时叶片较小,进入的菌液量较少,这可能导致了叶片不能完全白化。本研究使用三周龄前的工业大麻进行抽真空法侵染,而工业大麻在3 周龄后叶片逐渐变薄变硬,易于抽真空法菌液的进入[25],这可能是本研究抽真空法未能出现表型的原因之一。
在本试验所有白化结果中,只有靠近注射叶的第二对真叶出现白化,白化叶片也并未像马铃薯、棉花等作物一样整株白化,即单株沉默效果较低,说明TRV 在工业大麻细胞间和全身的运动都受到限制,下一步研究方向为提高病毒对工业大麻的侵染效率,以优化沉默体系。
有研究[26]显示,在适宜温度条件下,SiRNA 能够调控VIGS 的活性,但在较高的温度条件下,VIGS基因会迅速退化,无法保持持久、稳定的沉默。此外,很多抗病毒的通路还取决于温度的调控,比如AGOs、DCLs、RDR[27]。病毒在入侵宿主细胞后,必须在适当的温度下进行繁殖[28]。除了对低温依赖性的病毒以外,大部分的植物病毒都能在20~25 ℃发生感染[29]。本研究侵染后将植株放在24 ℃环境下培养,可根据温度调控进一步优化体系。本研究使用的材料为2~3 周龄的工业大麻,对于一些在更大周龄表达的功能基因,该VIGS体系是否起作用还有待商榷,后续需使用花期的工业大麻继续探索其沉默体系,沉默该时期表达的基因,以验证基因功能。
对于工业大麻VIGS 沉默体系,目前还存在沉默株率低、沉默叶片数较少、等待周期较长、条件不够完善等缺点,需要继续优化体系,以保证更高效的沉默。
4 结论
研究结果表明,侵染的苗龄、侵染方式、目的基因的片段、菌液浓度、农杆菌的菌株对VIGS 沉默效果均具有明显的影响,其中最适宜的体系为使用GV3101 农杆菌,PDS基因选取片段为960~1259 bp 或126~425 bp,接种浓度OD600为1.0,最佳的接种方式是在一周苗龄采用叶背注射法,接种后培养温度为24 ℃,培养2~3 周即可出现表型。
