小檗碱通过激活肌成纤维细胞铁死亡减轻肾脏纤维化*
2023-11-22凌生涛孙鑫波姚启盛
刘 波 王 黎 凌生涛 孙鑫波 姚启盛
近年来慢性肾脏病(Chronic Kidney Disease,CKD)在国内外呈逐年上升趋势,据不完全统计,我国成人CKD的发病率约为10.8%[1]。肾脏纤维化是所有CKD的共同终点,也是CKD的治疗靶点[2]。肌成纤维细胞是驱动纤维化的效应细胞,激活机制复杂且不明确。当前认为,肾纤维化形成主要与肌成纤维细胞及其产生的细胞外基质积聚有关,但肌成纤维细胞的调控还未完全阐明。
铁死亡是一种新型的程序性细胞死亡,其特征是细胞内铁超载和脂质活性氧的积累。铁死亡细胞表现出铁代谢紊乱、脂质过氧化积累、谷胱甘肽(GSH)和GPX4缺乏[3]。酰基辅酶a合成酶长链家族成员4(ACSL4)是一种参与脂质代谢的重要酶,被认为是铁死亡的标记蛋白。铁死亡与多种人类疾病有关,在多器官疾病中起着重要作用,包括脑、心、肾和肝脏疾病[4,5]。研究表明,铁死亡在缺血/再灌注诱导的急性肾损伤(Acute Kidney Injury,AKI)中起重要作用,也是其它AKI模型的致病因素[6-8]。可见,铁死亡是一个很有前途的治疗靶点,但肾脏纤维化过程中是否有铁死亡发生尚不清楚,其作用也没有得到充分的研究。
小檗碱(Berberine,BBR)作为黄莲的主要活性物质之一,是许多疾病的有效治疗药物,包括炎症、糖尿病和癌症[9,10]。BBR对肾脏代谢性疾病也有良好的临床治疗效果。Li等[11]和Wang等[12]均发现BBR可显著降低血清尿酸水平,改善肾脏功能障碍引起的代谢紊乱。但是,目前BBR在肾脏纤维化中的研究报道较少,本研究主要采用单侧输尿管结扎造成梗阻(UUO)建立肾小管间质纤维化实验动物模型,探讨肾纤维化过程中铁死亡的作用。本研究通过体外和体内实验证实了BBR对肌成纤维细胞铁死亡的作用及对肾纤维化的影响,为BBR在肾脏纤维化中的应用提供更多参考。
1 材料与方法
1.1 动物分组及UUO模型建立
40只雄性C57BL/6J 小鼠(20-25g)随机分为6组:假手术组(Sham组,n=7),模型组(UUO组,n=7),小檗碱假手术组(Sham+BBR组,n=7),小檗碱模型组(UUO+BBR组,n=7),铁死亡抑制剂模型组(UUO+Fer-1组,n=6),小檗碱+铁死亡抑制剂模型组(UUO+BBR+Fer-1组,n=6)。通过结扎左侧输尿管引起持续尿路压力升高建立UUO模型[2]。备皮消毒后在小鼠左腹部切开约1cm左右手术切口,逐层分离腹部组织直至腹腔,医用棉签轻轻挤出左肾,找到肾盂并向下游离输尿管,使用0号丝线于左侧输尿管肾孟结合处以及向下0.3cm左右予以两处结扎,并在两处结扎中间段离断输尿管,然后逐层缝合关闭腹腔,所有建模小鼠全部建模成功。随后各组小鼠进行相应药物干预,持续10天。Sham组只行同样分离输尿管处理不予结扎。BBR购自MedChemExpress公司(货号:2086-83-1),采用灌胃给药(200mg/kg/天)。铁死亡抑制剂Fer-1(1mg/kg/天)采用30G大小的胰岛素针在尾静脉仪辅助下行尾静脉注射。10天后对所有试验小鼠实施安乐死并留取肾组织进行后续分析。本试验动物由湖北医药学院动物实验中心提供。所有动物实验程序均经中国湖北医药学院实验动物委员会批准,符合国家卫生研究院《实验动物护理和使用指南》。
1.2 细胞培养及处理
肾肌成纤维细胞(NRK49F)购自武汉普诺赛生命科技有限公司,用10%胎牛血清+1%双抗+DMEM于 37℃、5% CO2的培养箱中培养。取对数期生长的NRK49F细胞,以1.0×106细胞/皿的密度铺于35mm培养皿中,当细胞生长密度达到80%—90%时即可进行干预。前期实验筛选出BBR的最佳作用浓度为50μM,最佳作用时间为48h。将NPK4F9细胞分为:对照组(上述培养液培养)、Fer-1组(上述培养液+1μM Fer-1培养)、铁死亡激动剂(Erastin)组(上述培养液+5μM Erastin培养)、Erastin+Fer-1组(上述培养液+1μM Fer-1+5μM Erastin培养)、BBR组(上述培养液+50μM BBR培养)和BBR+Fer-1组(上述培养液+50μM BBR+1μM Fer-1培养)。Erastin和Fer-1均用DMSO溶解稀释至实验浓度。48h后收集各组细胞,用SDS裂解液提取各组细胞蛋白进行后续实验。每组重复3次。
1.3 苏木精-伊红(HE)、马松三色(Masson)和免疫组化染色
分别将各组小鼠摘取的肾组织于4℃条件下经生理盐水灌洗后取部分肾组织放入10%福尔马林中固定,留取肾皮质部分放入液氮保存,24h后放入-80℃冰箱中冻存备用。
1.3.1 HE染色:取各组小鼠部分肾组织用10%的甲醛固定48h,经梯度酒精脱水后用二甲苯透明30min,石蜡包埋切片,切片用梯度酒精脱蜡后苏木精染液染色5min,流水冲洗1min,流水冲洗至切片返蓝,伊红染液染色3min,流水洗去伊红染液后用梯度酒精脱水,二甲苯透明,中性树胶封存,光学显微镜下观察各组肾组织病理改变。
1.3.2 Masson染色:将各组肾脏组织石蜡切片脱蜡后用梯度酒精脱水,将脱水后的肾组织依次经苏木精、酸性丽春红、1%磷钼酸、苯胺蓝染色,梯度酒精脱水,二甲苯透明,中性树胶封存。400倍光学显微镜下观察各组肾组织胶原纤维沉积并采集图像。采用Image J工具计算胶原蛋白面积分数定量间质纤维化,即蓝色区域(胶原蛋白)占每个区域总面积的百分比。
1.3.3 免疫组化染色:将肾脏组织切片在10mM柠檬酸钠、0.05% Tween-20、pH6.0中提取抗原后,通过3%过氧化氢孵育以阻断内源性过氧化物酶活性,然后加入2.5%正常马血清以减少非特异性结合。α平滑肌肌动蛋白(α-SMA)一抗(RnDSystems,MAB1420-SP,1∶20)在4℃孵育过夜。用抗体稀释剂代替一抗作为阴性对照。光学显微镜下观察各组肾染色情况。α-SMA组化定量分析采用从外髓质和肾皮质区域中每个标本的10个随机挑选的图像中计数α-SMA阳性细胞。数据表示为阳性细胞数/mm2。
1.4 铁、GSH、脂质过氧化和MDA的测定
1.2中细胞裂解离心后收集细胞裂解液的上清液并匀质化。使用铁测定试剂盒(货号:ab83366,Abcam)通过比色法测定铁水平(Fe2+)。使用总GSH/氧化GSH检测试剂盒(货号:S0053,上海碧云天生物技术有限公司)通过比色法进行GSH分析。使用脂质过氧化检测试剂盒(货号:A106,南京建成生物工程研究所)按照说明检测细胞裂解液中的脂质过氧化物酶水平。使用脂质氧化(MDA)检测试剂盒(货号:S0131S,上海碧云天生物技术有限公司)采用比色法检测MDA含量。
1.5 Western Blot检测α-SMA ACSL4和GPX4蛋白
将1.2中收集的蛋白进行免疫印迹分析。用10%SDS-PAGE电泳将蛋白转移到PVDF膜上,然后用5%脱脂奶粉或者5%BSA进行封闭后,将膜与相应的一抗在4℃摇床孵育过夜。一抗如下:α-SMA(1∶500)、ACSL4(1∶2 000)、GPX4(1∶1 000)和β-actin (1∶5 000)。然后将膜与辣根过氧化物酶HRP标记的二抗在室温孵育1h。使用ECL化学发光试剂和系统检测蛋白表达,采用目标蛋白与β-actin蛋白条带灰度值的比值表示目标蛋白的相对表达量。
1.6 统计学处理

2 结 果
2.1 各组小鼠肾组织HE染色、Masson染色和α-SMA免疫组化染色结果比较
与Sham组相比,UUO组出现肾小管扩张、刷状缘丢失(图1A)、肾脏间质纤维化(图1B)、α-SMA阳性细胞数增加(t=7.015,P<0.05,表1)。与UUO组相比,UUO+BBR组肾小管扩张和刷状缘丢失减少(图1A)、肾脏间质纤维化面积减少(t=5.338,P<0.05,图1B)、α-SMA阳性细胞数减少(t=9.074,P<0.05,表1)。与UUO+BBR组相比,UUO+BBR+Fer-1组肾小管扩张和刷状缘丢失增多(图1A)、肾脏间质纤维化面积增多(t=8.146,P<0.05),α-SMA阳性细胞数减少(t=6.907,P<0.05)(表1)。

表1 各组小鼠肾脏间质纤维化面积(Masson半定量)及α-SMA阳性细胞数比较
2.2 各组NRK49F细胞Fe2+、GSH、MDA、脂质ROS水平比较
各组NRK49F细胞Fe2+、GSH、MDA、脂质ROS水平差异均有统计学意义(P<0.05)。与对照组相比,Fer-1组Fe2+、MDA、脂质ROS降低,GSH的升高;与Erastin组相比,Erastin+Fer-1组Fe2+、MDA、脂质ROS降低,GSH升高;与BBR组相比,BBR+Fer-1组Fe2+、MDA、脂质ROS降低,GSH的升高(t均>8.547,P均<0.05)。见表2。
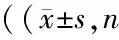
表2 各组细胞Fe2+、GSH、MDA以及脂质ROS的相对含量均=3)
2.3 各组NRK49F细胞α-SMA、ACSL4和GPX4蛋白水平比较
各组NRK49F细胞α-SMA、ACSL4和GPX4蛋白水平差异有统计学意义(P<0.05)。与对照组相比,Fer-1组α-SMA蛋白表达降低(t=7.988,P<0.05),GPX4和ACSL4蛋白水平差异无统计学意义(P>0.05)。与Erastin组相比,Erastin+Fer-1组α-SMA和GPX4蛋白水平升高,ACSL4水平降低(t均>7.176,P均<0.05)。与BBR组相比,BBR+Fer-1组α-SMA和GPX4蛋白水平增加,ACSL4水平降低(t均>5.623,P均<0.05),见表3。

表3 各组细胞α-SMA、ACSL4和GPX4蛋白水平比较均=3)
3 讨 论
CKD是当前比较重要的一个公共卫生问题,它影响着全球约10%以上的人口[13-15]。尽管肾纤维化的形成存在有多种病因,但它是所有类型CKD的最终常见病理改变,且目前还没有能有效治疗肾纤维化的策略。肾间质肌成纤维细胞位于间质中,不但可以通过连接相邻的肾小管促进组织重构,而且具有调节细胞外基质成分的功能。通常认为肌成纤维细胞是肾纤维化发展的最终执行者[16]。成纤维细胞和肾小管上皮细胞通常相互串扰和传递信息,可在生理条件下促进肾脏修复或在不适应条件下加重疾病进展。铁死亡与肾纤维化之间的关系是一个活跃的研究领域。肾脏是易于发生纤维化的器官之一。在某些慢性肾脏疾病,如慢性肾小球肾炎中,铁的沉积和代谢紊乱可能与纤维化密切相关。铁的过度沉积和氧化应激可能引发炎症反应、细胞凋亡和细胞外基质沉积,从而促进纤维化的发生和进展。铁死亡与肾纤维化之间存在复杂的关系,铁死亡在肾纤维化研究中是一个有前途的研究方向,对于更好地了解肾纤维化的发生机制,以及可能的治疗方法具有重要意义。
BBR是一种重要的季系苯基异喹啉生物碱,被认为是可以治疗多种疾病的天然产物之一[17]。最近有学者发现,BBR有减轻组织器官纤维化的作用,如BBR可通过抑制肝星状细胞的增殖和细胞外基质的产生减轻肝纤维化[18]。Wang等[12]发现,BBR可通过激活AMPK通路,抑制转化生长因子-β1(TGF-β1)/Smad3信号通路,从而改善与肥胖相关的脂肪组织纤维化。还有研究[19]发现,BBR治疗降低了肥胖小鼠的胰岛素抵抗,改善了附睾白色脂肪组织纤维化。因此,BBR是一种有前途的治疗纤维化疾病的药物,需要更多的研究来证实其在治疗纤维化疾病方面的作用。本研究通过小鼠UUO模型证实了BBR能够减少肾脏病理损伤、肾脏间质纤维化和α-SMA阳性细胞数(图1和表1)。体外研究发现,BBR能有效减少肾肌成纤维细胞中α-SMA的表达。表明BBR可能通过抑制肾肌成纤维细胞的活化,减轻小鼠肾小管间质纤维化。
铁死亡是一种涉及自身免疫性过程的疾病,主要表现为肾脏组织中铁储存过多,导致自身免疫性损伤。在某些还原剂的作用下,包括超氧化物(ROS的主要种类),铁蛋白结合的Fe3+可以被还原为Fe2+,然后从铁蛋白中释放出来促进细胞铁死亡[20]。此外,铁死亡与代谢和氧化还原信号传导以及多种病理生理条件有关,包括肝肾等器官的纤维化[21,22]。这与本研究中观察到的结果是一致的。本研究表2结果显示,铁死亡参与BBR介导的肾纤维化减轻肾损伤发生发展过程。证实了BBR可诱导肾肌成纤维细胞铁死亡,Fer-1可消除BBR的这种作用,进一步表明BBR对肾纤维化的影响是通过调控肌成纤维细胞铁死亡实现的。
总之,本研究结果证实,BBR可抑制肾肌成纤维细胞的活化并减轻小鼠肾小管间质纤维化;BBR可诱导肾肌成纤维细胞的铁死亡;Fer-1能有效降低BBR抗肾纤维化的作用。这些结果为BBR在铁死亡调控中的潜在药理作用提供了一个视角,并为肾纤维化的治疗提供了思路。
