苍术素调节PINK1/Parkin信号通路对膝骨关节炎大鼠线粒体自噬的影响*
2023-11-22叶海东甄朋超
叶海东 刘 宇 甄朋超
膝骨关节炎(Knee Osteoarthritis,KOA)作为一种以软骨损伤退变为主要病理改变的退行性和慢性关节疾病,仍是导致残疾和疼痛的主要原因之一,且多发于老年人[1,2]。尽管目前有可用的治疗KOA的方法(包括手术和非手术),但其疗效仍尚未能满足医疗需求[3]。因此,开发能够缓解、阻止甚至逆转KOA进展的新治疗策略一直是广大临床和科研工作者的首要任务。近年来,中医药作为KOA的常见辅助疗法,在KOA治疗中显示出独特优势,且其可通过减轻膝关节炎症、抑制软骨细胞外基质降解等途径来缓解KOA[4,5]。苍术素是一种从菊科植物苍术或北苍术的干燥根茎中提取出的有效单体成分,具有抗菌、抗氧化、抗炎和抗肿瘤等多种药理活性[6,7]。已有研究表明,苍术素能够抑制白细胞介素-1β(IL-1β)诱导的人KOA软骨细胞炎症反应[8]。但苍术素对KOA的作用机制仍未完全明确。线粒体功能障碍可促使软骨细胞自噬和凋亡之间的失衡,导致软骨退化,加速KOA进展[9]。此外,促进PINK1/Parkin介导的线粒体自噬可保护骨关节炎中软骨细胞[10];且增强关节软骨细胞自噬有助于防止骨关节炎中软骨细胞凋亡[11]。基于此,本研究通过构建KOA大鼠模型,探究苍术素对软骨组织中PINK1/Parkin介导的线粒体自噬的影响,为苍术素用于KOA临床治疗提供实验基础。
1 材料与方法
1.1 实验动物
80只SPF级健康雄性SD大鼠(3-4月龄,体质量330-370g)购自北京斯贝福生物技术有限公司,许可证号:SCXK(京)2019-0010。所有大鼠在恒温(22-23℃)、恒湿(50-60%)的SPF级动物房统一饲养,每天使用灯光控制光照/黑暗(12h/12h),自由进食饮水。本研究动物实验严格遵循3R原则,符合中华人民共和国国家标准《实验动物福利伦理审查指南》中相关准则。
1.2 主要试剂
碘乙酸钠、自噬抑制剂3-MA(I9148-5G、189490-100MG)购自美国Sigma公司;苍术素(B20128-20mg,HPLC≥98%)购自上海源叶生物科技有限公司;肿瘤坏死因子-α(TNF-α)、IL-1β、软骨寡聚基质蛋白(Cartilage Oligomeric Matrix Protein,COMP)ELISA试剂盒(E-EL-R2856c、E-EL-R0012c、E-EL-R0159c)、TUNEL原位细胞凋亡试剂盒(HRP-DAB显色法,E-CK-A331)以及免疫组化试剂盒(带DAB显色液,E-IR-R215)均购自武汉伊莱瑞特生物科技股份有限公司;改良番红O-固绿软骨染色液(G1371)购自北京索莱宝科技有限公司;组织ROS检测试剂盒(DHE,470515-200T)购自上海雅吉生物科技有限公司;兔源一抗cleaved Caspase-3(PA5-114687)购自美国Invitrogen公司;兔源一抗Beclin1、LC3、GAPDH(ab207612、ab192890、ab181602),鼠源一抗PINK1、Parkin(ab186303、ab77924)以及二抗HRP标记羊抗兔或鼠IgG(ab205718、ab6789)购自英国Abcam公司。
1.3 动物分组、造模与药物干预
大鼠适应性饲养7天后按随机数表法分为对照组、模型组、(低、高)剂量苍术素组和高剂量苍术素+ 3-MA组,每组16只。除对照组外,其余组大鼠采用关节腔内注射碘乙酸钠法构建KOA模型[12],具体操作为:大鼠麻醉后,使用30号针头穿过髌下韧带注射4mg碘乙酸钠溶液(将碘乙酸钠溶解于50μl生理盐水中)至后肢膝关节腔内。对照组于相同部位注射50μl生理盐水。
造模3周(经膝关节红肿、活动受限等情况确认造模成功)后,(低、高)剂量苍术素组大鼠腹腔注射3mg/kg、6mg/kg苍术素[13](预实验已证实,3mg/kg、6mg/kg苍术素对正常SD大鼠无明显毒性作用);高剂量苍术素+3-MA组大鼠腹腔注射6mg/kg苍术素和15mg/kg 3-MA[14];对照组、模型组注射等量生理盐水,每天1次,持续给药3周。
1.4 ELISA检测大鼠血清中TNF-α、IL-1β、COMP水平
给药结束24h后所有大鼠进行麻醉,腹主动脉取血5ml,静置1h后3 000r/min离心10min,获取上层血清,参照ELISA试剂盒说明书步骤检测血清TNF-α、IL-1β、COMP水平。
1.5 番红O-固绿染色检测大鼠膝关节软骨组织病理学改变
腹主动脉取血后使大鼠安乐死,打开患肢膝关节腔,小心取出关节软骨,每组随机选取8只大鼠的关节软骨置于4%多聚甲醛固定24h,10% EDTA溶液脱钙后制备常规石蜡切片(5μm)。将切片脱蜡至水,随后分别使用Weigent染液、固绿染液染色5min,蒸馏水冲洗后加入番红O染液孵育2min。光学显微镜观察并拍照,软骨基质呈红色。每张切片随机选取5个视野,根据膝关节软骨结构(0-6分)、软骨细胞数量和分布(0-3分)、基质染色(0-4分)、潮线完整性(0-1分)进行Mankin’s评分[15],Mankin’s评分越高,膝关节软骨退变越严重。
1.6 TUNEL染色检测大鼠膝关节软骨细胞凋亡率
将1.5中制备的石蜡切片脱蜡至水,根据TUNEL原位细胞凋亡试剂盒说明,分别添加0.2% Trition X-100、3% H2O2、DNase I、Streptavidin-HRP工作液等试剂进行处理,DAB显色,苏木素复染核,在光学显微镜下观察拍照,TUNEL阳性染色细胞即为凋亡细胞(呈棕黄色)。随机选取6个视野对凋亡细胞和总细胞进行计数(Image-Pro Plus 6.0软件),计算凋亡率,凋亡率(%)=凋亡细胞数/总细胞数×100%。
1.7 DHE荧光探针检测大鼠膝关节软骨组织中ROS水平
将1.5中制备的石蜡切片脱蜡至水,经抗原热修复、0.2% Trition X-100、3% H2O2处理后添加DHE ROS探针室温孵育30min,在激光扫描共聚焦显微镜下观察拍照(ROS染色呈红色),并随机选取6个视野通过Image-Pro Plus 6.0软件分析积分光密度,以单位面积内积分光密度即平均光密度(Average Optical Density,AOD)表示ROS水平。
1.8 免疫组化检测大鼠膝关节软骨组织中cleaved Caspase-3、LC3阳性表达
将1.5中制备的石蜡切片脱蜡至水后置于枸橼酸盐缓冲液中煮沸进行抗原热修复,加入3% H2O2灭活内源性过氧化物酶,正常山羊血清封闭后加入兔源一抗(cleaved Caspase-3、LC3抗体)4℃孵育过夜,加入生物素标记二抗37℃孵育30min,DAB显色,苏木精复染核。在光学显微镜下观察拍照(阳性细胞呈棕黄色),随机选取6个视野计数阳性细胞和总细胞(Image-Pro Plus 6.0软件),计算阳性细胞比例(阳性细胞数/总细胞数×100%)。
1.9 Western Blot检测大鼠膝关节软骨组织中自噬以及PINK1/Parkin通路相关蛋白表达
剩余8只大鼠的膝关节软骨使用RIPA裂解液充分裂解,获取组织中总蛋白,BCA法检测蛋白浓度。各样品取20μg变性蛋白进行SDS-PAGE电泳,并通过电转移将蛋白转至PVDF膜,5%脱脂奶粉封闭膜2h,膜与一抗(Beclin1、LC3、PINK1、Parkin、内参GAPDH抗体)在4℃下孵育过夜,与对应种属的二抗在37℃下孵育45min,化学发光试剂显色。凝胶成像系统扫描图像,Image-Pro Plus 6.0软件分析蛋白条带灰度。以目标蛋白与内参蛋白条带灰度值的比值作为目标蛋白的相对表达水平。
1.10 统计学处理

2 结 果
2.1 各组大鼠血清中TNF-α、IL-1β、COMP水平比较
如表1所示,各组大鼠血清中TNF-α、IL-1β、COMP水平差异均有统计学意义(P<0.05)。与对照组比较,模型组大鼠血清中TNF-α、IL-1β、COMP水平升高(q均>21.582,P<0.05);与模型组比较,低、高剂量苍术素组大鼠血清中TNF-α、IL-1β、COMP水平均降低(q均>10.320,P<0.05);与高剂量苍术素组比较,高剂量苍术素+3-MA组大鼠血清中TNF-α、IL-1β、COMP水平升高(q均>12.384,P<0.05)。

表1 各组大鼠血清中TNF-α、IL-1β、COMP水平比较
2.2 各组大鼠膝关节软骨组织病理学改变
番红O-固绿染色结果显示(如图1、表2),对照组大鼠膝关节软骨表面光滑,细胞排列整齐,基质染色均匀,潮线完整;相比于对照组,模型组大鼠膝关节软骨层变薄且表面粗糙,出现较多裂隙,细胞排列紊乱且数量减少,基质染色消退,潮线不清晰,同时Mankin’s评分升高(q=20.987,P<0.05);相比于模型组,低、高剂量苍术素组大鼠膝关节软骨病理损伤有所减轻,表现为软骨层变厚且表面更加光滑,裂隙减少,细胞数量增多且排列较有序,基质染色增多,潮线较清晰,同时Mankin’s评分降低(q均>5.865,P<0.05);相比于高剂量苍术素组,高剂量苍术素+3-MA组大鼠膝关节软骨病理损伤加重,同时Mankin’s评分升高(q=9.521,P<0.05)。

图1 各组大鼠膝关节软骨组织病理学改变(番红O-固绿,×100)

表2 各组大鼠膝关节软骨Mankin’s评分、细胞凋亡率和ROS水平比较
2.3 各组大鼠膝关节软骨细胞凋亡率比较
如图2、表2所示,各组大鼠膝关节软骨细胞凋亡率差异均有统计学意义(P<0.05)。与对照组比较,模型组大鼠膝关节软骨细胞凋亡率升高(q=11.729,P<0.05);与模型组比较,低、高剂量苍术素组大鼠膝关节软骨细胞凋亡率降低(q均>5.368,P<0.05);与高剂量苍术素组比较,高剂量苍术素+3-MA组大鼠膝关节软骨细胞凋亡率升高(q=5.739,P<0.05)。
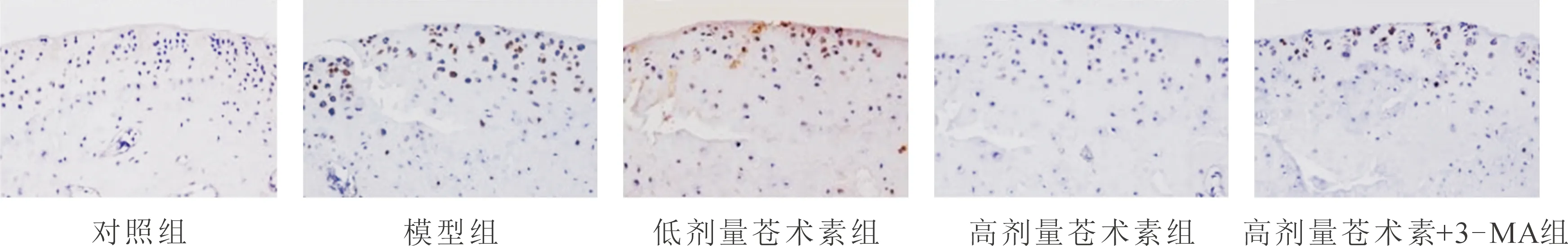
图2 各组大鼠膝关节软骨细胞凋亡情况(TUNEL,×200,凋亡细胞呈棕黄色,细胞核呈蓝色)
2.4 各组大鼠膝关节软骨组织中ROS水平比较
如图3、表2所示,各组大鼠膝关节软骨组织中ROS水平比较差异有统计学意义(P<0.05)。与对照组比较,模型组大鼠膝关节软骨组织中ROS水平升高(q=10.735,P<0.05);与模型组比较,低、高剂量苍术素组大鼠膝关节软骨组织中ROS水平降低(q均>4.880,P<0.05);与高剂量苍术素组比较,高剂量苍术素+3-MA组大鼠膝关节软骨组织中ROS水平升高(q=5.855,P<0.05)。

图3 各组大鼠膝关节软骨组织中ROS表达(DHE荧光探针,×200,DHE染色细胞呈红色,细胞核呈蓝色)
2.5 各组大鼠膝关节软骨组织中cleaved Caspase-3、LC3阳性表达水平比较
如图4、表3所示,各组大鼠膝关节软骨组织中cleaved Caspase-3、LC3阳性表达水平差异均有统计学意义(P<0.05)。与对照组比较,模型组大鼠膝关节软骨组织中cleaved Caspase-3、LC3阳性细胞比例均升高(q均>6.648,P<0.05);与模型组比较,低、高剂量苍术素组大鼠膝关节软骨组织中cleaved Caspase-3阳性细胞比例降低,LC3阳性细胞比例进一步升高(q均>8.554,P<0.05);与高剂量苍术素组比较,高剂量苍术素+3-MA组大鼠膝关节软骨组织中cleaved Caspase-3阳性细胞比例升高,LC3阳性细胞比例降低(q均>12.936,P<0.05)。

图4 各组大鼠膝关节软骨组织中cleaved Caspase-3阳性表达(免疫组化,×200)
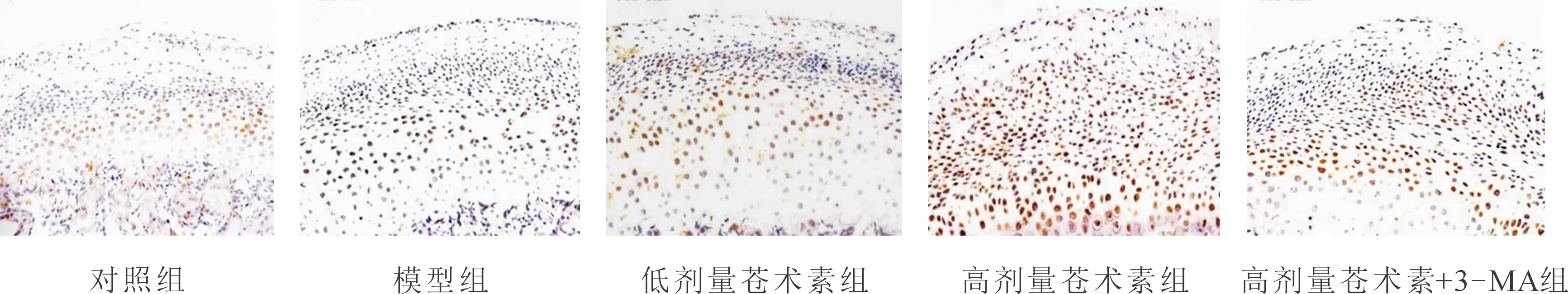
图5 各组大鼠膝关节软骨组织中LC3阳性表达(免疫组化,×200)

表3 各组大鼠膝关节软骨组织中cleaved Caspase-3、LC3阳性细胞比例比较
2.6 各组大鼠膝关节软骨组织中自噬和PINK1/Parkin通路相关蛋白表达水平比较
如图6、表4所示,各组大鼠膝关节软骨组织中自噬和PINK1/Parkin通路相关蛋白表达水平差异均有统计学意义(P<0.05)。与对照组比较,模型组大鼠膝关节软骨组织中Beclin1、LC3Ⅱ/LC3Ⅰ、PINK1、Parkin蛋白表达水平升高(q均>5.012,P<0.05);与模型组比较,低、高剂量苍术素组大鼠膝关节软骨组织中Beclin1、LC3Ⅱ/LC3Ⅰ、PINK1、Parkin蛋白表达水平进一步升高(q均>13.364,P<0.05);与高剂量苍术素组比较,高剂量苍术素+3-MA组大鼠膝关节软骨组织中Beclin1、LC3Ⅱ/LC3Ⅰ、PINK1、Parkin蛋白表达水平降低(q均>17.819,P<0.05)。

图6 各组大鼠膝关节软骨组织中Beclin1、LC3、PINK1、Parkin蛋白表达(Western Blot)

表4 各组大鼠膝关节软骨组织中Beclin1、LC3Ⅱ/LC3Ⅰ、PINK1、Parkin蛋白表达水平比较
3 讨 论
中医药治疗KOA可减轻膝关节疼痛、改善膝关节功能且不良反应少,为KOA患者提供了潜在益处,并已被接受作为KOA的补充疗法[16]。苍术素作为一种中药单体,已被证明具有抗炎、抗氧化应激等多种作用[17]。另有研究表明,苍术素可能是二妙散不同极性溶剂提取物保护佐剂性关节炎大鼠的主要活性成分[18];在小鼠模型中,苍术素抑制骨髓来源的树突状细胞成熟并改善胶原诱导的关节炎[19];苍术素在IL-1β诱导的人KOA软骨细胞中发挥抗炎活性[8]。然而,苍术素对KOA的保护机制尚不完全清楚,有待更深入探究。
KOA是炎症、氧化应激、细胞外基质降解等多因素导致的膝关节软骨退变,其中IL-1β、TNF-α是机体细胞产生的致炎细胞因子,在KOA发生发展中具有重要的调节作用,而COMP是软骨中非胶原蛋白的主要成分,常作为关节软骨退变的生物标记物[20,21]。本研究结果显示,KOA模型大鼠血清中TNF-α、IL-1β、COMP水平升高,且膝关节软骨存在明显的病理损伤,同时Mankin’s评分升高,表明本研究构建的模型大鼠体内存在炎症,同时膝关节软骨发生退变,这与KOA的病理特征相吻合。而苍术素治疗可降低KOA大鼠血清中TNF-α、IL-1β、COMP水平和Mankin’s评分,提示苍术素可减轻KOA大鼠膝关节软骨退变,并抑制体内炎症。
此外,软骨细胞自噬不足和过度凋亡被认为是KOA的重要病理机制,且二者之间的平衡在软骨退化中起关键作用[22]。据报道,增强软骨细胞自噬并抑制其凋亡可改善KOA[23],而抑制软骨细胞自噬则加剧KOA[24]。软骨细胞自噬和凋亡均与线粒体功能障碍密切相关,线粒体功能障碍时线粒体会持续生成大量的ROS,加剧软骨细胞凋亡,同时为了维持细胞内环境稳定而通过选择性自噬来降解功能失调或过剩的线粒体,从而维持细胞的正常生命活动,即线粒体自噬[9,25]。本研究中,KOA模型大鼠膝关节软骨组织中ROS水平以及细胞凋亡率、线粒体凋亡通路关键蛋白cleaved Caspase-3阳性细胞比例均升高,同时自噬标志物LC3阳性细胞比例以及Beclin1、LC3Ⅱ/LC3Ⅰ蛋白表达水平亦升高,表明KOA发生时线粒体受损,促进膝关节软骨细胞凋亡,同时自噬水平升高,这与Jin等[10]和Hu等[25]研究中KOA模型小鼠或大鼠软骨细胞凋亡和自噬水平均升高相一致,推测可能的机制是:KOA发生后软骨细胞通过线粒体自噬以维持线粒体数量和质量与细胞内环境稳定性之间的平衡,但由于软骨细胞线粒体自噬水平不足,无法有效保护受损细胞,且在ROS等刺激下凋亡细胞持续增多,最终导致软骨细胞仍处于严重损伤状态。此外,有趣的是,Wang等[26]和Li等[24]研究表明KOA发生后软骨细胞自噬水平降低,这与本研究结果貌似矛盾,分析原因可能是KOA病因不同或疾病所处阶段不同等。进一步分析发现,苍术素可降低KOA大鼠膝关节软骨组织中ROS水平以及细胞凋亡率、cleaved Caspase-3阳性细胞比例,但进一步升高了LC3阳性细胞比例以及Beclin1、LC3Ⅱ/LC3Ⅰ蛋白表达水平。提示苍术素可缓解KOA大鼠膝关节软骨组织中线粒体功能障碍,减少软骨细胞凋亡,并增强软骨细胞自噬。Lv等[27]研究亦表明,槲皮素能够缓解KOA中软骨细胞凋亡,并促进软骨细胞自噬等。
PINK1/Parkin途径介导的线粒体自噬是哺乳动物系统中研究最广泛的途径,其中PINK1是一种蛋白激酶,通过感知残基状态来监测线粒体的完整性,而Parkin是一种泛素蛋白连接酶,它将泛素连接到故障线粒体上作为降解信号,两种酶协同促进受损线粒体的自噬清除(即线粒体自噬)[28]。上调软骨细胞中PINK1/Parkin依赖性线粒体自噬可对KOA发挥保护作用[29]。本研究结果显示,KOA模型大鼠膝关节软骨组织中PINK1、Parkin蛋白表达水平升高,且苍术素可进一步升高KOA大鼠中PINK1、Parkin蛋白表达水平,其与自噬标记物LC3、Beclin1、LC3Ⅱ/LC3Ⅰ的变化趋势相同。表明苍术素增强KOA大鼠膝关节软骨细胞线粒体自噬与激活PINK1/Parkin信号通路有关。此外,为进一步验证线粒体自噬在苍术素改善KOA膝关节软骨退变中的作用,本研究在苍术素干预基础上添加自噬抑制剂3-MA,结果显示,3-MA可抑制KOA大鼠膝关节软骨中PINK1/Parkin信号通路激活和线粒体自噬,同时减弱苍术素对膝关节软骨退变、体内炎症、线粒体功能障碍和软骨细胞凋亡的改善作用,这进一步证实了苍术素减轻KOA与激活PINK1/Parkin信号通路并增强膝关节软骨细胞线粒体自噬有关,这与既往研究中[10,23-27]增强线粒体自噬缓解KOA具有一致性。
综上所述,苍术素可能通过激活PINK1/Parkin信号通路增强KOA大鼠膝关节软骨线粒体自噬,并减少软骨细胞凋亡,从而改善膝关节软骨退变。本研究为KOA的治疗提供了新思路和实验基础。但本研究仅通过大鼠KOA模型进行了初步验证,后续有待通过体外细胞实验进一步完善与补充。
