ATP敏感性钾通道亚基突变对血管生理特性的影响*
2023-11-22宋涛黄燕
宋 涛 黄 燕
Cantu综合征(MIM 239850)是一种新型ATP敏感性钾离子通道病[1,2],病变累及全身多个系统和器官[3];患者主要表现为多毛征、面容粗糙、骨骼异常、精神智力发育迟缓、心血管缺陷等,约80%的患者合并有心血管缺陷,包括心脏增大、血管扩张、血压降低、动脉导管未闭、心律失常、肺动脉高压[4]。Cantu综合征临床危害大,严重影响患者生活质量:24%的患者有肺动脉高压,新生患儿因肺动脉高压需要长期呼吸机辅助呼吸[5],18%的患者合并有心律失常,14%的患者有心衰病史[4],这些心血管异常甚至在新生婴儿期即可发生,但目前尚无有效治疗方法,且Cantu综合征患者心血管异常的病理机制亦不清楚[4,5]。
目前发现的Cantu综合征患者均存在编码KATP通道亚单位的基因突变[6-10]即ABCC9或KCNJ8突变,已检测出来的突变位点至少有30个[4],重组细胞实验表明这些突变均为功能获得性突变[6]。本课题组前期制备了带有Cantu综合征患者突变基因(Kir6.1[V65M])的小鼠,本研究主要探讨该突变对小鼠血压、血管张力、平滑肌细胞钙电流等动脉血管生理特性的影响,以期为Cantu综合征的发病机制及临床治疗提供理论依据。
1 材料与方法
1.1 实验动物和分组
将8-10周龄Kir6.1wt/VM(V65M+/-)进行相互交配,繁殖得同窝野生型小鼠Kir6.1wt/wt(V65M+/-)、杂合子Kir6.1wt/VM(V65M+/-)、纯合子Kir6.1VM/VM。由于纯合子小鼠出生后三周左右均死亡,且临床上Cantu患者均为杂合子突变,故本实验纳入8-10周龄同窝野生型小鼠Kir6.1wt/wt(野生组,n=35)和杂合子Kir6.1wt/VM(突变组,n=52)作为实验对象,雌雄不限。小鼠饲养于SPF 级动物房,自由进食进水,饲料经钴 60 照射灭菌,水高压处理,动物房内温度恒定于22-24℃,湿度为 50-60%,灯光控制12h明暗交替。本实验经武汉大学人民医院伦理委员会批准,符合《实验动物饲养管理和使用指南》。
1.2 主要仪器和设备
压力传感器(Model SPR-671,澳大利亚),PowerLab数据采集系统(AD Instruments,澳大利亚),LabChart 7 数据分析软件(AD Instruments,澳大利亚),倒置显微镜(Olympus,日本),张力传感器(Panlab,西班牙),成都泰盟生物电子仪器公司生产的新型420生物机能试验操作系统,膜片钳HEKA系统(HEKA,德国)。
1.3 主要试剂及药品
1.5%异氟烷购自深圳瑞沃德科技有限公司(批号:R510-22-10),去甲肾上腺素(批号:U1468501),吡那地尔(批号:TMLT12478),NaCl(批号:10019308),KCl(批号:10016308),MgSO4-7H2O (批号:10013018),KH2PO4(批号:100176008),NaHCO3(批号:10018960),EDTA(批号:53219860),葡萄糖(批号:FBP350101)等试剂均购自国药集团化学试剂有限公司。Krebs-Ringer溶液(mmol/L):NaCl 120.00,KCl 5.90,CaCl22.50,MgSO41.20,NaH2PO41.20,NaHCO315.50,葡萄糖 11.50 (pH 7.40)。平滑肌细胞分离液(mmol/L):NaCl 145.00,KCl 5.90,HEPES 10.00,葡萄糖 10.00,CaCl20.05,MgCl21.00。平滑肌细胞分离液1:20ml平滑肌细胞分离液+0.1%牛血清白蛋白;平滑肌细胞分离液2:2ml平滑肌细胞分离液1+3mg木瓜蛋白酶+2mg二硫赤藓糖醇;平滑肌细胞分离液3:2ml平滑肌细胞分离液1+3mg胶原酶+2mg胰蛋白酶抑制剂+1mg弹性蛋白酶。记录钙电流的细胞外液(mmol/L):NaCl 137.00,CsCl 5.40,CaCl21.80,MgCl20.50,葡萄糖 10.00,HEPES 5.00,NaHCO33.00,NaH2PO40.16 (pH 7.40);记录钙电流的细胞内液(mmol/L):CsCl 130.00,TEA-Cl 20.00,MgCl21.00,CaCl20.50,K2ATP 3.00,EGTA 5.00,HEPES 10.00 (pH 7.40)。肾素、血管紧张素II、醛固酮ELISA试剂盒(批号分别为:DY4277,LS-F523,KA1883)。
1.4 血压测量
小鼠吸入1.5% 异氟烷麻醉,并置于加热垫上保持身体温度。颈中线处切开2-3mm皮肤,分离胸腺和肌肉,露出右侧颈动脉,小心地将压力传感器插入右颈动脉并移至升主动脉。使用PowerLab数据采集系统记录收缩压、舒张压和心率,并使用LabChart 7对数据进行分析。
1.5 动脉环制备及血管张力测量
异氟烷麻醉小鼠安乐死后,摘取其降主动脉,分离、清除附着结缔组织,制成3mm长的动脉环,将动脉环穿过两个边长为2cm的等边三角形不锈钢小钩后,置于盛有20ml Krebs-Ringer液的恒温(37℃,95%O2+5%CO2平衡)离体血管灌注浴槽内,下端固定于槽底部,上端通过张力换能器与Power lab八道生理记录仪相连,记录动脉环张力变化。稳定30min后,采用KCl刺激动脉环有反应后开始实验。用60mmol/L KCl收缩血管,达到平台期后,反复洗去KCl,再次平衡30min,加入10-6mol/L去甲肾上腺素达最大收缩后,分别观察加入不同浓度吡那地尔(0.1μmol/L,0.3μmol/L)时血管的收缩情况,并描记曲线收缩幅度,计算不同浓度吡那地尔刺激下的血管张力与10-6mol/L去甲肾上腺素刺激下血管的张力百分比。
1.6 平滑肌细胞分离及L型钙电流记录
异氟烷麻醉小鼠安乐死后,摘取其降主动脉,在冰浴的生理盐水上分离、清除附着结缔组织,剪成1-2mm血管环;将血管环转移到2ml的平滑肌细胞分离液1中,室温孵育10min;轻轻吸出平滑肌细胞分离液1,加入2ml常温平滑肌细胞分离液2,在37℃水浴25min,每10min轻轻颠倒数次;再转移到平滑肌细胞分离液3中,37℃水浴5min;室温下静置2-3min后冰上静置3-5min。缓慢轻轻吸走平滑肌细胞分离液3,再用0.5ml平滑肌细胞分离液1轻轻吹打数次,置于冰上,吸取75μl分离的细胞悬液置于小的载玻片上,冰块上保存至少1h进行膜片钳记录。
将分离的平滑肌细胞转移至灌流槽,用全细胞膜片钳记录单个平滑肌细胞的钙电流,电极电阻2-3MΩ,记录钙电流程序:电位钳制在-70mV,先给予-70mV到-45mV的梯度电压,命令电压从-45mV开始,65mV终止,阶跃10mV,持续300ms的系列脉冲,采用Clamp及pClamp软件完成数据的采集和分析。
1.7 小鼠血清肾素、血管紧张素II、醛固酮水平检测
采用眼眶内眦静脉采血,将采集的血液收集在EP管中,室温静置2h,4℃下3 500rpm×10min离心,收集上层血清,-80℃冻存。样本采集完成后集中检测,检测前样本室温解冻,采用ELISA试剂盒检测血清肾素、血管紧张素II、醛固酮水平,以此来反映RAAS系统活性。
1.8 统计学处理
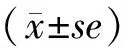
2 结 果
2.1 Kir6.1[V65M]突变对小鼠血压的影响
与野生组小鼠比较,突变小鼠收缩压、舒张压降低(P<0.01),两组小鼠心率无统计学差异(P>0.05)。见表1。

表1 两组小鼠血压、心率比较
2.2 Kir6.1[V65M]突变对小鼠血管张力的影响
与野生组小鼠比较,Kir6.1[V65M]突变组小鼠离体动脉环在60mmol/L KCl和10-6mol/L去甲肾上腺素刺激下的张力均大于野生组(P<0.05或P<0.01); 0.1μmol/L和0.3μmol/L吡那地尔使突变小鼠血管张力下降幅度大于野生小鼠(P<0.01)。见表2。

表2 两组小鼠动脉环张力比较
2.3 Kir6.1[V65M]突变对小鼠平滑肌细胞钙电流的影响
在预设的刺激方案刺激下,可记录到一缓慢激活的内向电流,该电流在-45mV左右被激活,+25mV左右达电流最大值。与野生组小鼠相比,突变组小鼠钙电流峰值明显增加(-4.20±0.73pA/pF,n=10 vs-2.51±0.39pA/pF,n=10;t=2.214,P<0.05)。见图1。

注:A,野生小鼠平滑肌细胞L型钙电流原始记录曲线图;B,突变小鼠平滑肌细胞L型钙电流原始记录曲线图;C,野生组小鼠和突变组小鼠血管平滑肌细胞L型钙电流I-U曲线图。*P<0.05
2.4 Kir6.1[V65M]小鼠RAAS系统被激活
与野生小鼠相比,Kir6.1[V65M]突变组小鼠血清中肾素和血管紧张素II水平升高(P<0.05)。两组间血清醛固酮水平无统计学差异(P>0.05)。见表3。

表3 两组小鼠血清肾素、血管紧张素、醛固酮水平比较
3 讨 论
KATP通道广泛分布在心肌细胞、平滑肌细胞以及内皮细胞[11]。在正常生理状态下,KATP通道通常处于关闭状态,对细胞兴奋性贡献不大。但在严重的代谢压力状态下,如缺血缺氧,KATP通道迅速开放,在肌细胞,KATP通道开放使得动作电位时程缩短,减少钙内流,抑制肌细胞收缩,从而减少能量消耗来保护细胞。但KATP通道开放也会带来弊端,若KATP通道过度开放会引起心肌收缩障碍,因此KATP通道开放是一把双刃剑[12]。KATP通道基因突变主要引起心血管系统的临床表现,KCNJ8功能获得性突变可引起J波综合征、心房颤动、Cantu综合征;KCNJ11功能获得性突变可引起高血压、心衰、室性心律失常;ABCC8功能缺失性突变肺动脉高压、心房颤动;ABCC9功能获得性突变主要引起Cantu综合征、早复极综合征;ABCC9功能缺失性突变引起扩张性心肌病、心房颤动[11]。
目前已明确编码KATP通道Kir6.1和SUR2亚基的基因KCNJ8和ABCC9的常染色体显性功能获得性突变为Cantu综合征的遗传基础[12]。除了常见多毛和面部粗糙外,Cantu综合征患者还具有一系列心血管临床表现,包括明显的心脏肥大、血管扩张和扭曲、低血压和肺动脉高压[4]。KATP通道功能获得性突变引起的直接结果是,KATP通道对ATP敏感性降低,KATP通道过度激活,钾离子流增加,细胞膜超极化,钙通道被抑制,使得血管平滑肌松弛,血管扩张,血压降低[13],同时可导致动脉导管未闭持续存在;血管扩张可增加毛囊的氧气、血液和营养物质供应,促进毛囊生长,导致多毛症状[14]。本实验在KATP功能获得性突变小鼠观察到明显的血管扩张及血压降低,因而,KATP开放剂在临床上也可作为治疗高血压的药物之一。同时,在血管动脉环实验记录到突变小鼠在高浓度氯化钾及去甲肾上腺素刺激下有更高的收缩反应性,这些结果表明KATP通道功能获得性突变小鼠钙通道活性增强或α肾上腺素能受体表达上调,高钾溶液可诱导细胞膜电位去极化,使细胞膜电压依赖性钙通道激活,引起胞外钙内流从而诱发血管收缩;去甲肾上腺素缩血管作用与促进细胞内钙释放和诱导细胞外钙内流有关。这一猜想被血管平滑肌细胞L型钙通道电流记录进一步印证,在急性分离的突变小鼠血管平滑肌细胞记录到显著增加的L型钙通道电流。
KATP通道功能获得性突变导致血管平滑肌舒张,血管扩张血压降低,外周血管阻力降低。但本课题组前期在Kir6.1[V65M]突变小鼠观察到心肌肥厚以及心输出量增加[15],本实验在突变小鼠分离的动脉环记录到对高浓度氯化钾及去甲肾上腺素反应性增强。早期Ruzicka等[16]的研究表明RAAS系统激活参与了KATP通道开放剂米诺地尔诱导的心脏重构;Levin 等[17]观察到Kir6.1转基因小鼠交感神经活性增强;本研究在突变小鼠血清中检测到肾素、血管紧张素II水平升高,这表明突变小鼠RAAS系统被激活,因而Cantu综合征突变小鼠模型研究表明,KATP通道功能获得性突变引起的原始血管扩张、血压降低刺激颈动脉窦压力感受器,反射性引起交感神经兴奋,同时血压降低导致肾血流量减少促进肾小球旁细胞分泌肾素,RAAS系统被激活,血管紧张素II作用于血管平滑肌,使钙通道活性增强,同时也作用于心肌细胞,出现心肌肥厚、钙离子通道活性增强、心肌收缩力增强,从而心输出量增加,以此来对抗KATP通道突变引起的原始血管扩张、血压降低;从某种意义上来说这是机体的代偿调节机制。
综上所述,KATP通道功能获得性突变使得血管扩张、血压降低,刺激颈动脉窦压力感受器,反射性引起交感神经兴奋,RAAS系统激活,血管平滑肌细胞钙电流增加,使得动脉血管对收缩剂及舒张剂的反应性增加,此为机体的代偿调节机制。
