《Ⅰ型神经纤维瘤病多学科诊治指南(2023 版)》解读
2023-11-22杨满红王平夏迪张清
杨满红,王平,夏迪,张清
I型神经纤维瘤病(neurofibromatosis type Ⅰ,NF1)是由NF1基因突变引发的遗传性疾病,临床表现复杂,以皮肤特征性咖啡牛奶斑(CALMs)和神经纤维瘤为主要特征,可伴多系统损害且有恶变风险。除典型皮损和神经纤维瘤表现之外,可并发多种良、恶性肿瘤及骨骼、心血管、眼科、神经系统病变等,近年来不乏NF1合并性早熟、大脑萎缩、阴蒂肥大及肠道疾病等个案报道[1-4],进一步突显了NF1疾病的复杂性和临床多学科诊疗的挑战性。为促进NF1多学科同质化的诊疗水平,继我国NF1多中心治疗协作组撰写的2021版Ⅰ型神经纤维瘤病临床诊疗专家共识(以下简称2021版共识)后[5],我国罕见病联盟NF1多学科诊疗协作组又撰写发布了《Ⅰ型神经纤维瘤病多学科诊治指南(2023版)》(以下简称2023版指南)[6],相比2021版共识其对于基因筛查的推荐、疾病多学科诊疗和全周期性监测的论述更为系统,临床适用性更强,对于促进多学科同质化诊疗水平意义重大。本文就其亮点部分及NF1相关骨科方面内容展开解读,以期推动该指南的推广应用。
1 基因检测推荐更为明确
目前NF1诊断标准仍根据1987年美国卫生研究院(NIH)所发表共识制定[7],但由于儿童患者临床症状缺乏典型性,其诊断标准针对儿童患者敏感性较低,因此2021年国际神经纤维瘤病诊断标准共识组[8]就其部分提出修正意见,着重加入了基因诊断标准[9]。2023版指南在基因筛查上做出明确推荐,建议对7岁以下儿童以及症状不典型的患者行基因检测进一步明确诊断[10]。
基因检测不仅能进一步明确诊断,也能为疾病日后长期管理提供指导。2023版指南提到,p.Met1149(+)者表型较轻;p.Arg1276和p.Lys1423变异者容易出现心血管问题;而NF1基因缺失者可能有更大的肿瘤负荷,因此建议患者尽可能进行相应的基因学筛查,重视其在疾病管理方面的指导意义。
在基因检测类型上,2023版指南建议首选全外显子组测序(WES)。WES在NF1基因识别和诊断上优势明显,但是相较全基因组测序(WGS),WES检测在结构变异、深度内含子区等方面有着不同程度的局限性[11]。而WGS对患者基因组中的所有DNA序列进行检测,既涵盖全部基因的外显子序列,也覆盖了内含子序列和基因间序列。因此在条件允许情况下可行WGS。其次指南建议若能取得局部病变组织,优先对其进行基因检测。若结果阴性但仍无法排除NF1,可分析含NF1基因的拷贝数变异或RNA测序,并结合基因型—表型关联进行相关遗传学分析。
2 疾病评估和诊疗方案更为系统
2.1 NF1相关皮肤表现及诊疗 2023版指南提出,约1/2患儿在出生后不久可出现多发性贫血痣,约1/3儿童可发生头面部多发性黄色肉芽肿[12-13],其对NF1的早期诊断有一定意义。对于CALMs及腋窝部雀斑(Crowe征)等皮损治疗,2个版本指南意见一致,以对症治疗为主。表现轻微者一般不必处理,对于此类患者而言,心理疏导至关重要。皮肤型神经纤维瘤(cNF)表现为皮肤上橡胶状、外生软性丘疹和肿物[14],外科治疗是目前主要的治疗方式,另外患者还可选择CO2激光消融、激光烧灼、电干燥术等,指南并未就其做出具体建议,应根据医生业务水平和患者实际情况共同决策,但如何减少术后相关并发症,仍然是临床研究的重点,其次有望针对cNF的药物研究取得突破性进展。
2.2 结节型、丛状神经纤维瘤(pNF)的评估和外科治疗
2.2.1 分类及评估:为强化对NF1的认知和疾病管理,2023版指南论述了不同的分类方法。根据分布特征差异可将神经纤维瘤分为cNF、结节型神经纤维瘤和pNF,相较cNF,后两者更易于转化为恶性神经鞘瘤(MPNST)。根据MR特征,可分为浅表型、移位型、侵袭型等3种类型[15],相对比浅表型,移位型和侵袭型临床症状更为明显,易于造成邻近组织的压迫损害;根据病理学分类,可分为局限/结节型、弥漫型和pNF等3种类型[16-17],相较而言,pNF在3种类型中转化为MPNST的风险最高,其次还可根据位置进行分类。
为了便于区分恶性潜能不确定的神经纤维瘤,2023版指南提到了具有不确定生物潜力的非典型神经纤维瘤(ANNUBP)的概念,满足以下4项中至少2项的施万细胞瘤:细胞学异型性、神经纤维瘤结构缺失、细胞增多、有丝分裂指数>1/50HPF且<3/10 HPF。ANNUBP复发性低,几乎不发生转移[18],因此要与低度MPNST严格区分以避免过度医疗。在排除禁忌证及严重手术并发症的情况下,可考虑手术治疗ANNUBP,但指南不推荐术中采用广泛的阴性切缘,其次要密切监测其发展倾向。
2.2.2 神经纤维瘤的手术治疗:针对临床症状明显、有恶变证据的病灶,以及直径>6 cm的神经纤维瘤建议进行手术治疗[19],但手术时期一直充满争议,部分学者建议早期手术以防止其发展或恶化,但也有学者认为早期手术会增加后期重复手术几率。2023版指南建议对有手术指征的患者,综合评估病情后限期手术。当然抵触手术者可选择其靶向药物治疗。
手术方式根据切除范围可分全切除/近全切除[20]、次全切除以及部分切除。对于体积较大或浸润性瘤体,理想状态下建议全切、近全切,但由于其体积较大,往往多侵犯毗邻组织和重要神经,且血供丰富导致手术难度大,几乎很难完成全切或近全切,因此在手术策略的制定上应慎之又慎,尽可能在缓解临床症状的基础上保留神经功能,依靠多学科协作,最大程度上保证手术安全性。
术前要参考影像学资料充分评估纤维瘤性质以及其他系统受累情况,对MR表现为“流空征”或血供丰富的纤维瘤,指南认为术前行血管造影和/或经皮血管栓塞术或助于减少术中出血及其并发症的发生[21],另外术前神经传导检测和肌电图检查也利于手术策略制定。
术中建议持续电刺激以更好地识别和保留功能性神经纤维,显微技术下荧光素引导结合神经监测能进一步提升安全性和减少术后神经功能缺损的发生[22]。由于神经纤维瘤血管丰富,术中出血一直是个相对棘手的问题,对于四肢末端的瘤体,止血带辅助是常规操作,而术中血管结扎及多层止血缝合对手术医师提出更高要求,另外指南也提出切缘保留粗尼龙缝合线及运用线性切割缝合器系统等技术,有助于临时控制术中出血。
2.2.3 MPNST的手术治疗:2023版指南根据不同分期和神经血管受累情况做出系统性推荐(图1),Ⅰ、Ⅱ期肿瘤如果没有神经血管受累情况,指南推荐局部根治性切除,如果存在主要血管或者神经损伤则考虑截肢或者局部切除联合血管置换、神经外膜切除及放射性治疗等方法,而Ⅲ期肿瘤患者主要采取全身综合性治疗,发生转移则考虑放化疗及靶向药物治疗。
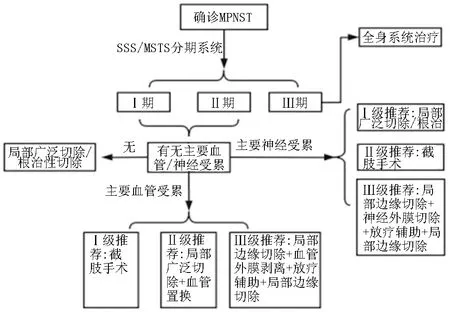
图1 MPNST手术治疗方案流程图
2.2.4 强调术后密切监测:对于pNF这种术后易于复发的肿瘤,筛选术后复发高危因素和周期性病情监测极为重要。目前研究报道pNF术后复发率高达25%~66%,影响其复发及进展的因素包括手术切除范围、患者年龄、肿瘤位置和生长类型[23-24]。研究表明,手术切除范围越小、患者干预年龄越早术后更容易复发或进展,这也是部分学者不认可早期手术的主要原因。其次,pNF分布位置的不同其术后复发率也存在差异,总体头面部肿瘤较躯干部及四肢部位有着更高的复发及进展概率,此外有报道认为移位型pNF较浅表型或侵袭型更容易复发。值得注意的是,有研究表明pNF术后复发是疾病自然过程[25]。目前很多关于肿瘤复发因素的研究结论仍然有待进一步检验,但建立系统地术后病情监测方案势在必行,未来可就不同的分型或基因表型尝试建立不同的监测方案,以便尽早掌握发展倾向。
3 pNF骨科常见并发症及处理
3.1 脊柱侧凸 NF1伴脊柱畸形的发病机制尚不清楚,目前有骨缺损、中胚层发育不良、肿瘤侵蚀、骨密度降低等假说解释其原因[26]。脊柱侧凸是脊柱科常见疾病,但NF1合并脊柱侧凸的诊疗对于脊柱外科医师而言仍充满挑战。目前将NF1合并脊柱侧凸分为两种类型:一种类似于特发性脊柱侧凸,其椎体正常;另一种是伴椎体发育不良,又称为营养不良性脊柱侧凸,好发于胸腰段且发展较快。目前X线仍然是脊柱侧凸的首选检查方法[27]。特发性脊柱侧凸的治疗一般采取分层阶梯化治疗,Cobb角介入10°~25°之间者建议运动疗法,>25°~ 40°之间可使用支具联合运动治疗,Cobb角超过40°建议手术治疗;而对于营养不良性脊柱侧凸,一般认为Cobb角<20°时应密切观察进展情况,>20°通常需要手术治疗,另外由于此类患者容易引起脊髓损伤,在具备适应证的情况下应积极手术,术式分椎体融合及非融合术。
一般认为,早期椎体融合是干预NF1合并脊柱畸形最有效的手段,Cobb角20°~40°之间者可行单纯后路融合术。Cobb角>40°且后凸多需要前后路联合融入术,但对于儿童患者来讲,椎体融合可能影响其脊柱和呼吸系统发育。因此一些生长棒技术在NF1患者中得到应用。总体而言,NF1合并脊柱侧凸患者往往合并其他系统问题,手术治疗难度大,指南建议术前行多系统、多学科评估,另外应由经验丰富的手术团队治疗并长期随访。
3.2 颅骨发育缺陷 颅骨发育缺陷导致头面部畸形、视力受损等症状,蝶骨翼发育障碍是NF1较为特异性的表现[28]。外科治疗目的主要在于维持脑脊液、血流动力学平衡,其次在于保护大脑功能、改善外观。颅骨成形术是针对颅骨发育缺陷重要的手术方法,但在手术时机、材料的选择及优化手术操作上仍存难点,2021版共识强调了其手术操作的复杂性,主张由经验丰富的多学科团队治疗。2023版指南提出对颅骨缺陷导致脑膜脑膨出者,应早期手术干预以恢复大脑正常结构。
3.3 长骨发育不良 长骨发育不良多体现在胫骨上,往往表现为胫腓骨进行性向前外侧弯曲、病理性骨折及假关节。2021版共识指出长骨发育不良患者骨折风险高,强调补充维生素D。对于胫骨假关节,虽然手术是主要的治疗方式,但2023版指南指出其手术难度大,如何提高远期疗效、降低手术次数依然是临床面临的难题。
3.4 胸壁异常 2023版指南提出,NF1患者胸壁异常主要包括胸壁不对称、漏斗胸及鸡胸,此类患者是否需要外科干预主要取决于患者心肺功能情况,2021版共识并未就其做出推荐。
3.5 骨质疏松症 针对NF1伴骨质疏松患者,指南建议增加钙和维生素D摄入的同时保持适度运动,其次指南建议NF1患者每年进行全身骨骼系统评估,降低骨折风险。若出现骨折,可根据具体情况接受复位固定,但是再骨折的风险高。
4 病情监测机制的建立
根据不同肿瘤的流行病学特征、好发年龄阶段等建立病情监测机制极为重要,如MPNST好发于50岁以下的成年患者,幼年型粒单细胞白血病(JMML)好发于14岁以下儿童等,要重视对其早期识别和监测。其次NF1患者易出现眼科及心血管疾病,患儿可出现认知障碍等,涉及众多临床科室,建立多学科诊疗模式和病情监测机制势在必行,2023版指南的亮点在于不仅在疾病的评估和治疗上更为系统,更在于其建立的多学科全周期病情监测机制(图2),能有效指导医患进行病程管理和监测。
5 总结及展望
NF1可累及全身不同系统,临床表现复杂,诊疗一直是临床的难点,因此建立国内多学科权威性指南对于提高疾病认识及提供同质化的临床诊疗水平至关重要。相较2021版共识,2023版指南对于基因检测、手术适应证及注意事项、多学科全周期病情监测的建议更为明确和系统,临床指导性更强,二者在诊断、多系统并发症评估及遗传咨询方面等意见一致。总体而言,NF1作为遗传性疑难病种,国内各科室临床医师应参考指南意见强化对疾病的认识和诊疗水平。
