L-酪氨酸清液发酵工艺研究
2023-11-22时唐恩赵思宇刘韪玮赵春光徐庆阳
时唐恩,赵思宇,刘韪玮,赵春光,徐庆阳*
(1.天津科技大学 生物工程学院,天津 300457;2.宁夏伊品生物科技股份有限公司,银川 750100)
L-酪氨酸在生产生活中应用广泛。L-酪氨酸与无机碘化物在甲状腺处生成甲状腺激素[1-3];L-酪氨酸在酪氨酸酶的催化作用下转化成多巴色素,多巴色素再经过一系列生化反应变成黑色素[4-6];去肾上腺素、肾上腺素、多巴胺都是以L-酪氨酸为前体物质生成的[7]。L-酪氨酸还作为食品和饲料添加剂被广泛应用[8-11]。
传统发酵法生产L-酪氨酸的过程中,容易造成发酵液黏稠浑浊、泡沫丰富、色素问题严重,从而导致发酵生产L-酪氨酸产率低,不利于后期L-酪氨酸的分离提取,所以有必要开发一种新型清液发酵来近似替代玉米浆、豆粕水解液发酵生产L-酪氨酸[12]。
在满足菌体生长繁殖的基本条件下,探究添加物质最佳用量,并根据菌株生产特性选取了天冬氨酸、谷氨酸、色氨酸等营养添加物质。其中天冬氨酸作为泛酸的合成前体物质之一,后者可在体内转变成CoA或ACP参与脂肪酸代谢反应;在一定范围内增加琥珀酸的添加量会提高谷氨酸产量[13];谷氨酸可提供一分子氨基,将对羟基苯丙酮酸转化为酪氨酸,自身转化为一分子α-酮戊二酸,参与柠檬酸循环;芳香族氨基酸的合成途径中[14],苯酸作为苯丙氨酸和酪氨酸的共同前体物质,添加苯丙氨酸促使反应向酪氨酸途径进行;色氨酸也属于芳香族氨基酸,分支酸作为芳香族氨基酸的生物合成系统中的中间体,添加色氨酸会反馈抑制色氨酸合成途径,从而加强酪氨酸的合成方向;鸟苷、腺苷、肌苷等核苷类物质能够参与机体内的能量代谢反应[15];生物素是多种羧化酶的辅酶,同时生物素参与控制细胞膜的合成[16-18]。
1 材料与方法
1.1 菌种
L-酪氨酸生产菌E.coliTR03:由天津科技大学代谢工程实验室保存。
1.2 培养基
1.2.1 种子培养基
葡萄糖 30 g/L,酵母粉 3 g/L,(NH4)SO44 g/L,KH2PO4·3H2O 3 g/L,MgSO4·7H2O 2 g/L,柠檬酸钠2 g/L,FeSO4·7H2O 15 mg/L,MnSO4·H2O 5 mg/L,VH1 mg/L,VB混合液0.5 mg/L,微量元素混合液1 mL/L,pH 7.0~7.2,115 ℃高压灭菌15 min。
1.2.2 清液发酵培养基
葡萄糖 30 g/L,酵母粉 2 g/L,(NH4)SO44 g/L,KH2PO4·3H2O 3 g/L,MgSO4·7H2O 2 g/L,柠檬酸钠2 g/L,天冬氨酸2 g/L,谷氨酸2.3 g/L,琥珀酸1.5 g/L,色氨酸1.5 g/L,苯丙氨酸1.5 g/L, FeSO4·7H2O 15 mg/L,MnSO4·H2O 5 mg/L,VB混合液0.5 mg/L,生物素2 mg/L,鸟苷0.3 g/L,腺苷0.3 g/L,肌苷0.4 g/L,微量元素混合液1 mL/L,pH 7.0~7.2,115 ℃高压灭菌15 min。
1.2.3 对照发酵培养基
葡萄糖 30 g/L,酵母粉 2 g/L,蛋白胨 5 g/L,豆粕水解液10 mL/L, 玉米浆4 mL/L,(NH4)SO44 g/L,KH2PO4·3H2O 3 g/L,MgSO4·7H2O 2 g/L,柠檬酸钠2 g/L,FeSO4·7H2O 15 mg/L,MnSO4·H2O 5 mg/L,VB混合液0.5 mg/L,微量元素混合液1 mL/L,pH 7.0~7.2,115 ℃高压灭菌15 min。
1.3 实验器材
仪器设备见表1。
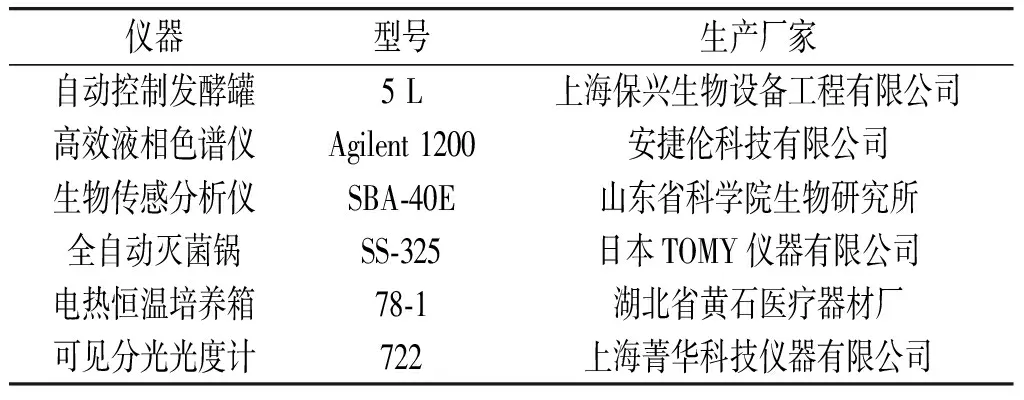
表1 仪器设备Table 1 Instruments and equipment
1.4 检测方法
1.4.1 残糖检测
取发酵液于1.5 mL EP管中,15 000 r/min离心2 min,将上清液用去离子水稀释10倍,取稀释后的上清液25 μL快速注入SBA-40E生物传感分析仪中检测。
1.4.2 OD600 nm检测
用1.5 mL EP管收集发酵液,将其稀释100倍后用722分光光度计进行检测,所得数值乘以100即为发酵液的OD600 nm数值。
1.4.3 L-酪氨酸的检测
将发酵液进行适当倍数的稀释以使L-酪氨酸晶体全部溶解,13 000 r/min离心2 min,再用去离子水将上清液稀释至一定倍数,经0.22 μm微孔过滤后采用高效液相色谱法[19]检测发酵液中的L-酪氨酸含量。采用 Kromasil C18色谱柱(250 mm×460 mm,5 μm),流动相为10%乙腈溶液,柱温设定为40 ℃,流速为1 mL/min,保留时间为10 min,检测波长为230 nm,进样量为20 μL。
1.4.4 糖酸转化率计算
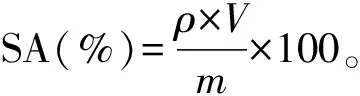
式中:ρ为L-酪氨酸质量浓度,g/L;V为发酵液总体积,L;m为总耗糖量,g。
1.5 单因素实验优化
通过摇瓶的方式,将自变量设置5组浓度梯度,进行单因素实验优化,单因素实验表见表2。
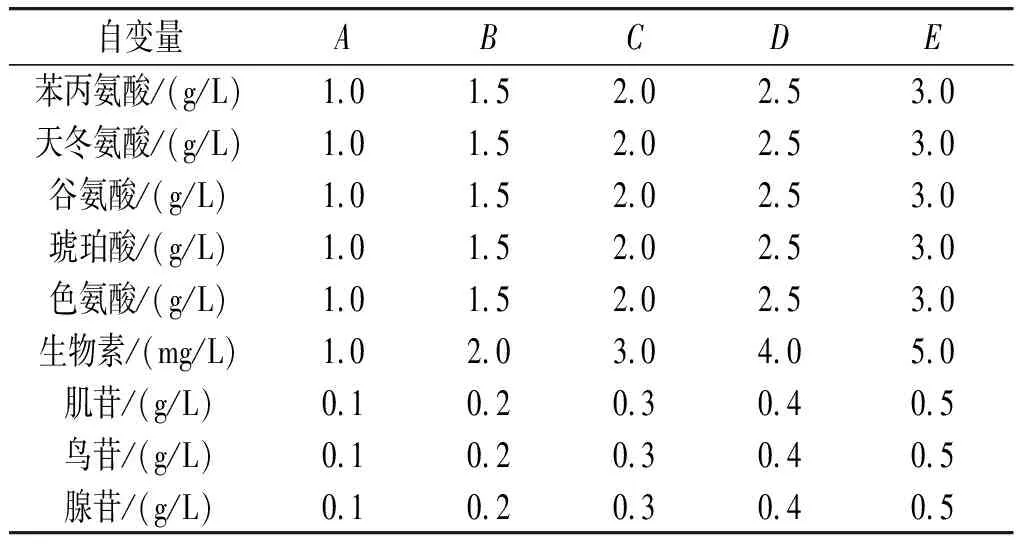
表2 单因素实验表Table 2 Single factor experiment table
1.6 正交实验优化
由于天冬氨酸、谷氨酸、苯丙氨酸和生物素对实验结果的影响较大,在单因素实验的基础上,将天冬氨酸、谷氨酸、苯丙氨酸和生物素通过设置四因素三水平的正交实验L9(34)方式使用摇瓶进行进一步优化,正交实验因素水平见表3。
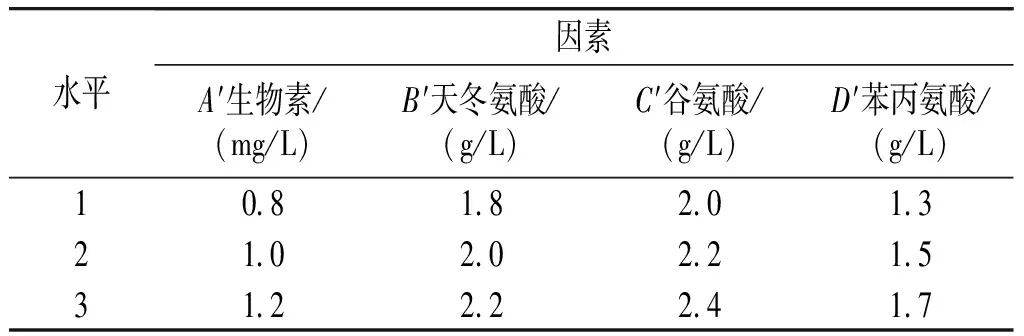
表3 正交实验因素水平表Table 3 Factors and levels of orthogonal experiment
1.7 5 L发酵罐验证
5 L发酵罐进一步验证清液培养基与传统培养基发酵过程中的各种参数(L-酪氨酸产量、OD600 nm、上清透光率),5 L发酵罐的控制条件:温度 37 ℃;pH 7.0;溶氧20%~30%;根据溶氧变化控制转速200~800 r/min;每隔2 h测定菌体OD600 nm和L-酪氨酸产量。
1.8 分离提取
分别将对照实验组传统发酵液与清液发酵液分离提取,首先用盐酸调节两种发酵液的pH至0.5,加入活性炭吸附除杂,然后利用50 nm陶瓷膜进行菌体过滤;过滤液冷却至10 ℃,加氨水调节pH至5.7,进行等电点结晶,离心或过滤收集L-酪氨酸湿晶体,80 ℃干燥即得L-酪氨酸晶体产品。
2 结果与讨论
2.1 单因素对结果的影响
2.1.1 单因素对L-酪氨酸产量的影响
在摇瓶中控制一种添加物含量变化,观察单一因素变化对L-酪氨酸产量的影响,见图1。
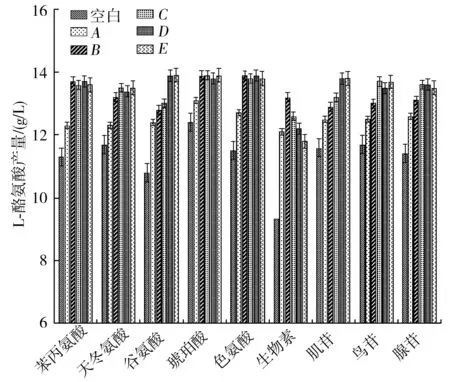
图1 摇瓶中不同添加物含量对L-酪氨酸产量的影响Fig.1 Effect of different additives' content in shaker on the yield of L-tyrosine
由图1可知,生物素添加量从1.0 mg/L增加到2.0 mg/L时,L-酪氨酸的产量逐步增加,在2.0 mg/L附近L-酪氨酸产量达到最大值。从2.0 mg/L继续增加生物素添加量时,L-酪氨酸的产量与生物素的添加量成反比关系,此时L-酪氨酸的合成受到抑制,由此可以确定生物素的最佳添加量为2.0 mg/L。控制苯丙氨酸的含量变化时,苯丙氨酸从1.0 g/L增加到1.5 g/L时,L-酪氨酸的产量逐步提高,在添加量为1.5 g/L时L-酪氨酸的产量达到最大值,并且在继续加大苯丙氨酸添加量的过程中,L-酪氨酸的产量逐步趋于稳定,过量的苯丙氨酸并不会增加产物的生成,从节约资源和产物生成量的角度,确定苯丙氨酸的最佳添加量为1.5 g/L。根据相同的分析方法可以得出,天冬氨酸的最佳添加量为2.0 g/L左右时,L-酪氨酸的产量达到最高峰;谷氨酸的最佳添加量为2.5 g/L左右时,L-酪氨酸的产量达到最高峰;琥珀酸和色氨酸的最佳添加量都为1.5 g/L左右时,L-酪氨酸的产量达到最高峰;肌苷的最佳添加量为0.4 g/L左右时,L-酪氨酸的产量达到最高峰;鸟苷和腺苷的最佳添加量为0.3 g/L左右时,L-酪氨酸的产量达到最高峰。
2.1.2 单因素对清液发酵生物量的影响
控制一种添加物含量变化,观察单一因素变化对清液发酵生物量的影响,见图2。

图2 不同添加物含量对生物量的影响Fig.2 Effect of different additives' content on biomass
由图2可知,在空白对照实验组中,天冬氨酸、谷氨酸、苯丙氨酸、生物素对大肠杆菌生物量的影响较大。在分别不添加天冬氨酸、谷氨酸、苯丙氨酸、生物素时,大肠杆菌的OD600 nm值比不添加其他物质的低,表明这4种物质对E.coliTR03菌种生长的影响比较大。苯丙氨酸添加量从1.0~1.5 g/L时,菌体生物量逐步增加,在添加量为1.5 g/L时OD600 nm达到最大值,之后随着苯丙氨酸添加量的逐渐增加,菌体生物量逐渐稳定,说明当添加物含量增加到一定值时,该物质不再是限制E.coliTR03菌种产酸的主要因素。由此可以确定苯丙氨酸添加量为1.5 g/L时对菌体的生长最有利,为最佳添加量。根据相同的分析方法,可以确定天冬氨酸 2.0 g/L、谷氨酸2.2 g/L、琥珀酸1.6 g/L、色氨酸1.5 g/L、鸟苷0.3 g/L、腺苷0.3 g/L、肌苷 0.4 g/L最有利于E.coliTR03菌种的生长,使其达到最大的OD600 nm值。生物素添加量为2.0 mg/L时OD600 nm达到最大值,之后随着添加量的不断增大,大肠杆菌的OD600 nm值急剧升高,当添加量为5.0 mg/L时,大肠杆菌的OD600 nm值超过100。结合图1可知,大肠杆菌的OD600 nm值升高到一定范围后,L-酪氨酸的产量反而下降。生物素通过控制细胞膜的生成量而影响大肠杆菌的OD600 nm值。
2.2 正交实验优化培养基
图1分析了单一因素对L-酪氨酸产量的影响,在单因素实验的基础上,挑选了生物素、天冬氨酸、谷氨酸、苯丙氨酸4种对L-酪氨酸产量影响较大的物质,通过正交实验的方法以L-酪氨酸产量作为参考指标,根据表3设计正交实验,通过摇瓶的方式进一步优化培养基配比,见表4。
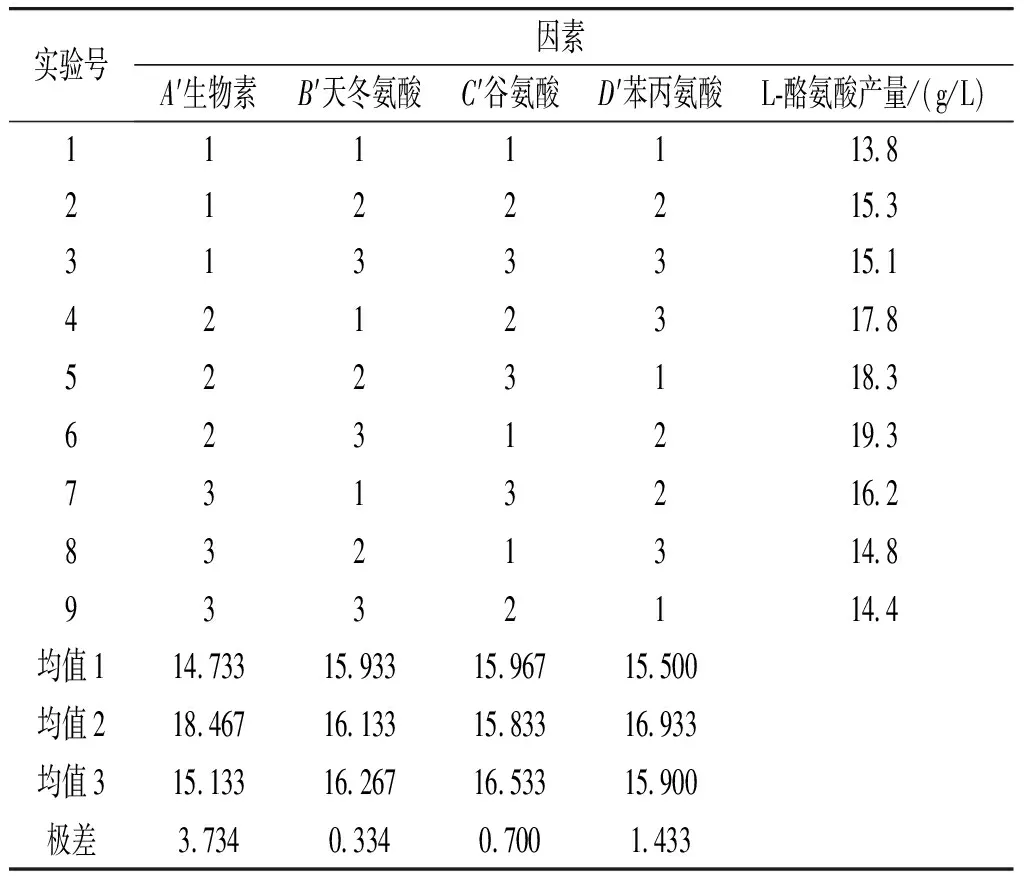
表4 L-酪氨酸产量正交实验结果Table 4 Results of L-tyrosine yield orthogonal experiment
2.3 5 L发酵罐进一步验证结果
2.3.1 清液发酵与传统发酵对L-酪氨酸产量的影响
发酵过程中,清液发酵与传统发酵L-酪氨酸生产菌E.coliTR03生产L-酪氨酸的能力对比见图3。
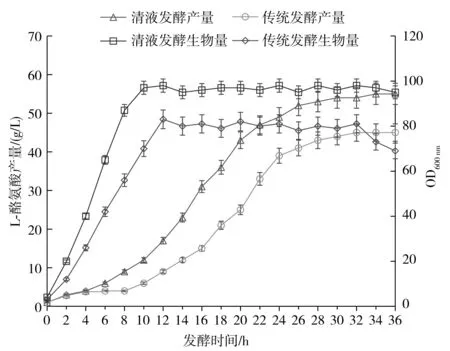
图3 清液发酵与传统发酵L-酪氨酸产量、OD600 nm对比Fig.3 Comparison of L-tyrosine yield and OD600 nm between clear liquid fermentation and traditional fermentation
由图3可知,发酵前期清液发酵与传统发酵L-酪氨酸产量基本相同,在6 h时,清液发酵液产酸提前进入对数期,L-酪氨酸的生成速度加快,而传统培养基菌液产酸在8 h时进入对数期。在对数期,清液发酵液比传统发酵液生产L-酪氨酸的速度快,且传统发酵液产酸比清液发酵液产酸提前进入稳定期。传统发酵在32 h时L-酪氨酸基本不再生成,最终产量在45.0 g/L左右。而清液发酵液在36 h时产量为55.2 g/L,清液发酵产酸能力比传统发酵产酸能力提高了22.7%,说明清液发酵液的营养成分更适合L-酪氨酸生产菌E.coliTR03的发酵产酸。
2.3.2 清液发酵与传统发酵对生物量的影响
由图3可知发酵过程中清液发酵与传统发酵L-酪氨酸生产菌E.coliTR03在36 h内生物量变化的对比情况,清液发酵液与传统发酵液都从2 h开始进入对数生长期,清液发酵液的OD600 nm比传统发酵液的OD600 nm增长迅速,清液发酵比传统发酵提前进入稳定期,分别为10 h和12 h。清液发酵液的OD600 nm最大值为98,传统发酵液的OD600 nm最大值为83,改良后的清液发酵相对于传统发酵生物量提高了18.1%。传统发酵32 h时生物量开始急剧下降,说明此时传统发酵进入了衰亡期,而清液发酵一直到36 h时仍然处在稳定期,表明清液发酵可以使发酵液提前进入稳定期且可以将稳定期维持更长的时间,有利于L-酪氨酸的生产。
2.3.3 清液发酵与传统发酵对上清液透光率和糖酸转化率的影响
传统发酵和清液发酵上清液透光率与糖酸转化率对比见表5。

表5 传统发酵和清液发酵上清透光率与糖酸转化率对比Table 5 Comparison of supernatant light transmission rate and sugar-acid conversion rate between traditional fermentation and clear liquid fermentation
由表5可知,发酵35 h后取上清液测量,传统培养基的上清液透光率只有26.9%,而清液培养基的上清液透光率为47.8%,上清液透光率提高了20.9%,表明将发酵液中色素含量高的玉米浆、豆粕水解液和蛋白胨利用各种色素含量低的氨基酸、核苷类等物质等效替换后,发酵液中的色素泡沫杂质类物质明显降低,使上清液透光率明显升高,符合清洁绿色环保的标准。传统发酵和清液发酵的糖酸转化率分别为20.6%、25.2%,相比提高了4.6%,提升效果明显。
2.4 清液发酵与传统发酵对分离提取的影响
传统发酵与清液发酵在0.8%活性炭添加量、pH 0.5、设定温度80 ℃、时间30 min的条件下,分离提取L-酪氨酸过程中的各项参数,见表6。
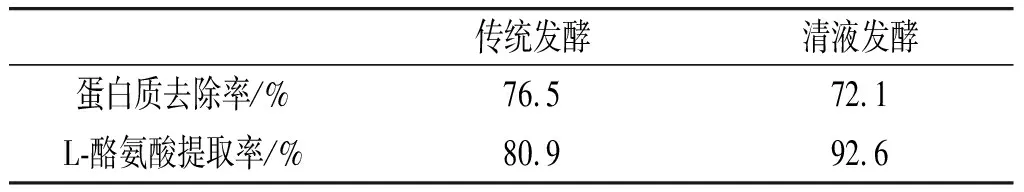
表6 传统发酵与清液发酵分离提取各项参数Table 6 Parameters of separation and extraction of traditional fermentation and clear liquid fermentation
由表6可知,传统发酵液与清液发酵液的蛋白去除率分别为76.5%、72.1%,清液发酵液的蛋白去除率比传统发酵蛋白去除率低,原因是经过培养基的优化,清液发酵液中的生物量有所提高,从而导致在相同时间内生物量高的发酵液蛋白去除率偏低。经过L-酪氨酸产物提取,清液发酵L-酪氨酸提取率为92.6%,传统发酵L-酪氨酸提取率为80.9%,清液发酵提取率提高11.7%,因此证明清液发酵通过降低发酵液的黏稠度、杂质和色素类物质,将分离提取的效率提高,有利于L-酪氨酸产量的提升。
3 结论
本实验通过等效替代的方法优化了传统培养基的成分,利用部分氨基酸、核苷和生物素替换传统培养基中的蛋白胨、豆粕水解液和玉米浆,从而解决了发酵液浓稠、色素杂质多、泡沫多等问题导致的L-酪氨酸产量低、分离提取率低、难度大等现象。通过单因素实验方法确定了添加物最优添加范围,在单因素实验的基础上进一步优化了生物素、谷氨酸、苯丙氨酸和天冬氨酸添加量,最终确定所有添加物最佳添加量为天冬氨酸 2.2 g/L、谷氨酸2.4 g/L、苯丙氨酸 1.5 g/L、色氨酸1.5 g/L、琥珀酸1.5 g/L、生物素 1.0 mg/L、鸟苷 0.3 g/L、腺苷 0.3 g/L、肌苷 0.4 g/L。通过5 L发酵罐进一步验证得出,优化后的培养基在各方面的发酵性能都有所提升。5 L发酵罐发酵35 h,清液发酵的OD600 nm为98,比传统发酵的 OD600 nm提高18.1%;清液发酵的生物量比传统发酵的生物量高,导致在条件相同的情况下,清液发酵比传统发酵的蛋白去除率低,但是清液发酵的L-酪氨酸产量为55.2 g/L,比传统培养基发酵提高22.7%;上清液透光率为47.8%,比传统培养基提高20.9%。最后通过分离提取验证,清液发酵L-酪氨酸分离提取率为92.6%,比传统发酵的提取率提高11.7%。由此证明该清液培养基无论是在清洁环保方面还是在发酵性能和分离提取方面都表现出不错的效果。
