顶空气相色谱法分析干姜、细辛及其药对挥发性成分
2023-11-22何嘉伟江汉美邸江雪刘天琪黄振阳
何嘉伟 江汉美 邸江雪 田 宇 刘天琪 黄振阳
(湖北中医药大学药学院湖北省药用植物研发中心,武汉,430065)
中药药对源于中医临床实践,系指两味中药通过相对固定的组合形式形成配伍单位而发挥综合效应,是中药复方“合群妙用”的缩影,体现了方剂配伍的规律特征和辨证施治的科学内涵[1]。
中药干姜来源于姜科植物姜ZingiberofficinaleRosc.的干燥根茎,性辛,热,归脾、胃、肾、心、肺经,具有温中散寒、温肺化饮的功效,有解热镇痛、抗炎抑菌、保护心血管等药理作用[2]。中药细辛来源于马兜铃科植物北细辛[Asarumheterotr-opoidesFr.Schmidtvar.mandshuricum(Maxim.)Kitag.]、汉城细辛(AsarumsieboldiiMiq.var.seoulensenakai)或华细辛(Asarum sieboldii Miq.)的干燥根和根茎,性辛,温,归肺、肾经,具有解表散寒、祛风止痛、温肺化饮的功效,有解热镇痛、镇静、保护心脑血管系统、抗肿瘤等药理作用;细辛也在国家卫生健康委员会、国家中医药管理局推荐临床治疗新型冠状病毒感染(Corona Virus Disease 2019,COVID-19)的通用方剂清肺排毒汤中得到合理应用[3-4]。
干姜、细辛药对首见于《伤寒论》中的小青龙汤中,可温肺散寒化饮止喘,用于治疗肺寒之诸喘证;临床上主治呼吸系统的疾病如风寒袭肺引起的痰饮、咳喘、鼻塞、慢性阻塞性肺病等病症[5-8]。挥发油类物质为干姜、细辛药对的主要有效成分,目前在国内外文献中运用顶空固相微萃取-气相色谱-质谱联用(Headspace Solid-phase Microextraction-gas Chromatography-mass Spectrometry,HS-SPME-GC-MS)法分析干姜、细辛药对配伍后的挥发性成分尚未见报道。本研究采用HS-SPME-GC-MS法对比分析干姜、细辛的挥发性成分,为后续其药效成分的深入研究奠定基础,同时进一步考察配伍前后的挥发性成分变化,以期为药对发挥协同增效的物质基础研究和临床应用提供科学依据。
1 仪器与试药
1.1 药材 干姜(湖南松龄堂中药饮片有限公司,批号:20210406),细辛(湖南松龄堂中药饮片有限公司,批号:202104014),经湖北中医药大学杨红兵教授鉴定,分别为姜科植物姜ZingiberofficinaleRosc.的干燥根茎和马兜铃科植物华细辛AsarumsieboldiiMiq.的干燥根和根茎。将干姜和细辛分别用粉碎机打成粉末并过16目筛,取出备用。
1.2 仪器 手动固相微萃取进样装置(IKA公司,德国,型号:C-MAG HS-4),气相-质谱-计算机联用仪(Hewlett-Packard公司,美国,型号:Agilent6890/5973),电子天平(北京赛多利斯天平有限公司,型号:ALC-210.2)。
2 方法与结果
2.1 GC-MS色谱与质谱条件
2.1.1 GC条件 色谱柱:HP-5MS石英毛细管柱(30 m×0.25 mm,0.25 μm);载气:高纯度氦气(99.999%);流速0.8 mL/min;进样口温度:230 ℃;程序升温:从50 ℃开始,以10 ℃/min升温至230 ℃;不分流进样。
2.1.2 MS条件 EI源;离子源温度230 ℃,电离电压70 eV;四极杆温度150 ℃;扫描质量范围35~550 m/z。
2.2 顶空固相微萃取条件的优化
2.2.1 取样量的优化 分别精密称取药对混合粗粉0.4 g、0.6 g、0.8 g、1.0 g,在60 ℃下平衡10 min,选用65 μm PDMS/DVB萃取纤维头萃取15 min,按“2.1”项下条件进样测定,以色谱出峰总面积为主要指标,以质谱鉴定出的化合物种类数为辅助指标,对样品取样量进行优化。当取样量为0.8 g时,萃取吸附效果最好,故确定0.8 g为最佳取样量。
2.2.2 萃取温度的优化 精密称取药对混合粗粉0.8 g,其他条件不变,分别在40 ℃、60 ℃、80 ℃、100 ℃、120 ℃条件下对混合样品进行萃取,按“2.1”项下条件进样测定和分析。当萃取温度为100 ℃时,萃取吸附效果最佳,故确定100 ℃为最佳萃取温度。
2.2.3 萃取时间的优化 精密称取药对混合粗粉0.8 g,在100 ℃下加热平衡10 min,其他条件不变,选用65 μm聚二甲基硅氧烷(Polydimethylsiloxane,PDMS)/二乙烯苯(Divinylbenzene,DVB)萃取纤维头分别萃取10、15、20、25、30 min,按“2.1”项下条件进样测定和分析。当萃取时间为25 min时,萃取效果最佳,故确定25 min为最佳萃取温度。
2.2.4 解析时间的优化 精密称取药对混合粗粉0.8 g,在100 ℃下加热平衡10 min,选用65 μm PDMS/DVB萃取纤维头萃取25 min,取出,立即插入色谱仪进样口,分别解析1、2、3、4、5 min,按“2.1”项下条件进样测定和分析。当解析时间为3 min时,总峰面积最大,故确定3 min为最佳解析时间。
2.2.5 顶空固相微萃取条件 综合“2.2.1~2.2.4”项的考察结果,最终确定顶空固相微萃取条件的最佳条件为:精密称取药对混合粗粉0.8 g,至于15 mL顶空瓶中,插入装有65 μmPDMS/DVB萃取纤维头的手动进样器,在100 ℃下加热平衡10 min,再压缩手柄伸出萃取头萃取25 min,取出,立即插入气相色谱仪进样口解析3 min,不分流进样。单味药材干姜和细辛的实验条件同上。
2.3 数据分析 采用峰面积归一化法计算各组分相对百分含量,并通过NIST08质谱数据库对所出峰的质谱图进行检索,结合相关文献进行人工谱图解析,并结合相对保留时间以鉴定各组分。实验结果通过SPSS 21.0统计软件对干姜、细辛及其药对的挥发性成分及其含量进行主成分分析(Principal Component Analysis,PCA),得到主成分的特征值和贡献率。各特征向量挥发性成分相对含量再通过SPSS 21.0标准化后,得到各主成分得分及综合得分。
2.4 样品测定结果
按照上述条件,采用HS-SPME-GC-MS法对干姜、细辛配伍前后挥发性成分进行检测分析,初步鉴定出了78种化合物,挥发性成分分析结果见表1。干姜、细辛及其药对总离子流见图1。
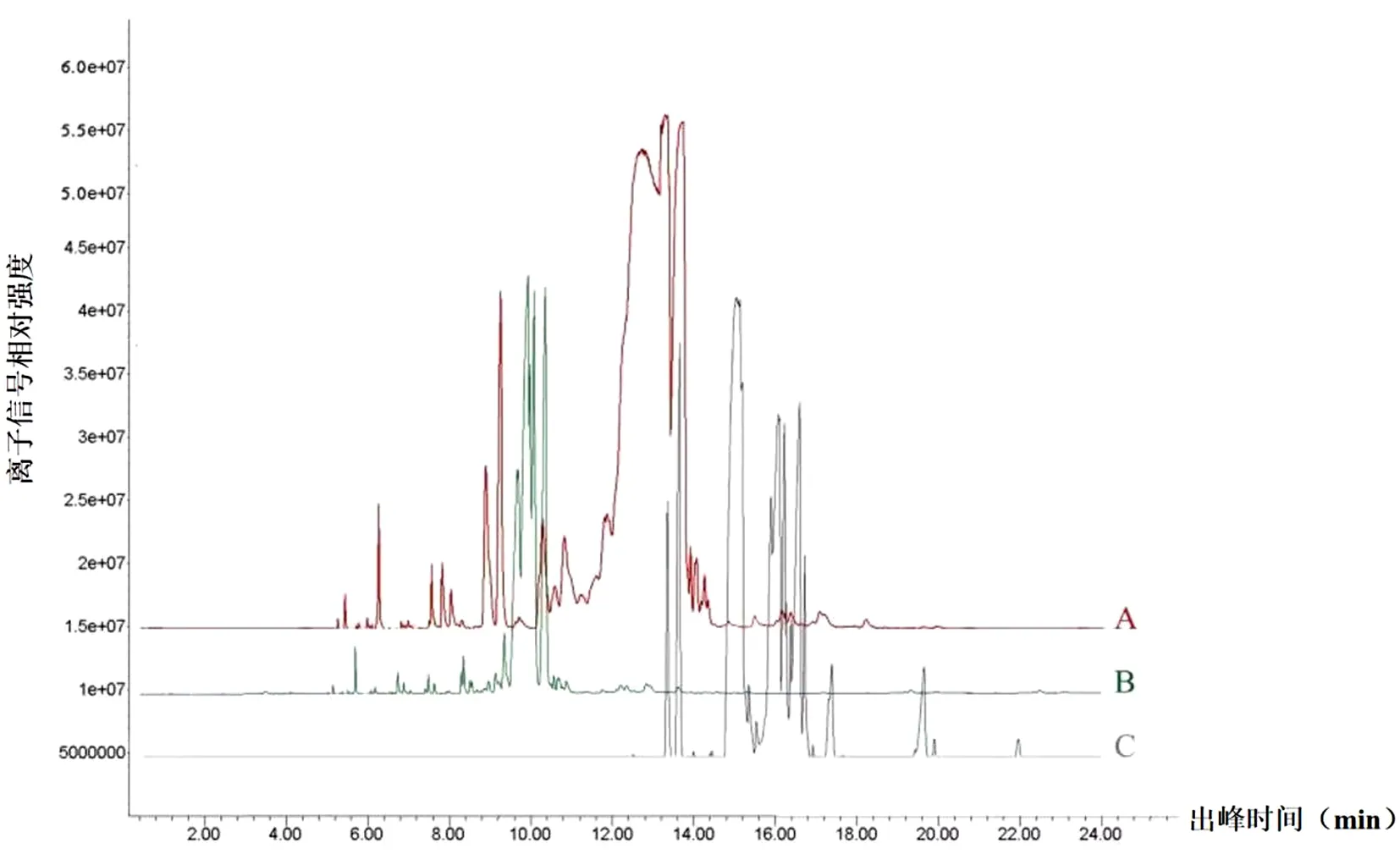
图1 干姜、细辛及其药对挥发性成分总离子流注:A.药对;B.干姜;C.细辛
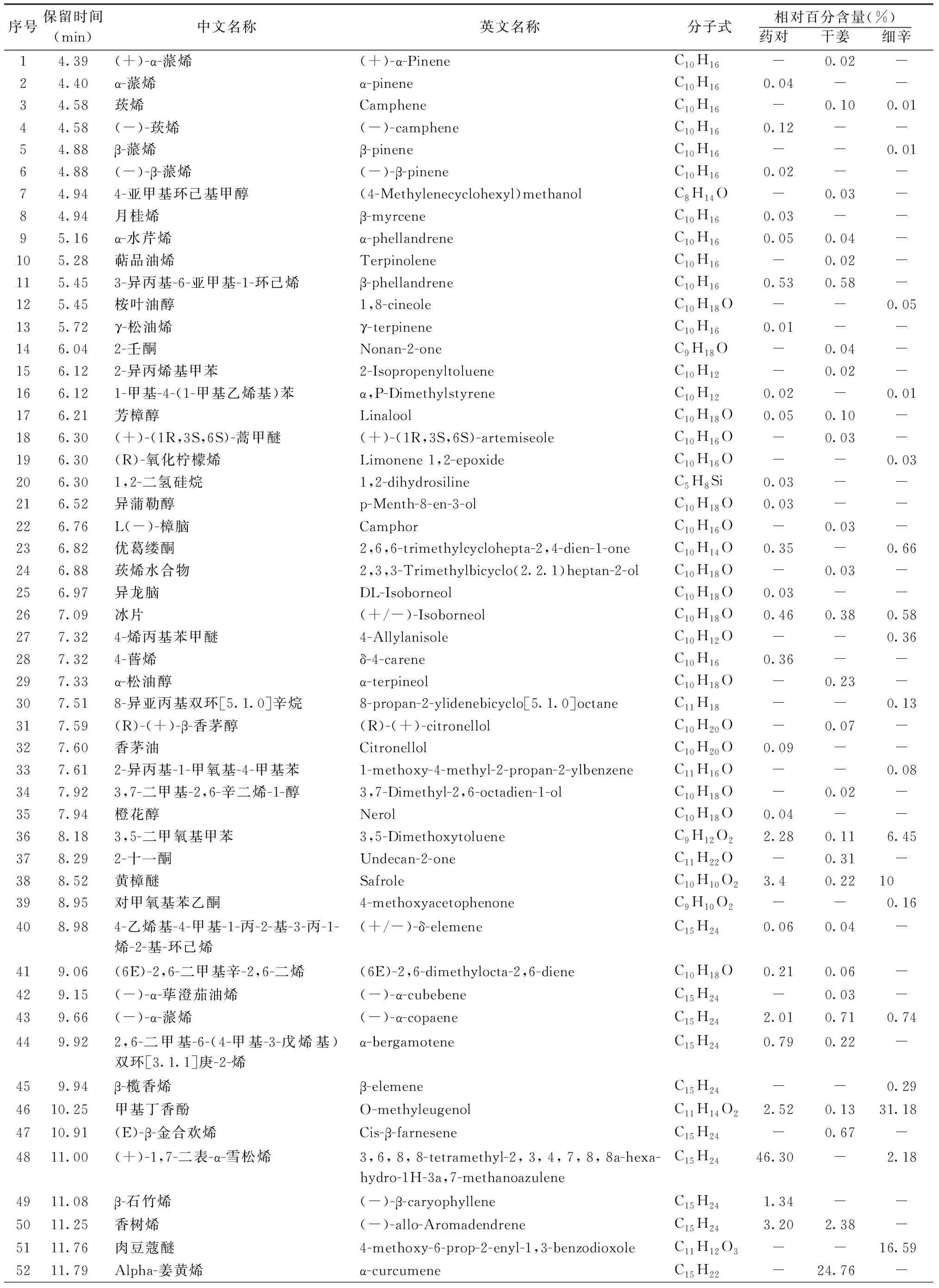
表1 干姜、细辛以及干姜细辛药对挥发性成分分析结果
2.4.1 干姜、细辛以及药对的挥发性成分的定量分析 从干姜、细辛及其药对中共鉴定出挥发性成分78种。其中从干姜、细辛药对中分离出52个峰,并鉴定出37种成分;从药材干姜中分离出52个峰,并鉴定出38种成分;从药材细辛中分离出45个峰,并鉴定出33种成分;各成分总量分别占总挥发性成分的96.31%,95.13%和97.69%。见表1,图1。
干姜、细辛药对中挥发性成分含量最高的为(+)-1,7-二表-α-雪松烯(46.3%),其次为B-倍半水芹烯(16.94%)、(-)-β-花柏烯(13.65%)、黄樟醚(3.4%)、香树烯(3.2%)、甲基丁香酚(2.52%)、3,5-二甲氧基甲苯(2.28%)、(-)-α-蒎烯(2.01%)等;药材干姜中挥发性成分含量最高的为(-)-α-雪松烯(49.57%),其次为α-姜黄烯(24.76%)、B-倍半水芹烯(5.11%)、(5-甲基-1-亚甲基-4-己烯基)环己烯(5.08%)、香树烯(2.38%)、α-法呢烯(2.29%)、(-)-α-蒎烯(0.71%)等;药材细辛中挥发性成分含量最高的为甲基丁香酚(31.18%),其次为肉豆蔻醚(16.59%)、正十五烷(11.2%)、黄樟醚(10%)、3,5-二甲氧基甲苯(6.45%)、(-)-α-雪松烯(49.57%)、B-倍半水芹烯(2.57%)、卡枯醇(2.27%)等。
2.4.2 干姜、细辛及药对的挥发性成分中共有成分和特有成分分析 干姜、细辛及药对挥发性成分中有6种共有成分,分别为冰片、3,5-二甲氧基甲苯、黄樟醚、(-)-α-蒎烯、甲基丁香酚、B-倍半水芹烯。三者共有成分中(-)-α-蒎烯和B-倍半水芹烯的含量相对于干姜、细辛配伍前上升较为明显;冰片、3,5-二甲氧基甲苯、黄樟醚和甲基丁香酚的含量相对于干姜、细辛配伍前下降。共有成分中部分成分差异较大,如药材细辛中甲基丁香酚的相对含量为31.18%,而药对和干姜药材中占比分别为2.52%和0.13%;药对中B-倍半水芹烯的相对含量为16.94%,而干姜和细辛单味药材中占比分别为5.11%和2.57%。
将干姜、细辛及药对的挥发性成分进行比较,药对中有16种特有成分,占总挥发性成分含量的16.58%,主要特有成分有(-)-β-花柏烯(13.65%)、β-石竹烯(1.34%)、橙花树醇(0.58%)等;干姜中有20种特有成分,占总挥发性成分含量的29.78%,主要特有成分有α-姜黄烯(24.76%)、α-法呢烯(2.29%)、(E)-β-金合欢烯(0.67%)等;细辛中有20种特有成分,占总挥发性成分含量的33.31%,主要特有成分有肉豆蔻醚(16.59%)、正十五烷(11.2%)、3,4-(亚甲基二氧)苯丙酮(2.07%)等。
2.4.3 干姜、细辛及药对挥发性成分种类和含量的差异 表1中的挥发性成分大致可分为8类,包括烯类、醇类、醚类、酚类、酮类、芳烃类、烷烃类和其他类化合物。药对挥发性成分中烯类成分相对含量最高为86.01%;干姜药材挥发性成分中同样也是烯类成分相对含量最高为92.15%;细辛药材挥发性成分中酚类成分相对含量最高为31.18%,其次为醚类成分为26.95%。三者的挥发性成分种类和含量的具体信息见表2。

表2 干姜、细辛以及药对挥发性成分种类和相对含量的分析
2.4.4 干姜、细辛及药对挥发性成分PCA 由表1可知,3组样品的挥发性成分含量数据离散,PCA结果显示前2个主成分的初始特征值均>1,其方差贡献率分别为37.552%、33.525%,2个主成分累计贡献率达到了71.077%,能够反映样品的整体信息,故取这2个主成分作为数据分析的有效成分。见表3。由表4可知,主成分综合评价中,药对与单味药材的评分差异较大,干姜、细辛药对挥发性成分的综合得分较高。

表3 主成分的特征值及其贡献率

表4 干姜、细辛及药对挥发性成分主成分得分和综合得分(分)
3 讨论
通过比较分析,药对中的挥发性成分并不是两味药材挥发性成分简单相加,干姜、细辛配伍后产生了许多新的成分且含量较高,同时单味药中有许多挥发性成分在药对中未被检出。结合三者的共有成分推测,干姜、细辛配伍前后挥发性成分变化可能是因为混合药材粉末在高温萃取过程中发生以化学变化为主的一系列反应,导致醚类和酚类物质转变成烯类物质。细辛中含量较高的毒性物质如黄樟醚、肉豆蔻醚、甲基丁香酚等成分在与干姜配伍后含量大幅度减少,提高了用药的安全性[9-11]。药对中挥发性成分相对含量上升的β-石竹烯具有抗炎抑菌的作用[12-13];B-倍半水芹烯具有抗肿瘤的药理作用[14];4-蒈烯和香树烯具有抑菌的作用[15-16];橙花叔醇具有抗疟疾、抗肿瘤、抗氧化等多种药理作用[17];(-)-α-蒎烯具有抗氧化的作用[18]。根据PCA结果显示,干姜、细辛药对评分最高。综上所述,干姜、细辛药对的配伍具有协同增效减毒的作用。
中药药对研究是阐明中医用药原则的重要途径,干姜、细辛药对是经过长期实践得出的经典药方,临床应用广泛。但是对干姜、细辛药对的挥发性成分研究较少。HS-SPME与传统的水蒸气蒸馏法等提取方法比较,操作更简单、费用低廉且减少了煎煮过程中造成的挥发性成分的流失;PCA通过对数据降维等分析,在中药成分分析鉴定中起到重要作用,PCA将数据进行标准化处理,进而便于对样品间的相似性和差异性进行科学准确的评价,主成分的特征值及方差贡献率是选择主成分的依据。通过SPSS 21.0统计软件对3组样品的78种挥发性成分及其含量进行PCA,对干姜、细辛及其药对的挥发性成分进行综合评价[19-20]。本研究首次采用HS-SPME-GC-MS结合化学计量法对干姜、细辛药对的挥发性成分进行比对分析,既拓展了其药效成分的研究方法,同时也为干姜、细辛药对发挥协同增效的临床应用提供了科学依据。
本研究采用HS-SPME-GC-MS联用分析干姜、细辛药对配伍前后的挥发性成分。共鉴定出78种成分,其中烯类成分占比最大。鉴定出干姜、细辛药对挥发性成分37种,干姜挥发性成分38种,细辛挥发性成分33种,各定性组分分别占总挥发性成分的96.31%,95.13%和97.69%。药对中新增16种成分,包括(-)-β-花柏烯、β-石竹烯、4-蒈烯、(-)-莰烯等。
同时,药对与干姜共有的挥发性成分为15种,与细辛共有的挥发性成分为10种,单味药材干姜和细辛共有的挥发性成分为9种,3组数据共有成分为6种。
利益冲突声明:无。
