C3N4原位负载镍金属催化剂上对氯硝基苯选择性加氢性能
2023-11-21马卫华
徐 浩,马卫华
(南京理工大学, 江苏 南京 210094)
硝基化合物是非常重要的有机化学工业中的材料[1],采用相应的芳香硝基化合物合成芳香胺是制备医药和精细化学品的重要步骤[2-4],氯代硝基苯(CNBs)选择性加氢得到的氯代苯胺(CANs)在染料、药品、除草剂、农药和聚苯胺工业中有着广泛的应用[5]。将CNBs转化为CANs时,传统的Fe/HCl还原法(Bechamp法)或硫化物还原法存在许多缺点,如多步骤路线、有毒废物的形成和不令人满意的产量[6]。虽然NaBH4或水合肼可以将CNBs直接还原成相应的CANs且具有优越的催化性能[7-8],但这些催化体系通常会产生大量副产物和巨大的环境压力[9]。从环境和工业角度看,CNBs的选择性加氢是一个备受关注的问题。CNBs加氢的一个主要缺点是在脱卤反应过程中产生相应的胺[10],因此,从CNBs制备不脱卤的CANs是一个巨大挑战。Pt、Ru、Pd、Au等[11-16]贵金属已广泛应用于CNBs加氢制备CANs,并表现出优异的催化性能,但贵金属的应用受限于资源短缺以及价格昂贵。在过去的几年里,许多非贵金属催化剂如Ni[17-18]、Ni-B[19]、Co-B[20-21]和Co-Mo-S[22]等被用于CNBs加氢,但这些催化体系仍需要较高的金属负载量或苛刻的反应条件,磁性纳米颗粒易聚集,会失去其粒径小所带来的独特性能[23],研究具有良好性能的非贵金属催化剂对CNBs加氢具有重要意义。
催化剂载体对其催化性能起着至关重要的作用[24-26],聚合石墨氮化碳(C3N4)因其特有的高热/化学稳定性、丰富的氮官能团、类石墨烯结构、比表面积大等优点而受到关注[27-30]。C3N4骨架结构可为金属活性位点提供独特的化学环境,影响金属位点的电子特性以及它们与底物/中间体的相互作用,这可能有利于提高氢化反应的活性/选择性[31]。
为了获得更高催化性能的镍基催化剂,本研究在高比表面积C3N4上原位负载镍,获得更高催化活性的镍基催化剂。考察不同镍负载量的催化剂、反应温度和反应压力对对氯硝基苯加氢的催化活性影响,并考察最佳催化剂的稳定性。
1 实验部分
1.1 试 剂
三聚氰胺(C3H6N6)、乙酸镍(C4H6O4Ni·4H2O)、对氯苯胺(C6H6ClN)、无水乙醇(C2H5OH)、硝基苯(C6H5NO2)、苯胺(C6H7N)以及对氯硝基苯(C6H4ClNO2),均为分析纯,上海麦克林生化科技有限公司。
1.2 仪 器
恒温加热磁力搅拌器(SF-101-SZ),巩义市科瑞仪器有限公司;万分之一天平(FA2004N),上海丙森电子科技有限公司;高温管式炉(OTF-1200X-S),合肥科晶材料技术有限公司;气相色谱仪(GC2010),日本岛津公司;高压反应釜(WP-MSAR-2010025A),西安华泰科思实验设备有限公司;电热鼓风恒温干燥箱(DHG9050A),山东博科生物产业有限公司;离心机(TGL-16G),上海安亭科学仪器厂。
1.3 催化剂制备
采用原位直接焙烧的方法,称取1.5 g三聚氰胺和1.5 g乙酸镍于研钵混合并研磨均匀,将研磨好的粉末置于550 ℃的高温管式炉氮气氛围下焙烧3 h,冷却至室温,收集储藏备用,催化剂样品标记为Ni@C3N4-2。三聚氰胺用量3 g,不添加乙酸镍制备得到的催化剂标记为C3N4。保持乙酸镍用量1.5 g,改变三聚氰胺和乙酸镍质量比为6∶5和4∶5,制备得到的催化剂分别标记为Ni@C3N4-1和Ni@C3N4-3。
1.4 催化剂表征
XRD分析仪为德国布鲁克公司D8-advanced型X射线粉末衍射仪,CuKα,工作电压40 kV,工作电流40 mA。采用康塔公司NOVA 4200e型比表面仪测定催化剂的比表面积和孔结构。采用日本电子株式会社 JEM-4000EX透射电子显微镜(TEM)表征催化剂形貌。
1.5 对氯硝基苯加氢活性评价
将10 mg制备得到的催化剂、0.5 mmol对氯硝基苯和1 mL乙醇加入10 mL高压反应釜,用N2排除反应釜内的空气,通放气3次即可。充入1 MPa的 H2,在60 ℃条件下反应2 h,反应结束后取上清液用气相色谱分析(HP-5毛细管柱,柱温160 ℃,氢火焰检测,检测室温度240 ℃,进样器温度260 ℃,N2为载气),计算选择性与转化率。
2 结果与讨论
2.1 表征结果
2.1.1 N2吸附-脱附
不同负载量Ni@C3N4催化剂和C3N4的N2吸附-脱附等温线见图1,比表面积及孔结构数据如表1所示。
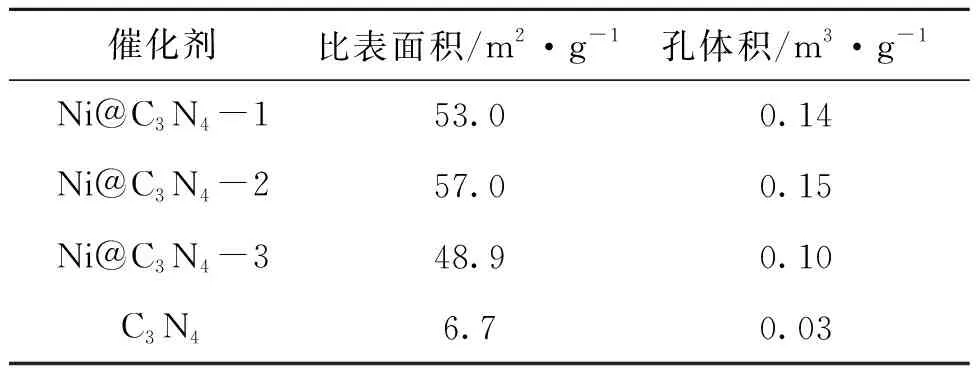
表1 不同负载量Ni@C3N4催化剂的比表面积及孔结构数据Table 1 Specific surface and pore structure data of Ni@C3N4 catalysts with different loading amounts

图1 不同负载量Ni@C3N4催化剂的N2吸附-脱附等温线和孔径分布Figure 1 N2 adsorption-desorption isotherms of Ni@C3N4 catalysts with different loading amounts
由图1(a)可以看出,催化剂的N2吸附-脱附等温线呈现Ⅳ型曲线,存在介孔结构[32]。通过图1(b)可以发现,催化剂孔径大部分约为4 nm,并且Ni@C3N4催化剂比纯C3N4在孔径4 nm处的孔体积更大。通过表1可见,Ni@C3N4-2催化剂具有最大的比表面积(57.0 m2·g-1)和孔体积(0.15 m3·g-1),表明在Ni@C3N4-2催化剂上反应物与活性位点的接触几率更高,也意味着更高的反应速率。更重要的是,C3N4的比表面积和孔体积远小于其他3个催化剂,可能是由于催化剂制备过程中乙酸镍的分解有利于孔道结构生成。
2.1.2 XRD
图2为不同催化剂的XRD图。由图2可以看出,在27.4°出现的衍射峰归属于C3N4的(002)晶面,代表其具有层间堆叠结构[33],表明三聚氰胺经过高温聚合可以得到类似石墨结构的C3N4材料。负载Ni后, C3N4特征峰向左微小偏移,说明镍的嵌入使C3N4晶格发生变化。负载Ni之后的Ni@C3N4-1、Ni@C3N4-2和Ni@C3N4-3催化剂均出现3个强的衍射峰,分别归属于Ni的(111)、(200)和(220)特征峰,对应的2θ分别为44.5°、51.8°和76.4°(JCPDS04-0850)[34]。Ni特征峰的半峰宽很窄,说明Ni的负载颗粒比较大。
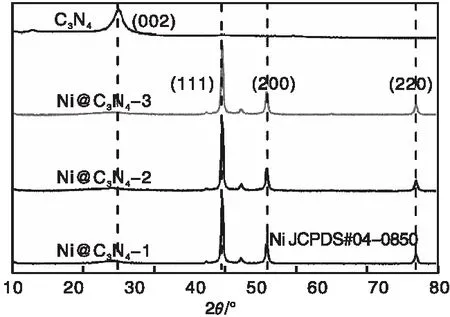
图2 不同负载量Ni@C3N4催化剂的XRD图Figure 2 XRD patterns of Ni@C3N4 catalysts with different loading amounts
2.1.3 TEM
图3为不同负载量Ni@C3N4催化剂的TEM照片和粒径分布。

图3 不同负载量Ni@C3N4催化剂的TEM照片和粒径分布Figure 3 TEM images and size distribution of Ni@C3N4 catalysts with different loading amounts(a).Ni@C3N4-1;(b).Ni@C3N4-3;(c、d).Ni@C3N4-2;(e).Ni@C3N4-2粒径分布
从图3(a)、(b)和(c)可以看出,催化剂中存在Ni颗粒,与XRD结果一致,并且可以看出每个Ni金属粒子都被包覆。由图3(b)可以看出,Ni@C3N4-3的Ni颗粒较大且聚集在一起,说明随着三聚氰胺与乙酸镍质量比的减小,Ni颗粒会变大。通过图3(d)更加直观地看出,Ni金属被C3N4材料包覆。由图3(c)和(d)可以看出,Ni@C3N4-2催化剂颗粒分布较为均匀,以(12~17) nm小颗粒为主[图3(e)],从而展现出更卓越的催化性能。
2.2 催化剂催化性能
2.2.1 Ni负载量
图4为不同Ni负载量Ni@C3N4催化剂的性能评价结果。
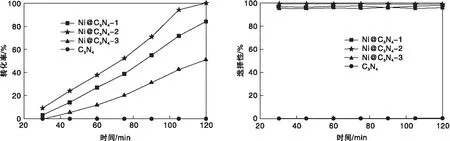
图4 不同负载量Ni@C3N4催化剂对对氯硝基苯的加氢效果Figure 4 Hydrogenation activities of Ni@C3N4 catalysts with different loading amounts in p-chloronitrobenzene hydrogenation
由图4可见,纯的C3N4对对氯硝基苯加氢几乎无催化性能,负载Ni之后,催化剂具有优异的催化性能。值得注意的是,Ni@C3N4-2催化剂(99.9%)相比Ni@C3N4-1(84.5%)和Ni@C3N4-3(51.0%)催化剂具有更高的转化率。由图4还可以看出,选择性非常高,均大于95%,说明Ni负载量对催化剂选择性的影响极小。这些结果表明,调控原料的质量比可以改变Ni颗粒的大小,影响金属Ni的活性,进而影响对氯硝基苯转化率。
2.2.2 反应压力
图5为对氯硝基苯的转化率随反应压力的变化曲线。
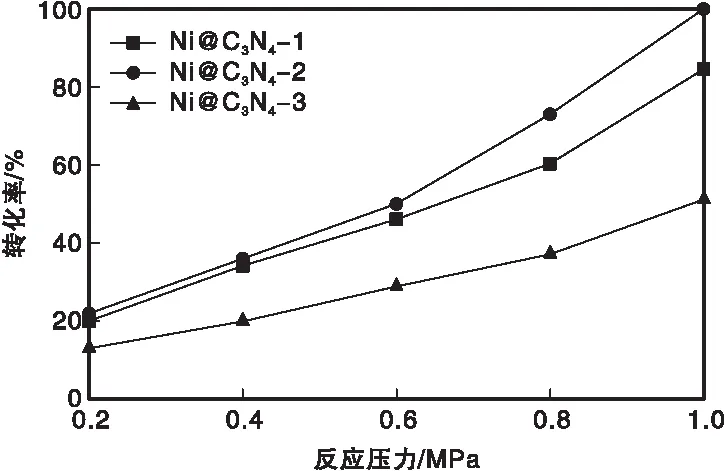
图5 反应压力对对氯硝基苯转化率的影响Figure 5 Effect of reaction pressure on conversion of p-chloronitrobenzene
由图5可以看出,反应压力增加到0.6 MPa以后,转化率明显提高,且Ni@C3N4-2催化剂的提升幅度相对于其他两个催化剂更大。这是由于在低压下,催化剂对对氯硝基苯和氢原子的吸附较弱,随着反应压力增加吸附逐渐增加,从而提高了对氯硝基苯的反应速率。
2.2.3 反应温度
图6为不同反应温度下对氯硝基苯的转化率曲线。

图6 反应温度对对氯硝基苯转化率的影响Figure 6 Effect of reaction temperature on conversion of p-chloronitrobenzene
由图6可以看出,反应温度对对氯硝基苯的加氢转化有明显的影响。在20 ℃条件下,对氯硝基苯在所有Ni负载催化剂上的转化率仅约10%,当反应温度升高到60 ℃时,对氯硝基苯转化率均提高达5倍以上。而Ni@C3N4-2催化剂上对氯硝基苯转化率高达99.9%,约为20 ℃时的10倍。表明提高反应温度,可以提高反应物与活性位点的碰撞几率,从而增大反应速率。
2.2.4 对硝基苯类化合物的催化性能
为了测试Ni@C3N4-2催化剂对硝基苯类化合物是否具有普适性,选择不同的硝基苯类化合物进行验证,结果如表2所示。由表2可见,所有的硝基苯类化合物在Ni@C3N4-2催化剂上均具有高转化率,但Ni@C3N4-2催化剂对邻氯硝基苯的选择性很低,可能是因为-Cl与-NO2非常接近,导致在进行-NO2加氢反应的同时也进行了加氢脱氯反应。
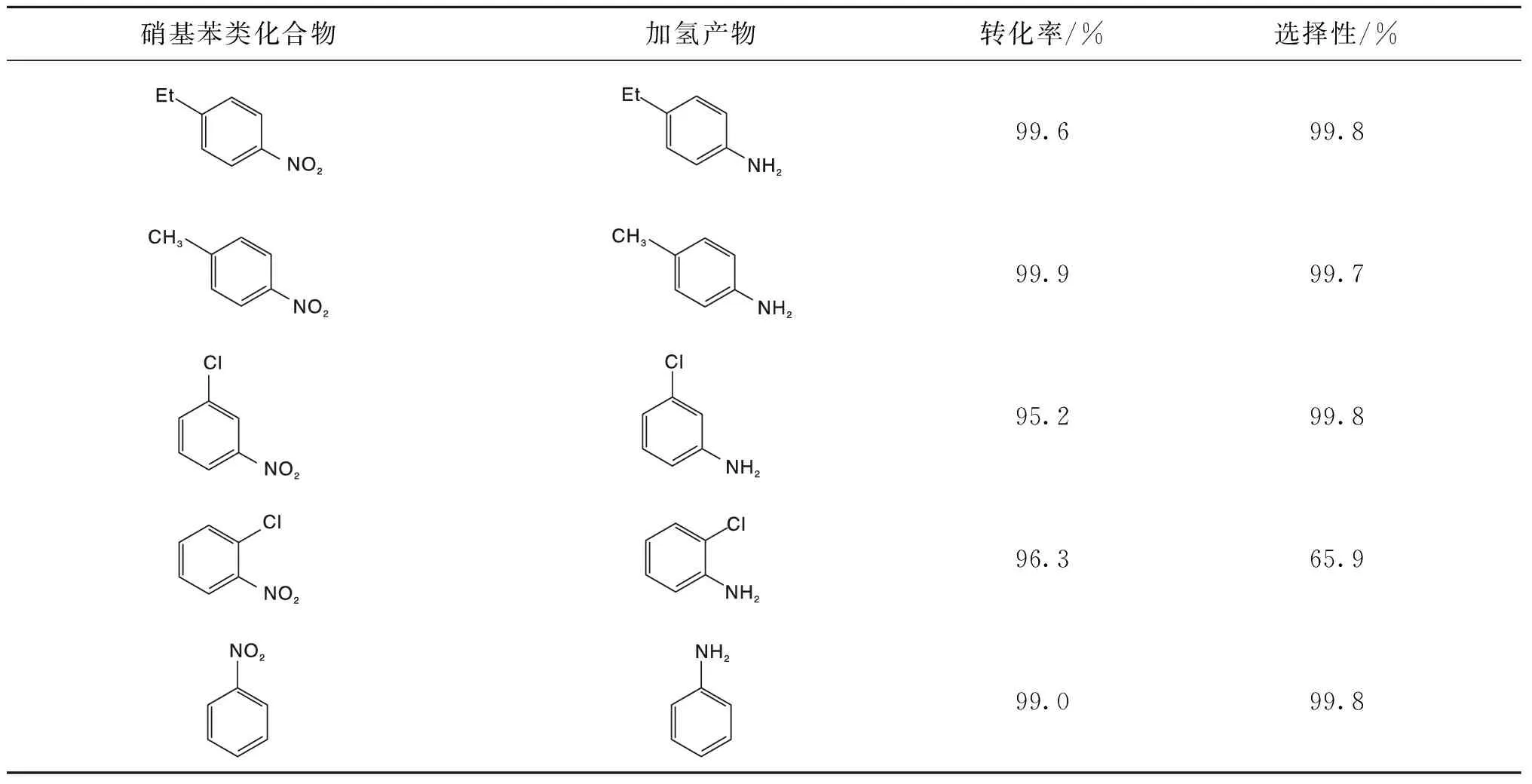
表2 Ni@C3N4-2催化剂对硝基苯类化合物的催化加氢性能Table 2 Catalytic hydrogenation performance of Ni@C3N4-2 catalysts for p-nitrobenzene compounds
2.2.5 催化剂的稳定性
Ni@C3N4-2催化剂5次循环使用的结果如图7所示,反应条件:79 mg对氯硝基苯,1 mL乙醇,反应压力1 MPa,反应温度60 ℃,反应时间2 h。

图7 Ni@C3N4-2催化剂稳定性测试Figure 7 Stability test of Ni@C3N4-2
由图7可以看出,在经历过5次循环后,催化剂Ni@C3N4-2具有优异的稳定性,对氯硝基苯的转化率约99%,选择性约95%。
3 结 论
通过原位直接焙烧的方法制备不同Ni负载量的Ni@C3N4催化剂,并将其用于对氯硝基苯催化加氢,结果表明,Ni@C3N4-2催化剂在相同催化条件下表现出最优异的催化活性,转化率高达99.9%,选择性高于95%。Ni@C3N4-2催化剂优异的催化性能主要归于其高比表面积和良好的金属分散性。同时,Ni@C3N4-2催化剂在经历5次循环使用后,性能基本保持稳定,说明具有优异的稳定性。
