MTNR1B基因突变合并胰岛素受体基因突变1例家系报道
2023-11-21崔焕焕刘晓云何戎华陈欢欢
崔焕焕,郑 帅,刘晓云,何戎华,陈欢欢*
1南京医科大学第一附属医院内分泌科,江苏 南京 210029;2无锡市惠山区人民医院内分泌科,江苏 无锡 214000
近年来全球糖尿病的发病率逐年提高,虽然临床上可供选择的降糖药层出不穷,但在临床工作中仍会遇到一些比较棘手的病例,即使尝试多种降糖方案后治疗效果仍不理想。基因诊断技术的发展日新月异,为进一步寻找这些患者的病因提供了有力支持。笔者发现了1 个褪黑激素受体1B(melatonin receptor 1B,MTNR1B)基因突变合并胰岛素受体(insulin receptor,INSR)基因突变的家系,现报道如下,希望为该类患者的诊治提供新思路。
1 病例资料
患者(先证者)为女性,42 岁,18 年前孕期产检时发现血糖升高,产后复查血糖仍高,糖耐量试验检查后诊断为“糖尿病”,予二甲双胍控制血糖。2年前患者因肢体麻木住院时调整为门冬胰岛素、二甲双胍及阿卡波糖治疗,监测血糖控制欠佳。患者为足月头位顺产,出生时身长50 cm,体重3.8 kg,母亲无糖尿病病史。既往有“慢性乙型肝炎”病史。家族史:祖母、父亲及兄弟3 人,患者及兄弟姐妹4 人和儿子均患有“糖尿病”。体格检查:身高161 cm,体重61 kg,体重指数(body mass index,BMI)23.53 kg/m2,血压130/82 mmHg,正常体型,颈部及腋下未见黑棘皮。查糖化血红蛋白为10.9%,糖尿病自身抗体均为阴性,胰岛功能检查结果见表1,胰岛素抵抗指数(HOMA-IR)为空腹血糖×空腹胰岛素/22.5,其中空腹血糖单位为mmol/L,空腹胰岛素的单位为U/mL,22.5为校正因子,该患者的HOMA-IR为3.40。
患者的姐姐在23岁因胰腺炎住院时确诊为“糖尿病”,正常体型,胰岛素抵抗明显,颈部可见黑棘皮(图1),怀孕期间每日胰岛素最大用量接近200 U,有高雄激素血症病史,多次因血糖控制不佳调整降糖方案。2018年12月因血糖控制不佳再次住院,查糖化血红蛋白为12.0%,糖尿病自身抗体均为阴性,门冬胰岛素及甘精胰岛素合计用量为77 U,同时服用阿卡波糖片(100 mg,每日3次)和格列美脲片(2 mg,每日1次),血糖控制基本达标,胰岛功能检查结果见表1,HOMA-IR为3.64。

图1 患者姐姐背部黑棘皮照片
患者的弟弟自幼饮食不控制,活动量少,体型肥胖,36 岁时因糖尿病性酮症酸中毒住院,无高雄激素血症病史,颈部未见黑棘皮,其降糖方案包括利格列汀(5 mg,每日1 次)、阿卡波糖片(50 mg,每日3次)、门冬胰岛素(早12 U、中12 U、晚10 U)及甘精胰岛素(22 U),查糖化血红蛋白为13.3%,糖尿病自身抗体均为阴性,胰岛功能检查结果见表1,HOMA-IR为0.76。
患者的妹妹因脑梗死住院时确诊为“糖尿病”,目前口服降糖药物治疗,血糖控制一般。此外患者的儿子21 岁,已确诊为“糖尿病”,但尚未正规治疗。患者的父亲和伯伯等均在20 岁左右时发现糖尿病。该家系成员糖尿病发病早,考虑不排除特殊类型糖尿病可能,为此征得患者及家属同意后,对患者及其家系成员的所有已知单基因遗传病相关基因(包括全部外显子,已报道的所有内含子、启动子位点)进行检测。
抽取患者及其家系成员外周血2 mL,提取DNA。利用捕获芯片将目标区域的DNA 片段进行富集后再借助高通量二代测序平台进行测序,采用靶向捕获测序。将原始测序数据去除污染和接头序列,然后利用BWA 软件将过滤后的序列与NCBI数据库人类基因组参考序列(hg19)比对,利用GATK软件分析得出单核苷酸变异(single nucleotide variation,SNV)和插入缺失突变(insertion deletion mutation,INDEL)的相关信息。然后通过ANNOVAR软件对所有的SNP 和INDEL 进行注释。利用PCR和Sanger 测序验证经过分析筛选得到的变异位点。利用Primer 3.0 在线软件设计PCR 引物。PCR 产物经过Sanger 测序并在ABI 3130 Genetic Analyzer上进行分析。再在家系成员中进行共分离验证。最后通过生物信息学蛋白功能预测软件SIFT、PolyPhen-2、REVEL对突变基因位点的致病性进行预测[1]。突变基因的筛选标准:在软件筛选基础上根据有无糖尿病病史,最后挑选出研究的基因。
基因检测结果发现患者家系中有两个位点的基因发生杂合突变,包括INSR基因(IVS7+/-5C>T,即c.1610+5G>A)和MTNR1B 基因(c.457C>T,p.R153W)(图2),未发现其他符合临床表型的突变基因。INSR 基因位于chr19-7167974,突变位于外显子前后5个碱基处,即7号内含子上第5个碱基由C 突变为T,该突变发生在内含子,会引起mRNA 剪接突变,可能会保留内含子或缺失外显子,导致翻译的多肽链发生改变,是否影响蛋白的剪切需要动物模型实验进行验证,蛋白功能预测软件SIFT、PolyPhen-2、REVEL的预测结果均为未知(表2)。另一个突变基因为MTNR1B 基因,其位于chr11-92714846,该编码区域的第457 号核苷酸中的胞嘧啶变异为胸腺嘧啶,导致合成的氨基酸发生改变(第153 号氨基酸由精氨酸变异为色氨酸),为错义突变,根据ACMG指南,初步判定该突变为临床意义未明,蛋白功能预测软件SIFT、PolyPhen-2、REVEL的预测结果分别为有害、有害、良性(表2)。该患者家系图(图3)及基因突变位点的验证结果如下(表3)。

图2 INSR与MTNR1B基因突变位点测序结果
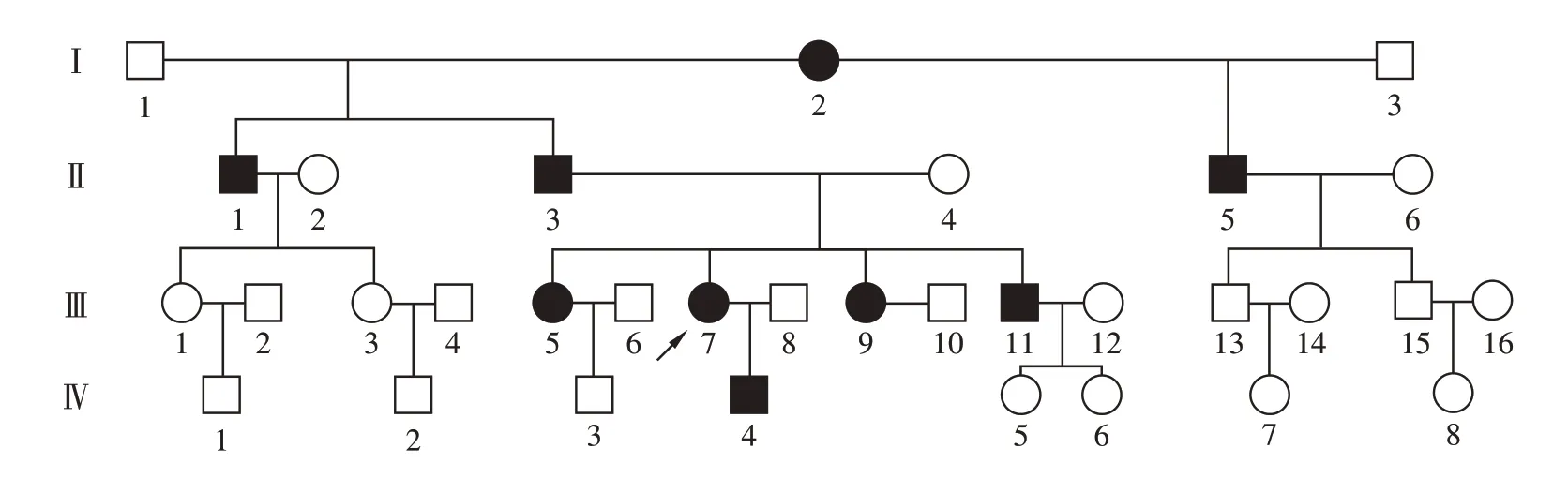
图3 患者家系图

表2 生物信息学蛋白功能预测软件分析结果

表3 患者家系基因检测报告汇总表
2 讨论
糖尿病及其相关并发症是全球疾病死亡的主要原因之一,2015—2017年我国18岁及以上人群的糖尿病患病率为11.2%[2]。国际糖尿病联合会估计,到2035 年,将有5.92 亿人患糖尿病。糖尿病的发病机制复杂,其发病与环境、遗传等多种因素相关。不管1型糖尿病还是2型糖尿病(type 2 diabetes mellitus,T2DM),均存在明显的遗传异质性。迄今为止,T2DM的致病机制仍不清楚。然而,越来越多的证据显示T2DM 的发病机制与遗传变异相关,其中胰岛素的信号转导和分泌途径相关基因之间的相互作用在个体对T2DM的易感性方面发挥重要作用。现有的降糖药物均有一定不良反应,因此发现一种可以有效帮助糖尿病管理的新型生物分子至关重要。
褪黑素是一种负责调节昼夜节律的激素,由哺乳动物和人类的松果体产生,分布于各靶器官和组织,研究显示其可通过影响昼夜节律来影响葡萄糖代谢[3]。褪黑素受体(melatonin receptor,MTNR)分为MTNR1和MTNR2两个亚型,主要分布于海马、下丘脑、视网膜等部位。MTNR1B基因编码的MTNR1B是褪黑激素受体家族的成员,其可在许多组织中表达,包括胰岛[4],褪黑素通过MTNR1B和下游的Raf-1/ERK信号通路对胰岛素基因转录发挥作用[5]。研究显示小鼠体内MTNR1缺失时,其糖代谢能力降低,推测激活MTNR1 能够促进葡萄糖的代谢能力,从而改善胰岛素抵抗,维持机体血糖稳态[6]。另有研究表明MTNR激动剂提高经棕榈酸处理过的脂肪细胞脂联素、脂联素受体1的表达,激活AMPK氧化应激通路,提高经棕榈酸处理过的脂肪细胞糖代谢能力,从而改善胰岛素抵抗,降低血糖。已有研究发现MTNR1B rs10830963 位点基因多态性与早期胰岛素反应缺陷和β细胞葡萄糖敏感性降低有关。全基因组关联研究发现MTNR1B 的遗传变异在调节空腹血糖水平和影响T2DM发病风险中发挥了重要作用,特别是由MTNR1B 调控的MTNR2,经鉴定MTNR2 功能丧失与T2DM 有关[7]。因此,研究认为褪黑素和MTNR1B 的遗传变异与T2DM 易感性有关[8]。褪黑素在动植物、真菌、细菌体内皆可发现,许多降糖中药(如黄芩、大黄、麦冬、连翘)中含有褪黑素成分,其中黄芩中的褪黑素含量高达0.7%,具有潜在的降血糖作用,为降糖药物研发提供参考。
INSR是一种细胞表面糖蛋白,属于酪氨酸激酶家族的受体,成熟的INSR由2个α亚单位和2个β亚单位组成,胰岛素通过与膜外的α亚单位结合,将信息通过跨膜的β亚单位传递至细胞膜内,引起受体及其底物发生一系列磷酸化反应,从而介导INSR生物效应的发挥。T2DM的发生与胰岛素分泌不足及胰岛素抵抗有关。胰岛素发挥作用必需由INSR 介导,因此INSR的数目及功能缺陷均会导致胰岛素抵抗的发生。研究显示INSR 基因突变通过以下几个方面引起胰岛素抵抗的发生:①抑制受体的生物合成,最常见的是形成成熟前链终止密码,使受体结构不完整;②INSR受体基因突变使受体向膜的转运发生障碍,导致细胞膜表面受体数目减少;③降低受体与胰岛素的亲和力;④抑制受体酪氨酸激酶活性;⑤加速受体降解[9]。
目前临床上与INSR基因相关的疾病有:①家族性高胰岛素血症性低血糖症5 型,也称为先天性高胰岛素血症、胰岛细胞增生症和婴儿持续性高胰岛素低血糖症,其特点为婴儿期持续低血糖,该病主要是由于血糖水平低下对胰岛素分泌形成负反馈调节所致[10];②松果体增生、胰岛素抵抗性糖尿病伴体细胞异常,又称为Rabson-Mendenhall 综合征,本病属于一组极端胰岛素抵抗综合征(其中还包括矮妖精貌综合征、脂营养不良以及A 型和B 型胰岛素抵抗综合征),它是一种发病率未知的罕见病;③胰岛素抵抗性糖尿病伴黑棘皮症,主要表现是严重的胰岛素抵抗、黑棘皮病和青春期女性患者的卵巢雄激素过多,女性患者经常表现为多毛症、痤疮、闭经或月经稀发和男性化。与MTNR1B 基因相关的疾病则为非胰岛素依赖性糖尿病,通常在儿童期或成年早期发病(一般在25岁之前),主要表现为发病初期胰岛素分泌缺陷和胰岛素依赖,临床表现为胰岛素抵抗和T2DM。
对该家系成员进行基因检测,结果显示家系中存在2 个突变的基因位点,包括位于chr19-7167974的INSR 基因(c.1610+5G>A)和chr11-92714846 的MTNR1B 基因(c.457C>T)。从患者及其家系位点验证报告可知,家系中已确诊的糖尿病患者中,除患者的弟弟2 个位点均未发现突变,妹妹仅MTNR1B 基因存在突变外,其余糖尿病患者均存在2个位点的突变。已有文献报道MTNR1B基因多态性与胰岛素受体底物(insulin receptor substrate 2,IRS2)基因变异相互作用,影响葡萄糖稳态[11]。该家系中先证者的弟弟无上述2 个基因位点的突变,糖尿病自身抗体为阴性,结合其自幼饮食不控制、体型肥胖,T2DM可能大,检查也提示其胰岛素抵抗指数较其他存在基因突变者低,这些基因表型上的区别值得研究和随访。
研究发现MTNR 基因与胰岛素敏感性、糖尿病和代谢综合征有关,提示MTNR 基因可能是多囊卵巢综合征(polycystic ovary syndrome,PCOS)的候选基因[12]。Shabani 等[13]发现给PCOS 患者补充褪黑素可明显降低HOMA-IR,并明显提高定量胰岛素敏感性指数。此外,多个研究提示褪黑素和MTNR1B的遗传变异与T2DM胰岛素抵抗也密切相关。分析该家系临床特点发现,INSR和MTNR1B基因未发生突变或仅存在MTNR1B 基因突变者胰岛素抵抗相对较轻,而2 个位点均突变者存在更严重的胰岛素抵抗,INSR基因的这一突变位点尚无报道,是新发现的突变位点,值得临床关注。患者姐姐的HOMA-IR为3.64,胰岛素抵抗明显,考虑可能与其INSR 和MTNR1B基因均存在突变有关。研究显示许多中药(如麦冬等)含有褪黑素成分,有潜在的降血糖作用,参芪降糖颗粒联合利拉鲁肽治疗胰岛素控制效果不佳的T2DM患者疗效显著[14]。文献报道,MTNR1B SNP 与IRS2 基因变异相互作用,与心外膜脂肪组织的数量相关,并影响葡萄糖稳态和血脂谱,从而影响心脏代谢风险[11]。岳颖等[15]研究显示,MTNR激动剂Neu-p11 可改善由线粒体融合蛋白2 介导的T2DM 大鼠的胰岛素抵抗、糖代谢异常及肝糖代谢酶mRNA 异常表达,达到保护肝脏、治疗糖尿病的作用。推测以MTNR 和INSR 为靶点的药物将成为以后的研究方向。
对于该家系来说,家系成员发病年龄早,大多数在25岁之前,有明显的家族遗传倾向。根据该家系特点考虑为常染色体显性遗传,部分家系成员目前尚未诊断为糖尿病,但不能排除他们以后不会发病,建议定期监测血糖变化。研究显示存在INSR和MTNR1B 基因突变者的胰岛素抵抗明显,无基因突变者胰岛素抵抗较轻,患者妹妹仅存在MTNR1B基因突变,考虑MTNR1B基因为其致病的主效基因可能大,蛋白功能预测软件SIFT、PolyPhen-2、REVEL分析MTNR1B 基因突变位点结果分别为有害、有害、良性,与临床表现相符。但INSR 基因突变位点的蛋白功能预测分析提示为未知,INSR基因突变是否与患者的发病有关,以及INSR和MTNR1B基因是否存在相互影响,仍需对子代其他人员观察随访后进一步探讨。
基因检测技术的发展为精准医疗奠定了基础。临床上对于治疗效果差的患者,要积极寻找病因,从基因层面进行疾病的诊断,从而为患者选择最佳的治疗方案。相信随着医学的不断进步,越来越多的糖尿病致病基因会被发现,从而为攻克糖尿病创造条件。
