SMARCA4突变的非小细胞肺癌患者临床特征及相关生物信息分析
2023-11-23陈雪松何梦钰
陈雪松,陈 玲,何梦钰
南京医科大学第一附属医院呼吸与危重症医学科,江苏 南京 210029
肺癌是最常见的恶性肿瘤,也是癌症相关死亡的主要原因之一。WHO统计2022年我国新增肺癌人数约87万,因肺癌死亡人数约50万,肺癌仍是威胁国民健康的重要疾病[1]。根据病理类型,肺癌分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC),其中NSCLC 占85%,主要包括肺腺癌及肺鳞癌。近年来,NSCLC 的诊断策略及治疗手段不断发展,但患者5年生存率仍不尽人意。NSCLC的发生发展是一个多因素、多基因共同参与的过程,因而探究其中的分子机制、寻找关键基因,对NSCLC 诊疗具有重要价值。
SWI/SNF(Switch/sucrose nonfermentable)染色质重塑复合体是ATP 依赖性染色体重塑复合物五大亚家族的成员之一,参与染色质修复、调控细胞增殖分化过程。SMARCA4(SWI/SNF related,matrix associated,actin dependent regulator of chromatin,subfamily A member 4)编码BRG1(brahma-related gene-1)蛋白,催化ATP 水解,是为整个SWI/SNF 复合物提供能量的核心基团[2]。由此可见,SMARCA4对肿瘤发生发展过程中的基因调控起重要作用,然而目前SMARCA4基因与NSCLC的相关研究仍不深入。本研究分析了含SMARCA4基因突变NSCLC患者的临床特征及预后,同时采用生物信息学方法探究SMARCA4基因在NSCLC中的差异表达、突变、与预后相关情况及潜在的生物学功能,为NSCLC诊断及治疗提供新思路。
十月,秋意正浓。下过一场绵绵细雨,那山、那水、那树更是秋味十足。这不,校园里的雾也迎来了它最浓的时光。它像一名神奇的魔术师,一会儿将远处那座山头变得无影无踪;一会儿将美丽的校园装点得扑朔迷离。秋日校园的协奏曲就这样开始了……
文体学为研究文体特征提供了具体的分析方法,它往往聚焦于文体的语言形式和使用技巧,继而探讨语言的艺术特色。从文体学视角分析英语诗歌称得上是一种创新的研究方法,它把语言学的发展成果和诗歌鉴赏紧密地联系在一起,不仅可以彰显诗歌的语言魅力,而且有利于揭示诗歌的主题意义。对英语诗歌的文体特征进行研究可以促进读者提高英语诗歌的欣赏水平,亦能帮助读者进行诗歌创作。
1 对象和方法
1.1 对象
回顾性分析2020 年1 月—2022 年12 月于南京医科大学第一附属医院就诊且符合条件的35 例患者临床资料。纳入经组织病理或细胞病理确诊为NSCLC[根据WHO(2021 版)肺肿瘤组织学分型[3]]且经二代测序(next generation sequencing,NGS)方法检测有SMARCA4基因突变的患者。本研究获得南京医科大学第一附属医院伦理委员会批准(2023-SR-318)。
1.2 方法
运用TIMER数据库(http://timer.cistrome.org)获取SMARCA4在不同肿瘤中的相对表达水平;TIMER数据库、GEPIA 数据库(http://gepia.cancer-pku.cn)分析SMARCA4 在肺腺癌组织与正常组织、肺鳞癌组织与正常组织间的表达差异。
本研究共纳入35 例经NGS 确诊为SMARCA4基因突变的NSCLC 患者,记录其性别、年龄、吸烟史、组织学类型、SMARCA4突变类型、突变位点、共突变基因等指标。对35例患者进行电话或门诊随访,统计患者生存时间。总生存期(overall survival,OS)指诊断NSCLC开始直至由于任何原因死亡的时间。
本研究纳入35例SMARCA4基因突变患者,1年生存率80%(图1A)。其中伴随EGFR 基因突变患者1 年生存率100%,EGFR 野生型患者1 年生存率71.4%,生存分析提示EGFR野生型与突变型患者预后差异有统计学意义(P=0.016,图1B)。伴随TP53基因突变患者1 年生存率72.7%,OS(14.2±2.0)个月,TP53 野生型患者1 年生存率87.5%,OS(28.3±1.6)个月,两者差异无统计学意义(P=0.067,图1C)。伴随KRAS 基因突变患者1 年生存率25.0%,OS(11.0±2.9)个月,KRAS 野生型患者1 年生存率87.1%,OS(27.9±1.6)个月,生存分析提示KRAS 野生型与突变型患者预后差异有统计学意义(P=0.003,图1D)。
1.2.1 患者资料收集
脂肪俗称油,油每天摄入量比较好算,但比较难控制。几乎全世界所有国家都建议油每天的摄入量不超过每人每天营养摄入总量的30%,最好能控制在25%左右。按30%来算,如果一个人每天摄入能量为1800千卡,那么这个人每日油的摄入量就不应该超过60克。这60克油不是每日的烹调用油,是包括我们食物里所有的油,比如鸡蛋、牛奶、肉、坚果和糕点等所含的油。
通过cBioPortal 数据库(https://www.cbioportal.org)的“cancer types summary”模块分析SMARCA4基因在所有TCGA NSCLC的突变类型和拷贝数改变(copy number alteration,CNV)信息,并进一步分析肺腺癌及肺鳞癌中的遗传突变信息。同时,在数据库“comparison”模块进行SMARCA4 突变型及野生型肺腺癌及肺鳞癌患者的生存分析。
1.2.3 遗传突变分析
1.2.4 蛋白相互作用分析
运用STRING 数据库(Version:11.5)探索与SMARCA4 潜在相互作用的蛋白并构建网络图,相互作用蛋白网络构建条件为置信度大于0.7。
1.3 统计学方法
要确保课程教学质量,关键在于有切合实际的教学措施及可操作的规范.课程质量标准作为课程教学的指导性文件,从课程的教学文件、教学运行、教学考核三个方面对机械设计课程教学加以规范,提出具体的教学建议,见表3.
2 结果
2.1 一般资料
本研究共纳入35 例SMARCA4 突变的NSCLC患者(表1),其中男23 例,女12 例,年龄(64.26 ±1.70)岁(39~78 岁),有吸烟史患者18 例,否认吸烟史患者17例。35例患者NSCLC组织学类型为腺癌27 例(77.1%),鳞癌4 例(11.4%),其他类型4 例(11.4%);Ⅰ~ⅢA 期8 例(22.9%),ⅢB~ⅣB 期27 例(77.1%)。
2.2 基因分析
在TCGA 数据库的基础上应用cBioPortal 数据库分析SMARCA4基因突变情况,8%的NSCLC患者携带SMARCA4基因突变,其中10.3%的肺腺癌患者携带SMARCA4基因突变,5.37%的肺鳞癌患者携带SMARCA4基因突变,突变类型包括错义突变、剪接突变、截短突变等(图3A、B)。进一步分析SMARCA4 基因突变对NSCLC 患者预后的影响,提示含SMARCA4突变的肺腺癌患者OS及无进展生存时间(progression-free survival,PFS)较野生型患者更短,差异有统计学意义(P=0.035,P=0.007,图3C、D);在肺鳞癌中,SMARCA4突变型及野生型患者OS率及PFS率差异无统计学意义(P=0.693,P=0.677,图3E、F)。
2.3 预后生存分析
1.2.2 差异表达分析
进一步对ⅢB~ⅣB 期SMARCA4 基因突变NSCLC 患者进行亚组分析,发现伴随EGFR 基因突变患者1年生存率仍为100%,EGFR野生型患者1年生存率56.2%,EGFR野生型与突变型患者预后差异有统计学意义(P=0.012,图1E)。伴随KRAS基因突变患者1 年内生存率0%,OS(7.8±0.7)个月,KRAS野生型患者1年生存率87.5%,OS(24.9±1.8)个月,合并KRAS突变患者预后较野生型差,差异有统计学意义(P=0.001,图1F)。伴随TP53基因突变与TP53野生型患者的OS差异无统计学意义(P=0.227,图1G)。
运用SPSS 26.0 统计学软件进行数据分析,计量资料用均数±标准误()表示。生存分析采用Kaplan-Meier法绘制生存曲线,Log-rank法进行生存时间的比较。SMARCA4 基因差异表达采用非参数Mann-Whitney 检验分析。P<0.05为差异有统计学意义。
2.4 SMARCA4基因在NSCLC中的生物信息学分析
应用TIMER数据库分析SMARCA4基因差异性表达发现,肺腺癌及肺鳞癌组织中SMARCA4 基因表达水平相比正常肺组织均明显上调(P<0.001,图2A)。利用UALCAN 数据库进一步验证,提示肺鳞癌组织中SMARCA4基因表达水平显著高于癌旁正常肺组织(P<0.05,图2B);肺腺癌组织中SMARCA4基因表达水平同样高于癌旁正常肺组织(P<0.05,图2C)。
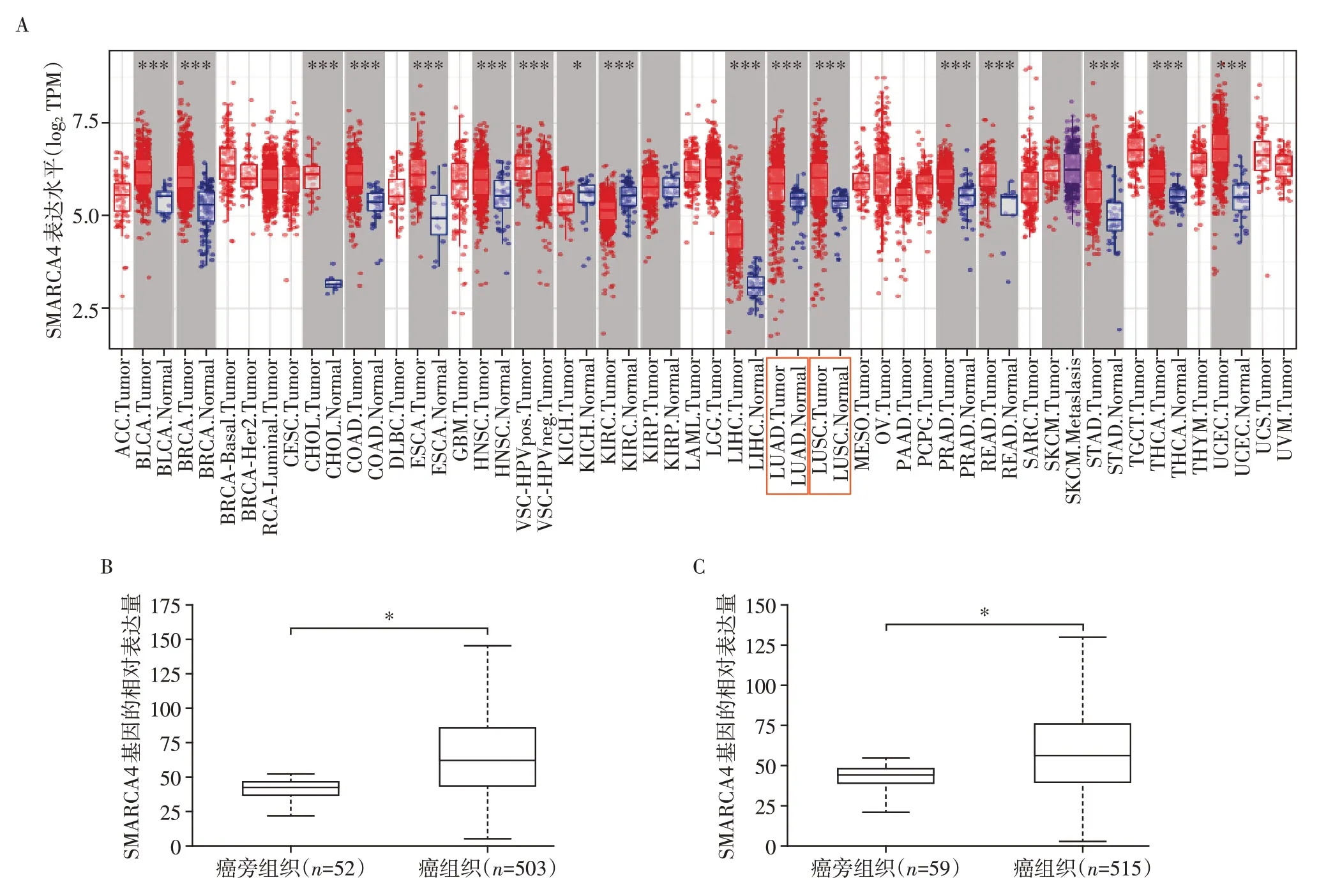
图2 SMARCA4基因在NSCLC中的表达情况Figure 2 Expression of SMARCA4 gene in NSCLC
在35 例含SMARCA4 基因突变NSCLC 患者中进行基因表达谱分析(表1),伴随EGFR 基因突变14例(40.0%);伴随TP53基因突变11例(31.4%);伴随KRAS基因突变4例(11.4%);伴随ERBB2基因突变4例(11.4%);伴随STK11基因突变3例(8.6%);伴随CDKN2A基因突变3例(8.6%);伴随ALK 基因突变2例(5.7%),其余共突变基因包括c-MET、ARID1A、PTEN、FGFR 等(表1)。SMARCA4 基因突变类型包括非同义突变16 例(45.71%),移码突变11 例(31.43%)、非移码突变5例(14.29%)、终止密码子突变2例(5.71%)、剪接突变1例(2.86%)。

图3 SMARCA4基因在NSCLC中的突变分析Figure 3 Mutational analysis of SMARCA4 gene in NSCLC
采用STRING数据库分析与SMARCA4相互作用的蛋白,包括ARID1A、ARID1B、ARID2、CTNNB1、SMARCB1、SMARCC1、SMARCC2、SMARCD3、SMARCE1、TERT 等(P<0.001,图4A)。进一步分析SMARCA4 参与的生物学过程,包括细胞间连接蛋白组装、染色质重塑等(图4B)。
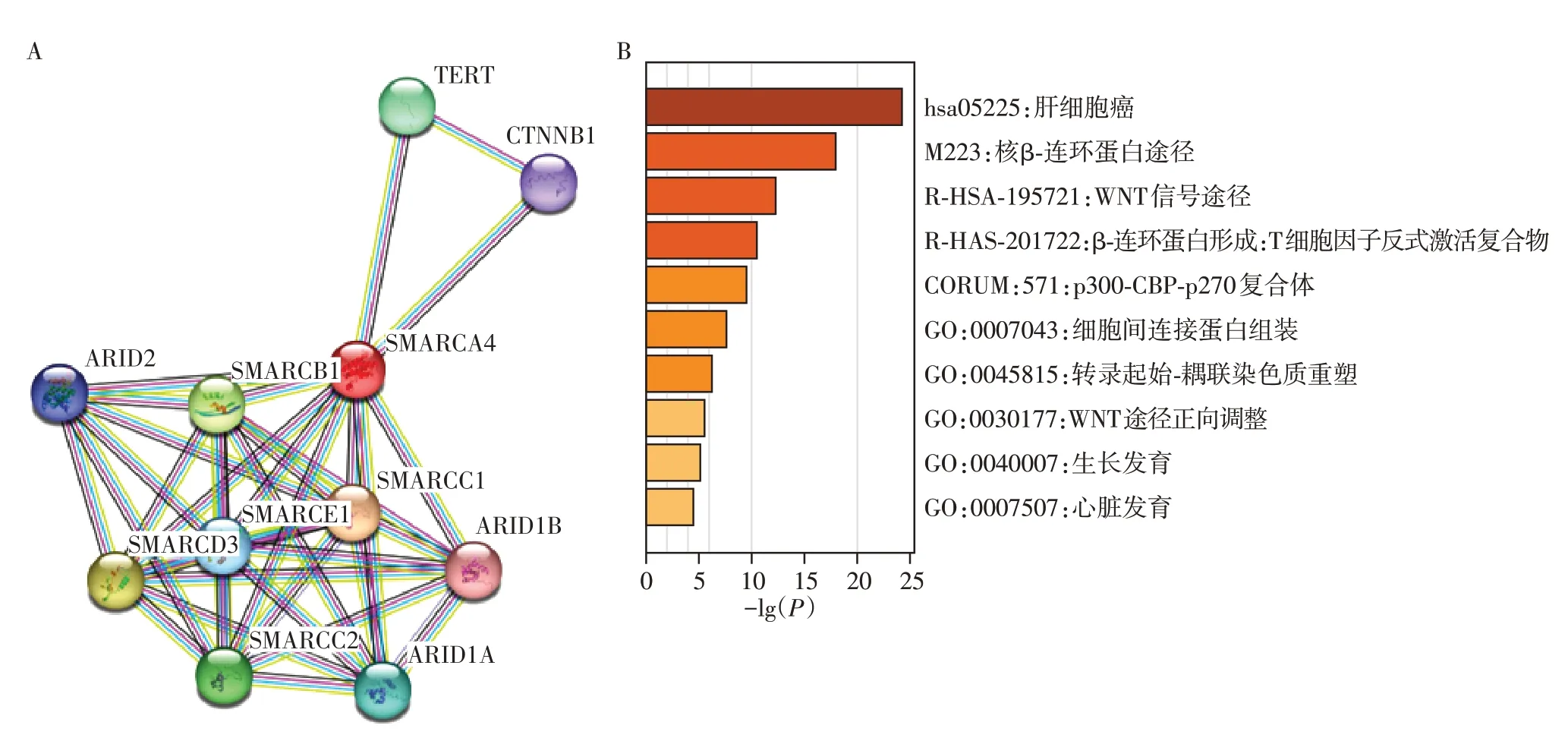
图4 SMARCA4蛋白相互作用网络(A)及SMARCA4蛋白相关生物学功能(B)Figure 4 Protein-protein interaction networks of SMARCA4(A)and SMARCA4-related biological function(B)
3 讨论
SMARCA4 是构成SWI/SNF 染色质重塑复合体的重要亚单位,其组成结构域包括1个ATP酶基团、保守的C 端溴基团、AT-hook 基序和N 端的QLQ、HSA、BRK 结构域。ATP 酶基团高度保守参与水解ATP 提供能量;溴区结构域参与组蛋白H3 和H4 羧基端乙酰化的赖氨酸的识别过程[4]。研究报道SMARCA4 基因突变与膀胱尿路上皮癌、乳腺浸润性导管癌、胃癌、前列腺癌和结肠癌等多种恶性肿瘤发生发展密切相关[5]。SMARCA4 基因在NSCLC中的突变发生率为6%~8%,好发于男性吸烟者,平均年龄65 岁,病理类型以肺腺癌为主,且其纯合缺失、融合或截短突变与蛋白缺失及更高的肿瘤突变负荷紧密联系[6-7]。本研究纳入35例经NGS检测含SMARCA4 突变的NSCLC 患者,男性占65.7%,年龄(64.26±1.70)岁,其中腺癌77.1%,鳞癌11.4%,其他病理类型11.4%,与既往研究结果基本一致。目前关于SMARCA4基因突变及伴随基因的相关报道仍较少。Schoenfeld 等[8]运用NGS 方法检测407 例含SMARCA4 突变的NSCLC 患者,其中56%合并TP53突变,41%合并KEAP1 突变,39%合并STK11 突变,36%合并KRAS 突变。蒋杰等[9]报道66 例有SWI/SNF 复合体亚基突变的NSCLC 患者,发现EGFR、KRAS、ALK 为最常见的伴随突变基因。本研究发现EGFR、TP53、KRAS为常见的伴随突变基因,其中以EGFR频率最高,此结果与既往研究不完全相同。首先,可能是Schoenfeld等[8]研究对象为西方人群,与我国人种存在差异。欧美人群的肺癌基因突变研究显示TP53、KRAS、KEAP1和STK11基因为最常见的突变驱动基因;亚洲人群中EGFR 突变为最主要的驱动基因,占比为50%~60%[10]。其次,本研究及国内研究纳入的SMARCA4 突变患者例数较少,后续需要多中心多样本的深入分析。
如表1所示,模型组和丁酸钠组肠黏膜血流量显著低于对照组(P<0.05、0.01),丁酸钠组肠黏膜血流量显著高于模型组(P<0.05);模型组和丁酸钠组肠黏膜葡聚糖水平显著高于对照组(P<0.05),丁酸钠组肠黏膜葡聚糖水平显著低于模型组(P<0.05)。
光波导谐振腔的自由谱宽FSR(Free SpectrumRange)指的是两个相邻谐振谱的间隔。从相位域上来看相邻谐振谱的间隔等于2π,说明光在光波导谐振腔中的谐振是周期性的,周期为2π。相位域上为2π的自由谱宽对应到频率域上为
最初研究认为SMARCA4为一种抑癌基因。肺BRG1蛋白条件敲除的杂合子小鼠的肿瘤体积明显增加,提示蛋白表达缺失促进了肿瘤发生[11]。在高钙型卵巢小细胞癌和乳腺癌等肿瘤类型中均观察到SMARCA4 缺失促进了肿瘤发生[12-13]。然而近期研究发现SMARCA4基因在不同肿瘤组织中作用不同。在结直肠癌组织中SMARCA4 呈现高表达,且肿瘤细胞增殖及侵袭过程依赖于SMARCA4相关分子途径;SMARCA4 缺失引起结直肠肿瘤细胞自噬缺陷,加速氧化应激损伤[14-15]。在小肠组织中,SMARCA4缺失可抑制Wnt信号通路异常活化,预防肿瘤的发生[16]。由此可见,SMARCA4 可能在不同类型的组织细胞、不同的微环境中扮演致癌基因或抑癌基因角色。目前SMARCA4 突变分为两类,第一类突变包括移码突变、无义突变、基因融合、纯和缺失等,通常引起蛋白表达缺失及功能丧失;第二类突变包括错义突变和拷贝数丢失,可能引起功能异常。SMARCA4突变被认为是晚期NSCLC患者预后不佳的独立危险因素,且含第一类突变的患者预后更差[8]。本研究通过生物信息学分析发现肺腺癌及肺鳞癌组织中SMARCA4 mRNA 含量明显高于正常组织,表明SMARCA4 基因与NSCLC 发生密切相关。预后分析发现含SMARCA4 突变的肺腺癌患者预后较野生型更差,而在肺鳞癌中并未发现SMARCA4 突变与预后的相关性。这种预后相关性的差异可能与肺腺癌及肺鳞癌间的遗传异质性相关。肿瘤测序及生物信息分析提示肺腺癌蛋白质编码区中平均存在7 755 个突变基因,携带非沉默突变基因中位数为105 个;肺鳞癌蛋白质编码区中平均存在11 125个基因突变,携带非沉默突变基因中位数为181 个,推测肺鳞癌具有更高的基因突变频率和更复杂的基因突变种类,因而仅通过一个或少量基因表达水平推测其预后较为困难[17]。
本研究进一步分析了SMARCA4 伴随基因与NSCLC 患者预后的关系,发现伴随EGFR 基因共突变患者与EGFR 野生型相比OS 更长;伴随KRAS 基因共突变患者OS 相比KRAS 野生型患者更短。近期研究发现EGFR 可能是SMARCA4 下游转录的直接靶点,SMARCA4表达水平与EGFR水平呈正相关,SMARCA4突变可能增加了EGFR酪氨酸激酶抑制剂敏感性[14]。这可能是含SMARCA4 与EGFR 共突变患者获得更好预后的原因。Liu 等[18]研究显示在晚期NSCLC 患者中,SMARCA4 合并KRAS 突变患者与野生型患者相比,无病生存期及OS 均更短,原因可能是SMARCA4、KRAS 共同影响肿瘤免疫微环境,诱导肿瘤细胞免疫逃避与免疫抑制。
综上所述,本研究结果表明含SMARCA4 基因突变的NSCLC患者以老年男性为主,常见伴随基因为EGFR、TP53、KRAS等,且伴随基因种类可影响患者预后;进一步生物信息学分析揭示,SMARCA4突变以错义突变为主,携带SMARCA4 突变的肺腺癌患者预后不佳。本研究分析了SMARCA4 突变对NSCLC患者预后的影响,为肺癌的精准化治疗提供了更多依据。
