P波参数与形态对心房颤动及其他心血管疾病的预测作用
2023-11-21郭叶丹刘璐张树龙
郭叶丹 刘璐 张树龙
(大连大学附属中山医院心脏中心,辽宁 大连 116001)
心房颤动(atrial fibrillation,AF)是最常见的心律失常之一,与显著的发病率和死亡率相关,是栓塞性卒中和心力衰竭(heart failure,HF)恶化的危险因素[1]。AF由炎症、心房传导阻滞、纤维化和左心房增大等多因素参与,其进展与心房重构有关,心房间传导异常和传导异质性受损,被认为是AF发展的潜在机制[2]。P波代表心房活动,其特征性的改变揭示了心房激动时间和传导路径的局部变化[3]。因此,利用P波参数及形态学改变,可做到AF的早期预测。现对正常生理条件下可能影响P波的因素进行简要探讨,针对P波与AF预测间的联系机制,人工智能技术下P波的预测价值,以及P波参数对于其他心血管疾病的预测作用做一综述。
1 影响P波参数和形态的因素
2022年发表的P波参数国际指南[4]表示,P波参数包括P波离散度(P-wave dispersion,Pd)、V1导联P波终末电势(P-wave terminal force in lead V1,PTFV1)、房间传导阻滞(interatrial block,IAB)、P波时限、P波电轴(P-wave axis,PWA)、P波面积等,P波参数反映了潜在的心房结构、大小和电激活;这些因素的改变表现为P波参数的异常,且不同情况下P波形态也各异。笔者认为正常生理条件下,P波参数不是维持不变的,心房优势传导径路的改变、激动位置、消融术后肺静脉再连接均可能导致P波形态和参数异常。
心房间传导路径有4条,即Bachamann束、冠状静脉窦附近心房下部肌束、卵圆窝处的穿间隔纤维、毗邻右侧肺静脉的后侧纤维。不同心房间传导路径占主导时,相应地会造成P波时限与形态的改变[5](表1)。其次,脉冲起点变化也可能导致P波改变。如Loewe等[6]证实了P波形态受右心房最早激活部位(the earliest activated site,EAS)的移动及其靠近心房间连接(inter-atrial connection,IAC)的影响,同时还发现PTFV1与二者也存在显著相关性,PTFV1显示出EAS从前/上位置移动到后/下位置的U形过程,附近的EAS导致PTFV1差异为2倍。因此在临床实践中评估PTFV1时应考虑到这一点。而Pezzuto等[7]表示阵发性房颤(paroxysmal atrial fibrillation,PAF)患者P波形态变异性可通过窦房结出口位置的变异性及其周围存在的慢传导区来解释,慢传导区面积越大,P波形态变异性越大。此外,因肺静脉电隔离的异位活动在引发持续性AF中起重要作用,而AF患者消融后复发被认为是其肺静脉和左心房之间电传导的重新连接。Martinez-Mateu等[8]表示消融前后P波的特征变化(包括持续时间、振幅或面积)可用作肺静脉隔离成功的指标,并可用于检测接受AF消融术的患者随访后期肺静脉是否重新连接。Yanagisawa等[9]通过调查PAF初次消融术后有/无肺静脉重新连接患者的P波参数及形态,发现肺静脉再连接组P波最大时限再次显著增加,且会出现新的或延迟的P波切迹。笔者猜测部分P波切迹的形成可能是由于肺静脉和肺静脉结(包括左心房)的心肌套管的激活。因此,消融后P波最大时限无明显变化和无切迹的P波有助于诊断成功的肺静脉隔离,二者组合形成的参数可能进一步增强预测效果。

表1 不同传导路径阻滞组合的P波时限及形态变化
2 P波形态和P波参数与AF
2.1 P波形态与AF
2.1.1 P波低平
Filos等[3]探讨了PAF患者与健康受试者P波形态差异,发现PAF患者心房基质的电不稳定性更高,心房传导模式会改变;并且可仅通过异常的P波形态来预测AF。Rasmussen等[10]提出了一个P波面积/P波时限指数用于反映P波形态,其中小P波面积/P波时限指数表示平坦P波,而大P波面积/P波时限指数表示尖峰短P波;研究发现Ⅱ导联中的小P波面积/P波时限指数可能是心房肌受损和传导时间延长的标志,与AF发生率增加有关。由于低平P波的形成可能源于心房肌纤维化,且与纤维化的严重程度成正相关,因此,笔者认为低平P波可能是心房扩张和纤维化的标志物,能预测AF的发生。
2.1.2 下壁导联双向P波
Skov等[11]表示Ⅱ导联正负双向P波与AF、缺血性卒中和传导障碍的关联性特别强,同时该研究还提出下壁导联双向P波的数量与AF发生风险成正相关。Eranti等[12]基于X、Y和Z导联P波极性,提出一种可评估AF不同风险的正交P波形态。其分3型:1型,P波时限<110 ms;2型,显著V1导联P波末端力相对普遍;3型,最常见的是三度IAB患者(其特征是Ⅱ、Ⅲ和aVF导联P波时限≥120 ms且表现为双向P波形态)。研究发现3型P波与AF住院风险增加高度相关,而1型P波受试者AF住院风险非常低;其中基于不同性别,异常P波形态的患病率不同。
2.1.3 P波宽大及V1导联双向P波
Andlauer等[13]发现左心房扩张导致受试者依赖性P波持续时间(P-wave duration,PWd)延长,二者存在中度相关性;同时发现V1导联的绝对负振幅与左心房向心性肥厚高度相关。但PWd变化在0~2 ms几乎不受左心房壁厚度变化的影响。笔者猜测左心房扩张导致的P波增宽以及由左心房向心性肥厚形成的V1导联双向P波形态,可能成为预测AF的指标。
2.2 P波参数与AF
2.2.1 Pd
Pd通过P波最大持续时间和P波最小持续时间的差值进行量化,研究发现术前高Pd是行冠状动脉旁路移植术患者术后AF的预测因子[14]。在一项接受植入式循环记录仪治疗的隐源性卒中患者的研究中,Marks等[15]表示年龄、舒张功能障碍、房性早搏和Pd升高有助于检测AF风险较高的人群,其中Pd>40 ms是AF唯一独立预测因子。
2.2.2 PTFV1
PTFV1(图1)被评估为V1导联中负向P波振幅和持续时间的乘积,≥4 000 ms×μV则为异常;Lebek等[16]发现异常PTFV1可作为AF一项预测因子,同时使用特定的Ca2+-钙调蛋白依赖性蛋白激酶Ⅱ(Ca2+/calmodulin-dependent protein kinaseⅡ,CaMKⅡ)抑制剂可显著降低AF和PTFV1异常的发生率。其机制考虑为CaMKⅡ是心脏离子维持稳态的关键调节剂和心房电重塑的基础。Wolder等[17]探究了PTFV1组成成分,即V1导联P波终末持续时间(P-wave terminal duration in lead V1,PTDV1)和V1导联P波末端振幅(P-wave terminal amplitude in lead V1,PTAV1)与AF和卒中/短暂性脑缺血发作(transient ischemic attack,TIA)之间的联系,发现PTFV1异常与AF和卒中/TIA的风险增加有关,其中PTDV1的增加与AF和卒中/TIA的发生呈剂量效应关系,而PTAV1与AF之间的关系不太明显。主要原因考虑PTAV1反映了矢量投影,而该矢量投影可因不同的因素发生改变,包括心脏和心电图电极放置的位置等。
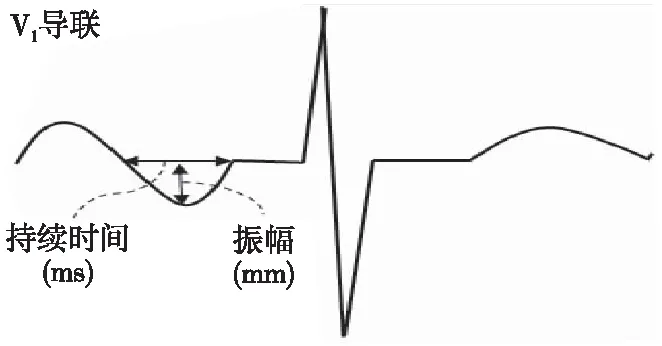
图1 PTFV1示意图
2.2.3 IAB
IAB是描述左右心房间传导延迟的心电图模式,Bachmann束是心房传导最重要的通路,一般认为,IAB的发病机制是Bachmann束部分或完全阻滞。根据阻滞程度不同,可分为一度、二度、三度IAB(表2和图2),其中三度IAB是快速房性心律失常的独立预测因子,与AF、缺血性卒中、认知障碍、痴呆有关。当IAB患者伴有室上性心律失常(如AF)时,称为贝叶综合征,其发生机制考虑高度IAB不仅为折返提供了条件,还与房性早搏发生率增加有关[18]。关于AF与IAB间相互作用,研究[19]表明心房不同步、纤维化和扩张型心肌病均可能导致IAB,最终导致AF,且IAB和AF可能形成一个恶性循环。已证明IAB具有临床预后意义,应进行深入的研究以探讨相关危险因素,更好地定义其与AF的关系。
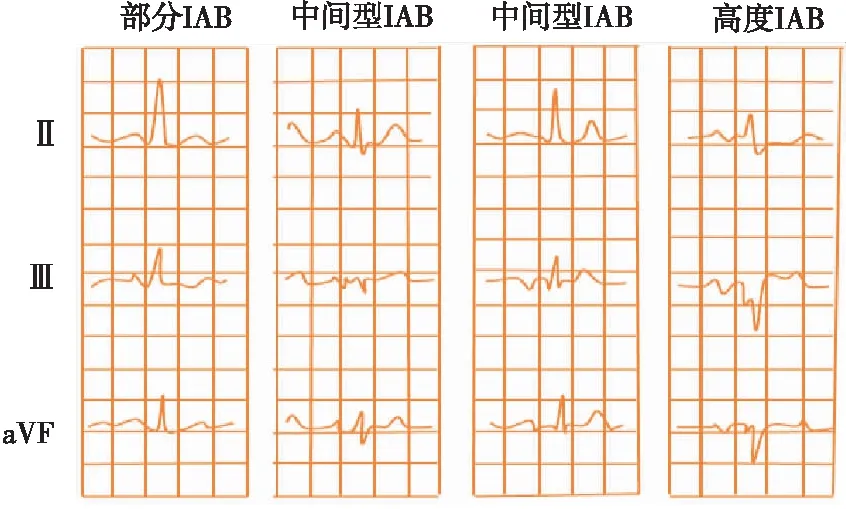
图2 IAB示意图
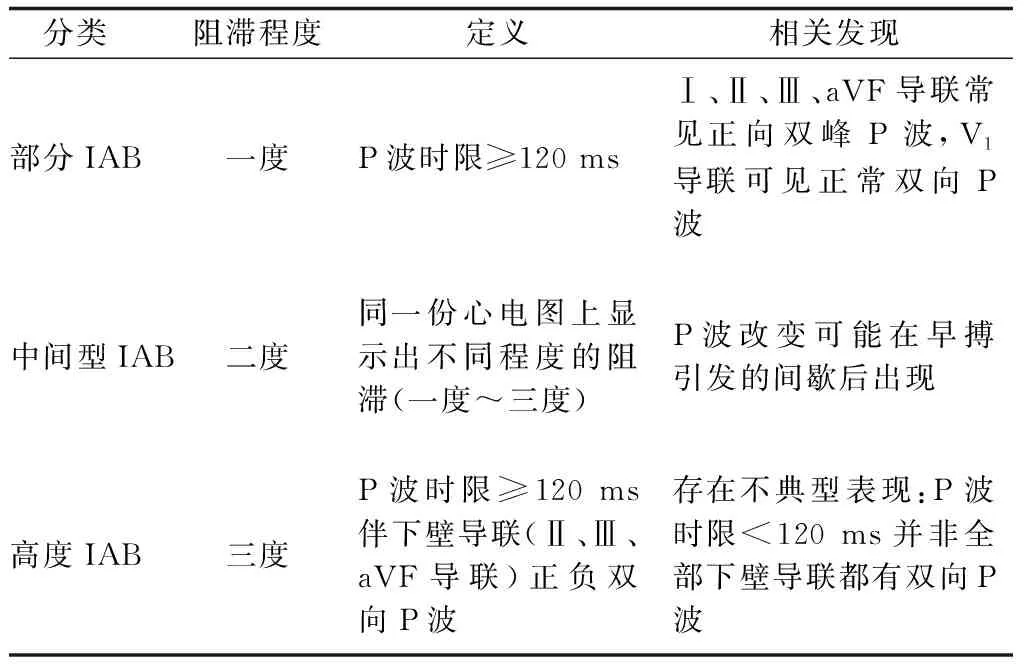
表2 IAB定义及分型
2.2.4 P波时限
目前众多研究认为PWd延长与AF发生有关,那么PWd缩短与AF间是否存在类似效应?Auricchio等[20]评估短P波患者肺静脉隔离后AF的复发率,发现PWd与AF复发显著相关,PWd<110 ms和PWd≥140 ms的患者AF复发风险相对于110~139 ms组增加了近2倍。该研究还提出钠通道电导的增加可能导致PWd明显缩短,这与心房传导速度增加有关,这一新发现背后的机制需进一步探索。
2.2.5 PWA
正常的PWA为0°~+75°,Dhaliwal等[21]发现PWA异常者的AF累积发生率几乎是正常者2倍,且P波左右电轴偏差发生AF的风险相当。一组社区动脉粥样硬化风险的研究[22]表明,19%PWA异常患者会发展为AF,PWA异常者发生AF的可能性是其它因素的2.34倍,随着PWA降低到14°以下或超过55°,AF发生率会明显增加。但存在高度IAB时,由于Ⅱ、Ⅲ和aVF导联中P波呈现正负双向形态,笔者无法计算PWA。关于PWA异常的AF患者并发卒中风险,Maheshwari等[23]对2 229例和700例由不同中心诊断为AF且未行抗凝治疗的患者进行研究,结果提示PWA异常与缺血性卒中风险增加相关(HR=1.84,95%CI1.33~2.55),并显著改善了CHA2DS2-VASc评分的风险预测。由于该研究只涉及美国人群,可能存在种族差异,因而在进入临床实践前,需在不同人群中测试该评分。
3 P波参数结合人工智能
机器学习(machine learning,ML)是人工智能的一个分支,Trayanova等[24]通过归纳ML在电生理和心律失常方面的主要成就,提出应用ML技术有助于心律失常的诊治。以上均是通过传统方法利用P波来预测AF。随着医工结合快速发展,通过ML方法是否可进一步挖掘P波参数对于AF的预测价值呢?此外,卒中作为心血管疾病常见并发症,P波参数结合ML应用于临床是否能有效降低卒中发生率呢?
3.1 AF
由于识别AF的主要挑战是心电图上不突出的P波,Yang等[25]开发了一种信号处理技术——最小弧长均匀相位经验模式分解用于隔离并提取P波,使用了支持向量机、感知器、随机森林和XGBoost4种ML分类器对AF进行分类,结果提示预测AF的ML模型(感知器),其ROC曲线下面积(area under the curve,AUC)最高为0.64;在这些模型中,Ⅱ和V4导联以及V3和V5导联之间P波夹角是最重要的两个特征(夹角越大,AF风险较高),与仅使用P波时限和振幅的模型相比,增加了分类性能(AUC=0.56)。一项单中心回顾性研究[26]采用决策树ML方法,发现二尖瓣狭窄的心房电生理变化可在心电图上检出,年龄、收缩压和V3导联P波面积可预测二尖瓣狭窄患者新发AF事件,V3导联P波面积的最佳截止值为1.45 Ashman单位;使用ML模型改善了预测性能(AUC=0.65)。Ouyang等[27]利用physionet.org数据库,对心电图数据进行滤波处理,提取了P波形态参数(PWd、PWA、Pd等)和心率变异性参数共31个,采用ML进行数据挖掘,结果证实,P波参数对AF患者的心电图有显著影响。因此,未来可通过该研究中确定的P波形态参数再结合ML模型,建立一个可解释的人工智能AF预测模型。
3.2 卒中
目前越来越多的证据支持ML可预测卒中发生。在一项预测二尖瓣反流死亡率和脑血管事件研究[28]中,PWd被证明是卒中最重要的预测因素之一,将其加入到ML模型中有助于预测TIA/卒中和全因死亡率。为了降低AF患者卒中发生率,Wu等[29]利用50例正常人和50例PAF患者的心电图,建立了一个高精度的人工智能模型。特征提取方面,类似于学者Ouyang将P波形态学参数和心率变异性参数结合起来;建模方面,将决策树、k最近邻、人工神经网络和支持向量机4个ML模型一起训练,结果显示P波参数组合改善了模型对AF的早期诊断,可为医生早期介入治疗提供诊断参考,避免卒中发生。
4 P波参数与其他心血管疾病
4.1 致心律失常性右室心肌病
致心律失常性右室心肌病(arrhythmogenic right ventricular cardiomyopathy,ARVC)是一种遗传性心肌病。Baturova等[30]评估了P波参数是否能作为ARVC进展过程中的一项心电图标志物,发现ARVC确诊前,P波参数无异常,而确诊后V1和V2导联P波面积显著减少,异常PTFV1的患病率从开始诊断到随访第15年增加了13%,演变过程中PWd和PWA无变化。前者可通过右心房心肌在疾病进展中的参与来解释,笔者推测,右心房传导异常在影响P波形态的同时,可能会增加P波的初始右心房向量与受影响较小的左心房向量之间的重叠,从而对整个PWd影响最小。
4.2 高血压
高血压能诱发心房重塑并导致传导异常,Aizawa等[31]回顾了高血压与P波参数之间的相关性研究,提出与非高血压组相比,高血压患者P波参数异常更常见。校正年龄,PWd和Pd仍是高血压患者AF复发或新发AF的预测指标;但有效的高血压治疗后异常P波参数可得到纠正。笔者猜测通过治疗高血压来逆转P波参数可能确实与新发AF的发生率降低有关,其中准确测量PWd和Pd至关重要。
4.3 HF
Ostrowska等[32]在探讨P波参数能否预测HF事件的研究中发现,V1导联中的PWd与突发HF之间存在很强的U型相关性,PWd<60 ms时HF风险显著增加,原因可能是心房传导速度增加,与跨膜离子通道或间隙连接的变化有关;但HF与P波振幅和PR间期之间无显著关系。总之,该研究提出短PWd与偶发HF之间的关联是一种新的发现,未来可能有助于HF的早期诊断和预防。对于其他P波参数,Abdellah等[33]提出Pd>40 ms和IAB在HF患者中普遍存在,同时它们与左室射血分数下降、心功能差、住院和死亡率增加相关。笔者认为,将这些心电图参数添加到临床评估中可显著提高对HF发病率和死亡率的预测。
4.4 心肌梗死
一项前瞻性观察性研究[34]提出IAB在ST段抬高型心肌梗死(ST segment elevation myocardial infarction,STEMI)患者中普遍存在,且STEMI患者的IAB可靠地预测了1年后的新发AF;其中弥漫性心肌缺血是导致IAB的主要因素。Demirci等[35]在急性冠脉综合征患者中发现,依据PTFV1的方向可检测左右心房的改变,其对心肌梗死、心房肥大、三支血管病变有一定的预测价值。
通过以上探讨,笔者发现利用P波参数和形态学改变可一定程度地预测AF和其他心血管疾病。此外,临床中还可能存在P波消失的情况,可能是P波真正消失,也可能是P波被藏匿。笔者认为前者考虑窦性停搏、窦房传导阻滞、心房肌异常;后者与异位节律的起源部位及其激动心房、心室的先后顺序有关。总之,P波消失代表激动异常,可能反映了不同的心血管病变。
5 展望
P波与AF密切相关,异常的P波形态和参数可作为早期预测AF发生的指标。相对于传统方法,通过人工智能技术,针对P波参数/指数以及图片的处理,建立诊断模型,可能成为未来预测AF的新模式。对于AF以外的其他心血管疾病,P波参数也可能成为一项独立预测指标。