柔性集成化微针生物传感器研究
2023-11-20马圆圆王秀霞周典法何逸昭周成刚
马圆圆,王秀霞,周典法,魏 钰,何逸昭,周成刚,
(1.中国科学技术大学微电子学院,安徽 合肥 230026;2.中国科学技术大学合肥微尺度物质科学国家研究中心微纳研究与制造中心,安徽 合肥 230026)
0 引 言
随着生活节奏加快和压力增大,人体体内代谢物的不平衡可能会诱发各种生理疾病,因此,监测和管理人体内各种生理指标对健康生活至关重要。葡萄糖(C6H12O6)和酒精(C2H6O)两种物质受人类的生活方式、饮食习惯等影响,在人体内浓度会随人体行为而出现较大的波动,进而引发相关的并发症[1~4]。目前,开发新的传感器以间接形式实时监测人体内葡萄糖和酒精浓度,可以避免传统的采血方式对人类造成痛苦与不便。
人体组织液和汗液与血液具有强相关性[5~7],因此最近几年利用微凸结构检测人体汗液和穿透人体皮肤监测人体组织液内物质受到了广泛的关注。例如:Sharma S 等人利用聚碳酸酯(polycarbonate,PC)材料设计出可以监测人体组织液葡萄糖的微针阵列[8],采用电化学三电极系统,利用葡萄糖氧化酶的催化效果,达到较长时间的监测;Kim J等人采用诱导式汗液检测方法[9],设计出可用于监测人体汗液酒精的无创贴片传感器,主动诱导皮肤分泌汗液再采用常规的电化学三电极系统进行浓度监测;2015年,刘尚等人[10]提出一种空心微针阵列来检测葡萄糖;2016年,刘亮泽等人[11]提出一种单针三电极的动态血糖传感器的研制。以上研究普遍使用硬质材料微针或者更关注于某一种物质的监测。
本文提出一种柔性集成化微针四电极系统。该系统采用的柔性材料在较好地贴合人体皮肤的同时,也可实现穿透人体皮肤监测的目的。2个工作电极分别用于葡萄糖和酒精的检测,1个辅助电极和氯化银(AgCl)参比电极,完成对多种物质的监测。2个工作电极上利用氧化酶的特异性分别催化葡萄糖和酒精,采用电化学沉积普鲁士蓝([Fe(CN)6]3)提高灵敏度,增强抗干扰性,通过壳聚糖将氧化酶固定在铂(Pt)电极表面,然后工作电极最外层滴涂全氟磺酸(Nafion),提高传感器的稳定性和重现性。
1 材料与方法
1.1 传感器工作原理
本文利用生物氧化酶(葡萄糖氧化酶、醇氧化酶)的酶促反应[12]实现对葡萄糖和酒精的电化学检测。葡萄糖在氧化酶的催化下,与氧气(O2)、水反应生成过氧化氢(H2O2)和葡萄糖酸(gluoose-acid),而H2O2又可以与电化学沉积的普鲁士蓝发生氧化还原反应,完成电子的转移,最终可以通过检测电流的大小来反映葡萄糖浓度的变化。同理,酒精在醇氧化酶的催化下生成 H2O2和乙醛(C2H4O),同样以普鲁士蓝为电介质完成检测。具体反应电学方程式如下:
葡萄糖氧化酶催化化学反应式为
酒精氧化酶催化化学反应式为
利用被检测物质的浓度与生成的H2O2量成定量关系,通过H2O2与普鲁士蓝的氧化还原反应,将电荷转移至金属电极表面产生电流信号,电流信号的强弱与催化反应的产物H2O2的浓度成正比,按照反应方程式也就是与被测物质的浓度成正比,其反应原理如图1所示。
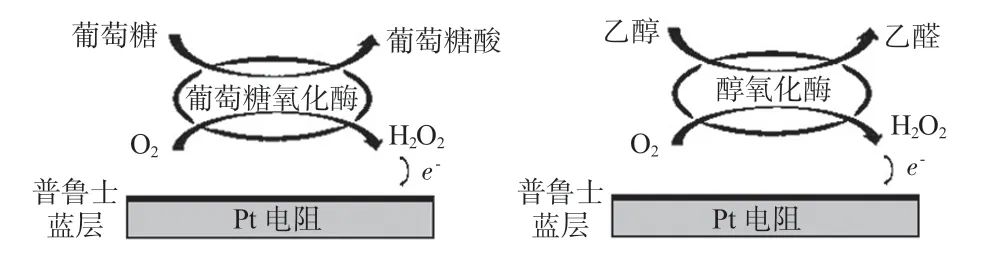
图1 工作电极原理
1.2 传感器设计
设计的聚酰亚胺(polyimide,PI)薄膜上的四电极微针传感系统如图2所示。其中,带有微针的PI基底是经过在特定硅基模具上旋涂液态PI并加热固化后脱模而成,然后对薄膜做特殊表面处理和磁控溅射钛(Ti)/Pt 进行金属图形化,形成2个工作电极、1个辅助电极、1个参比电极的结构,每个电极的有效区域为圆形有微针阵列区域,圆形区域经过一定长度的Ti/Pt 引线引出,连接至外界测试平台。2个工作电极用滴涂法分别依次修饰普鲁士蓝、氧化酶、壳聚糖和Nafion,辅助电极采用Pt 金属,参比电极直接使用AgCl油墨吹涂均匀,同时在AgCl表面修饰Nafion保护电极。
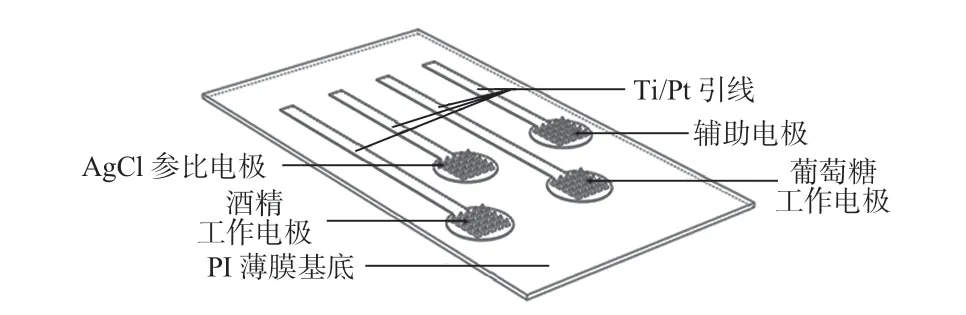
图2 四电极结构示意
2 传感器加工
2.1 硅基底模具加工
首先,选择(100)晶向硅片,采用低压化学气相沉积法沉积200 nm厚的氮化硅(Si3N4),再旋涂光刻胶进行曝光和显影,实现掩模版图形转移至晶圆片上。在反应离子刻蚀设备中,对显影处理后的晶圆片刻蚀,去除未被光刻胶保护的Si3N4。将经过反应离子刻蚀后的晶圆片放入浓度为30%的氢氧化钾(KOH)溶液中,在75 ℃条件下,腐蚀7~8 h,最终,在硅晶圆片上形成阵列式的金字塔凹槽。腐蚀后的晶圆片先用异丙醇(C3H8O)和去离子水进行超声清洗,再用氮气(N2)吹干表面,然后用等离子体增强化学气相沉积设备在干燥后的晶圆片上沉积200 nm 厚的氧化硅(SiO2),用于模具表面亲水性处理。
2.2 微针薄膜加工
称量定量液态PI,在加工好的硅基模具上旋涂和加热固化,设置的旋涂程序参数为:转速200 r/min 下持续时间10 s,转速300 r/min下持续时间30 s,将旋涂后的硅基模具水平静置1 h。静置足够时间后加热固化,设置的加热程序参数为:80 ℃下维持40 min,120 ℃下维持30 min,150 ℃下维持30 min,200 ℃下维持20 min,250 ℃下维持15 min。固化后冷却脱模。
2.3 四电极系统加工
将固化后的微针薄膜剪裁成合适的大小,磁控溅射镀金属之前必须用氧等离子气体处理薄膜表面,使用激光加工的硅质硬掩模完成金属的图形化,具体硅质硬掩模形状如图3(a)所示。首先,将薄膜样品固定在磁控溅射样品基板上,再将硅质掩模紧贴在薄膜之上,4 个微针阵列分别对应于硅质掩模的4个圆形区域,磁控溅射工艺参数如下:首先镀1层10 nm Ti作为黏附层,再镀100 nm的Pt作为电极表面金属,从而实现四电极系统工作区域和引线区域,如图3(b)所示。

图3 硅质掩模和金属图形化后样品实物
2.4 工作电极和参比电极修饰
采用电化学沉积法分别对2个工作电极区域进行普鲁士蓝介电层的沉积。首先,在普鲁士蓝沉积溶液(2.5 mmol/L FeCl3+ 2. 5 mmol/L K3[Fe(CN)6]+0.05 mol/L HCl+0.1 mol/L KCl)中,采用I-t法完成对普鲁士蓝的沉积,沉积电压为0.6 V,沉积时间为200 s,灵敏度设置为0.001。
普鲁士蓝沉积后,需要在普鲁士蓝稳定溶液(0.1 mol/L HCl+0.1 mol/L KCl)中稳定,采用循环伏安(cyclic voltammetry,CV)法完成对普鲁士蓝的稳定,最高电压设置为0.35 V,最低电压设置为-0.05 V,扫描速度设置为0.05 V/s,循环周期设置为40,灵敏度设置为0.001;之后,将薄膜样品100 ℃下烘烤1 h。
烘烤后的薄膜样品冷却至室温后,在2 个工作电极区域分别进行不同生物酶的修饰。在葡萄糖工作电极区域,首先根据工作区域面积大小滴涂10 μL 的葡萄糖氧化酶(0.02 mg/μL),6 ℃下干燥5 h,再滴涂10 μL 质量分数1%的壳聚糖溶液,6 ℃下自然过夜干燥,最外层再滴涂10 μL Nafion溶液(质量分数0.5%)作为选择性离子透过膜,6 ℃下自然干燥3 h,葡萄糖工作电极修饰完成。
对酒精工作电极区域也是采用滴涂法,首先滴涂4 μL的乙醇氧化酶,6 ℃下自然干燥4 h,再滴涂4 μL 的壳聚糖溶液,6 ℃下自然干燥过夜,最后再滴涂10 μL Nafion溶液,6 ℃下自然干燥3 h。2个工作电极修饰完成。
AgCl参比电极直接使用AgCl 油墨涂敷在Pt 金属表面,移液器吸取一定量的油墨滴涂在参比电极区域,用N2喷枪将油墨均匀吹开,完全覆盖住圆形区域和微针阵列,然后120 ℃下烘烤1 min。薄膜冷却后再滴涂10 μL Nafion溶液(质量分数0.5%),6 ℃下自然干燥3 h。
图4(a)为磁控溅射镀Ti/Pt金属后的圆形区域的微针阵列,阵列为5 ×5 金字塔阵列,微针形状可为金字塔形微针或棱台,可根据实际需求改变微针的形状和密度。图4(b)为修饰后的工作电极区域内微针表征,在微针表面依次进行沉积普鲁士蓝、滴涂氧化酶和壳聚糖、修饰Nafion,扫描电子显微镜(SEM)表征结果显示修饰物覆盖和固定效果良好。

图4 微针阵列SEM图
3 传感器测试
3.1 对H2O2 的线性响应
将采用I-t沉积的普鲁士蓝微针传感器浸入一定量的磷酸缓冲液(phosphatic buffer solution,PBS)溶液(0.05 mol/L磷酸氢二钾(K2HPO4)+0.05 mol/L磷酸二氢钾(KH2PO4)+0.1 mol/L氯化钾(KCl)),辅助电极之间加0.6 V 电压,等到电流稳定后开始测试。普鲁士蓝对不同浓度H2O2的响应曲线如图5 所示,在ORIGIN 中对测试数据进行线性拟合,可得到线性拟合方程为Y=14.99 +9.35X,校正决定系数R2=0.981 6,灵敏度为9.35 μA/(mmol·L-1),线性范围为0 ~28 mmol/L。说明沉积的普鲁士蓝介电层对H2O2具有良好的线性响应,可以有效检测酶催化葡萄糖或酒精后生成的H2O2。
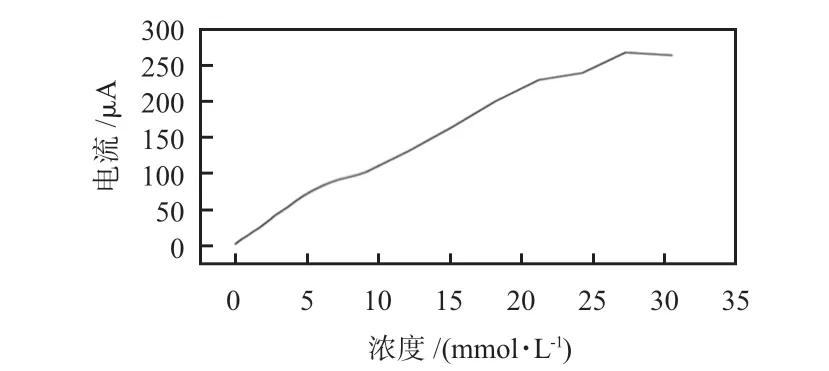
图5 裸普鲁士蓝电极对H2O2 响应曲线
3.2 浓度响应时间测试
将修饰氧化酶的传感器浸入一定量的PBS 溶液中,在酒精工作电极和参比电极之间加0.6 V 电压,初始的PBS溶液中酒精浓度为12 mmol/L,等测试电流稳定之后,如图6(a)所示,在150 s左右滴加一定量的0.5 mol/L酒精标定液,待溶液扩散稳定后,此时浓度迅速变成14 mmol/L。计算出加入酒精标定液到最终电流稳定所需要的时间,约为27 s。
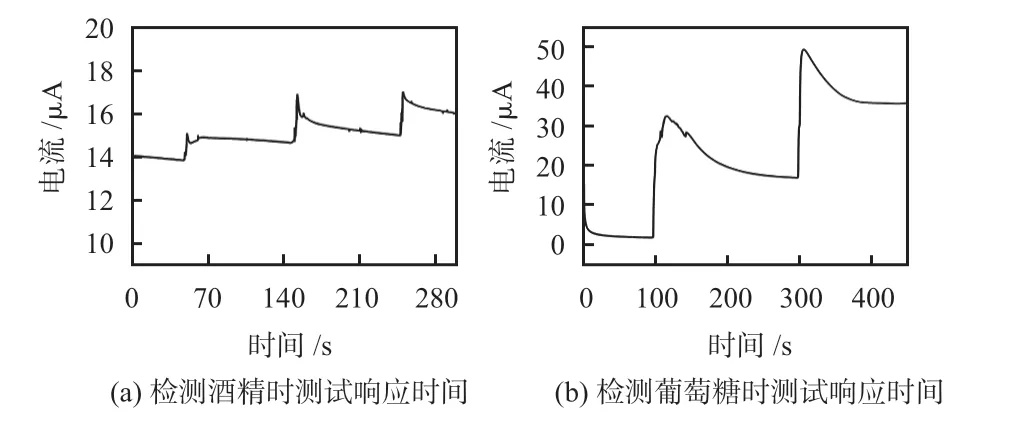
图6 传感器响应时间曲线
同样的条件下,在葡萄糖工作电极和参比电极之间加0.6 V电压,溶液初始葡萄糖浓度为2 mmol/L,然后向PBS溶液中滴加定量的葡萄糖标定液,溶液中葡萄糖浓度迅速提高到4 mmol/L,根据测试结果图6(b)所示,葡萄糖传感器的响应时间约为47 s。
3.3 浓度响应台阶测试
设置传感器不同响应台阶之间的时间间隔大于传感器的响应时间。将微针传感器浸入PBS 溶液中,在传感器的工作电极和辅助电极之间加0.6 V 电压,在一定的时间间隔下,向PBS溶液中滴加一定浓度的待测物质,从而测试出不同浓度下的电流台阶变化。每隔100 s向PBS溶液中滴加待测液(葡萄糖或酒精),溶液中待测液的浓度梯度为每次变化2 mmol/L,最终测试得到图7所示的台阶响应曲线。
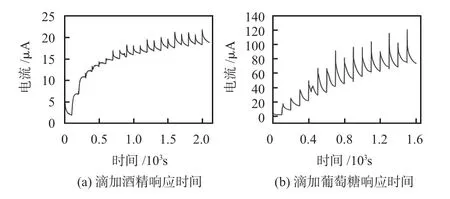
图7 浓度台阶响应曲线
酒精工作电极在滴加16次后不再出现明显台阶变化,其线性范围为0~32 mmol/L,葡萄糖工作电极在滴加12 次后不再出现明显台阶变化,其线性范围为0~24 mmol/L,2种工作电极的台阶范围足够覆盖一般人体中酒精和葡萄糖的浓度变化范围。
3.4 线性范围和传感器灵敏度测试
测试采用I-t法,每个浓度下,测试时间为100 s,记录最终稳定的电流值,将酒精工作电极和葡萄糖工作电极测试结果进行线性拟合,如图8 所示。传感器对酒精的线性拟合方程为Y=0.49X+8.18,校正系数R2=0.918,传感器零位为8.18 μA,灵敏度为0.49 μA/(mmol/L),线性范围为32 mmol/L,其检出限(limit of detection,LOD)为4.016 mmol/L;传感器对葡萄糖的线性拟合方程为Y=3.27X+2.88,校正系数R2=0. 996,传感器零位为2.88 μA,灵敏度为3. 27 μA/(mmol/L),线性范围为24 mmol/L,其LOD为0.134 mmol/L。
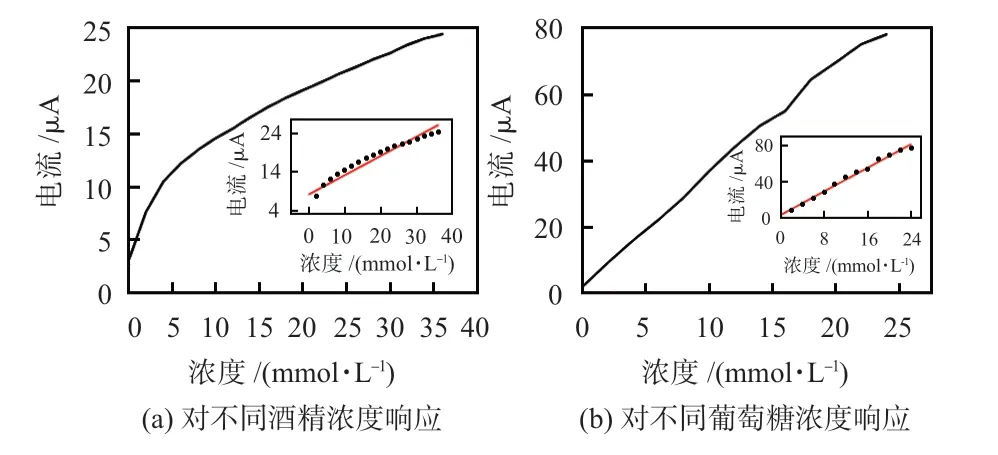
图8 传感器响应曲线
3.5 抗干扰性测试
在初始PBS溶液中加入一定量的尿酸和抗坏血酸,使得每次测量保证尿酸浓度为500 μmol/L,抗坏血酸浓度为0.14 mmol/L,这两者均高于人体正常值,在测试酒精抗干扰时加入一定量葡萄糖使得溶液中葡萄糖浓度为5 mmol/L;同理,在对葡萄糖抗干扰时加入酒精使得溶液中酒精浓度为5 mmol/L,测试结果如图9所示,随着被测物质浓度的增加,干扰物所带来的电流变化影响越来越小,减小趋势明显。整体的测试结果表明:传感器在对酒精和葡萄糖测试时具有较好的抗干扰能力。
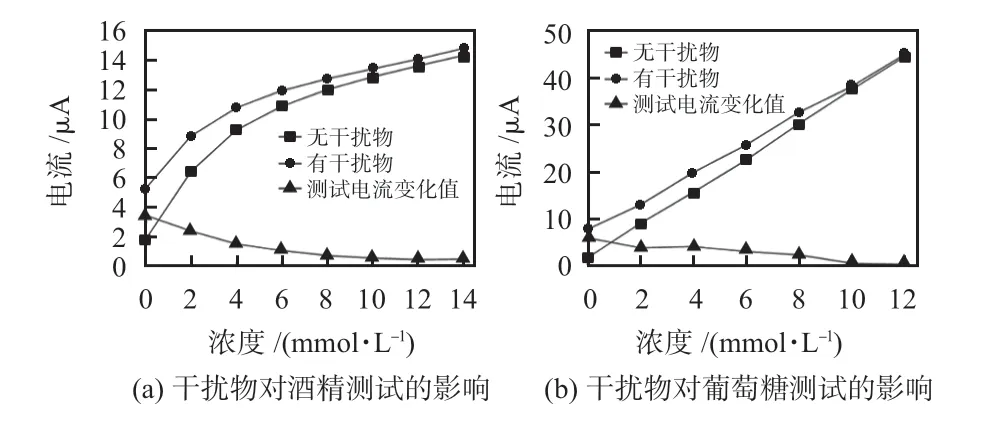
图9 干扰物对传感器的影响曲线
3.6 微针阵列穿透性测试
PI具有良好的生物相容性,同时具有较强的机械强度和弹性模量,其中,机械强度和弹性模量与PI 溶液加热固化工艺有关,本文上述提到的加热固化工艺加工的微针阵列可以满足穿透仿人体皮肤的要求。仿人体皮肤穿透实验是研究微针插入特性的重要手段,仿人体皮肤克服了生物皮肤的局限性,如昂贵的成本、新鲜人体皮肤样本的有限可用性、安全卫生问题,采用8 层Parafilm®M(PF)膜作为类人体皮肤进行插入测试[13,14]。将传感器用手指、大拇指轻轻按压进PF膜中,然后在SEM 中表征微针阵列的插入情况。因为微针是角度已知的四棱锥,可以根据插入的创口正方形边长估算出插入PF 膜的深度,计算得出微针阵列平均插入深度135 μm左右,此深度微针阵列完全可以穿透人体皮肤角质层监测人体组织液成分变化,同时不会带来明显的痛觉。
4 结 论
本文设计并实现的新型柔性微针生物传感器,通过半导体工艺完成硅基底处理、微针薄膜加工、化学生物修饰和体外仿人体测试研究,所有测试结果均是通过大量实验获得,其中传感器打破传统的电化学三电极系统,以分时监测,共用辅助电极和参比电极的方式设计出四电极系统,以微针阵列结构增加了监测汗液的传感面积和实现穿透人体角质层监测组织间液,传感器工作电极区域修饰的氧化酶也同时被壳聚糖和Nafion固定并保护。传感器对酒精和葡萄糖的线性范围大,灵敏度较好,同时具有良好的抗干扰能力,不同样品之间具有良好的重现性和稳定性,在适应于长时间监测人体生理变化的难题上具有极大的应用前景。
