奇亚籽胶提取工艺优化及其理化性质
2023-11-20刘树萍陆家慧张佳美彭秀文苏晓文石长波
刘树萍,陆家慧,张佳美,彭秀文,苏晓文,石长波
(哈尔滨商业大学 旅游烹饪学院,黑龙江 哈尔滨 150028)
植物种子是重要的食物来源,富含膳食纤维和人体所必需的脂肪酸。奇亚籽为西班牙鼠尾草的种子,属于唇形科,常产于南美和澳大利亚等热带地区[1],具有较高的营养价值和食用价值,已有大量研究报道其在食品、药品领域的应用[2]。奇亚籽胶(chia mucilage,CM)是一种阴离子杂多糖,当奇亚籽浸没于水溶液时,其表皮细胞外的细胞壁会释放出高黏度的奇亚籽胶溶液,与水充分接触后,种粒上会附着透明溶胶状物[3]。这些黏液牢固地附着在种子上(主要存在于种皮和相邻层中,部分交联或结合在种子表面),增加了提取的困难程度[4]。研究表明,不同的提取手段与参数会影响奇亚籽胶的化学组成,从而影响其功能特性[5]。本研究以奇亚籽为原料,通过水提法提取奇亚籽胶,确定其最优提取工艺,并对其理化性质进行表征,为奇亚籽胶的提取及潜在应用开发研究提供理论参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
奇亚籽:广州双诚食品有限公司;氢氧化钠、盐酸、硫酸、硫酸铜、硫酸钾、石油醚、乙醇、乙酸乙酯:天津市天力化学试剂有限公司;亚甲基蓝指示剂、甲基红指示剂:天津市光复精细化工研究所;蒽酮:上海源叶生物科技有限公司。以上试剂均为分析纯。
1.1.2 仪器与设备
电热恒温水浴锅(DK-98-Ⅱ):天津市泰斯特仪器有限公司;电动搅拌器(JJ-1):国华(常州)仪器制造有限公司;冷冻干燥机(FD-1A-80):北京博医康实验仪器有限公司;均质机(T25):上海珂淮仪器有限公司;pH 计(FE28)、高速离心机(L535-1)、水分测定仪(he/8302):梅特勒-托利多仪器(上海)有限公司;全自动凯式定氮仪(K9860):济南海能仪器股份有限公司;数字式黏度计(NDJ-5S):上海精天电子仪器有限公司;索式提取器(SZF-06A):浙江托普仪器有限公司;石墨消解仪(SH220N):山东海能科学仪器有限公司;紫外分光光度计(MAPADA):上海元析仪器有限公司;傅里叶红外光谱仪(Nicolet iS 20):赛默飞世尔科技(中国)有限公司。
1.2 试验方法
1.2.1 奇亚籽胶提取工艺流程
参考Timilsena 等[6]的方法并稍作修改,称取10 g奇亚籽溶于对应料液比的蒸馏水中,使用0.1 mol/L 的NaOH(或HCl)溶液调节pH 值,密封并在恒温水浴锅中于对应的温度和时间下充分浸润奇亚籽。使用电动搅拌器在不同时间下匀速(40×g)搅拌奇亚籽水溶液,然后室温条件下将水溶液400×g 离心30 min,通过18 目筛分离黏液。将分离出的上清液再400×g 离心10 min,取出上清液,置于干燥盘,-24 ℃冷冻48 h。冷冻干燥机冻干24 h,使用研磨钵充分研磨直至碾成均匀的粉末,于4 ℃密封存储。
1.2.2 奇亚籽胶提取工艺单因素试验
选取试验固定的单因素:料液比1∶30(g/mL)、浸提温度80 ℃、搅拌时间120 min、pH7.0,以奇亚籽胶得率为指标,探究料液比[1∶10、1∶20、1∶30、1∶40、1∶50(g/mL)]、浸提温度(60、70、80、90、100 ℃)、搅拌时间(80、100、120、140、160 min)、pH 值(5.0、6.0、7.0、8.0、9.0)对奇亚籽胶提取率的影响。
1.2.3 奇亚籽胶提取工艺的响应面优化试验
根据单因素试验结果,选取对奇亚籽胶得率影响较大的3 个因素(料液比、提取温度、pH 值)进行响应面优化试验,采用Design-Expert 8.0.6 软件,设计三因素三水平试验,中心点重复5 次,响应面试验因素与水平见表1。
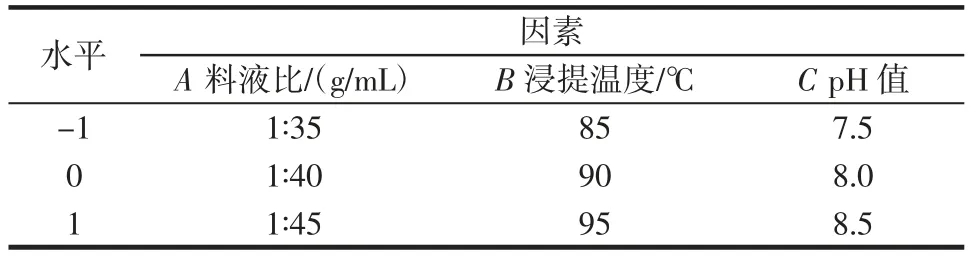
表1 响应面试验因素与水平Table 1 Variables and levels of response surface methodology
1.2.4 奇亚籽胶得率的计算
奇亚籽胶得率(W,%)计算公式如下。
式中:m1为奇亚籽质量,g;m2为奇亚籽胶冻干粉质量,g。
1.2.5 水分含量的测定
精确称取0.5 g 奇亚籽胶样品均匀铺在样品盘中,利用水分测定仪测定奇亚籽胶的水分含量。
1.2.6 蛋白质、脂肪以及灰分含量的测定
参照GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》中的方法检测奇亚籽胶蛋白质含量;参照GB 5009.6—2016《食品安全国家标准食品中脂肪的测定》中的方法检测奇亚籽胶脂肪含量;依据GB 5009.4—2016《食品安全国家标准食品中灰分的测定》中的方法检测奇亚籽胶灰分含量。
1.2.7 总糖含量的测定
采用蒽酮比色法测定奇亚籽胶的总糖含量,参考Tian 等[7]的方法稍作修改。将奇亚籽胶溶于水,然后以体积比为1∶13 与乙醇混合,4 ℃过夜保存。混合物在室温下4 000×g 离心10 min。然后滤去上清液,将沉淀溶解、冻干后得到奇亚籽粗多糖。
标准曲线的制备:配制0.2、0.4、0.5、0.6、0.7 μg/mL葡萄糖标准溶液分别放入试管中,用蒸馏水稀释至10 mL。然后向每管中分别注入1 mL 葡萄糖稀溶液和4 mL 0.2%蒽酮-硫酸溶液。然后将各溶液于80 ℃恒温水浴10 min,取出冷却后在620 nm 波长处测定吸光度。以葡萄糖浓度(μg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线(y=0.003 3x+0.167 4,R2=0.998 3)。
1.2.8 乳化活性和乳化稳定性的测定
参考徐洁茹等[8]的方法略作修改,将0.15 g 奇亚籽胶粉末充分溶于15 mL 磷酸盐缓冲溶液(0.1 mol/L,pH7.0)中,分别加入5.0、7.5、10.0 mL 大豆油作为分散相,在16 000 r/min 下均质5 min,取100 μL 静置0、10 min的乳液底层样品加入到10 mL 的0.1% 十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液中,振荡直至混匀,利用紫外分光光度计在500 nm 波长处测定稀释后的乳液的吸光度。乳化活性(E,m2/g)计算公式如下。
式中:E 为单位质量多糖的乳化表面积,m2/g;2 为平均散射系数;2.303 为比例系数,A500为稀释乳液在500 nm 处的吸光度;D 为乳液在0.1%SDS 溶液中的稀释倍数;ρ 为样品溶液中多糖的质量浓度,10 000 g/m3;φ 为油相在乳液中所占比例,0.25;L 为比色皿的光径,0.01 m。
乳化稳定性(B,%)计算公式如下。
式中:B 为乳液静置10 min 后的乳化稳定性,%;E1为0 min 时的乳化活性,m2/g;E2为10 min 时的乳化活性,m2/g。
1.2.9 持水力和持油力的测定
参考周士琪[9]的方法稍作修改,称取0.1 g 样品,置于20 mL 蒸馏水或玉米油(玉米油密度为0.92 g/mL)中,使用磁力搅拌器搅拌1 h,随后在室温条件下放置过夜以确保其充分溶解,然后将悬浮液以3 000×g 离心30 min,测量上清液的体积。持水力(C,%)和持油力(O,%)的计算公式如下。
式中:C 为持水力,%;O 为持油力,%;m1为蒸馏水中溶胀样品的质量,g;m2为玉米油中溶胀样品的质量,g;m0为干燥样品的质量,g。
1.2.10 溶解度的测定
参考Mirhosseini 等[10]的方法稍作修改,将20 mL不同浓度(0.2%、0.4%、0.6%、0.8%、1.0%)的奇亚籽胶悬浮液分别置于25、40、60、80 ℃水浴锅中搅拌30 min。然后在室温下于2 000×g 离心15 min,将上清液烘干过夜后称量。溶解度(S,%)的计算公式如下。
式中:S 为溶解度,%;m1为初始质量,g;m0为最终质量,g。
1.2.11 起泡性和起泡稳定性的测定
起泡性的测定参照Muñoz Hernández[11]的方法稍作修改。以酪蛋白酸钠(sodium caseinate,SC)为参考,配制不同浓度的奇亚籽胶悬浮液在室温下10 000 r/min均质10 min,记录静置0、30 min 的泡沫体积,起泡性(F,%)和起泡稳定性(T,%)计算公式如下。
式中:F 为起泡性,%;T 为起泡稳定性,%;Vs为溶液初始体积,mL;V0为0 min 时泡沫的体积,mL ;V30为30 min 时泡沫的体积,mL。
1.2.12 傅里叶红外光谱测定
参考Goh 等[12]的方法稍作修改,将奇亚籽胶冻干粉在去离子水中水合2 h,然后在培养皿中于60 ℃干燥48 h,获得薄膜。然后用透射模式对干燥膜的特定官能团进行分析表征。测定波长为4 000~500 cm-1,扫描次数为3,分辨率为4 cm-1。
1.3 数据处理与分析
使用SPSS 软件对所得数据进行分析,采用Origin 2019 作图,试验结果均以平均值±标准差表示,所有试验均做3 次平行。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 料液比对奇亚籽胶得率的影响
图1 为料液比对奇亚籽胶得率的影响。
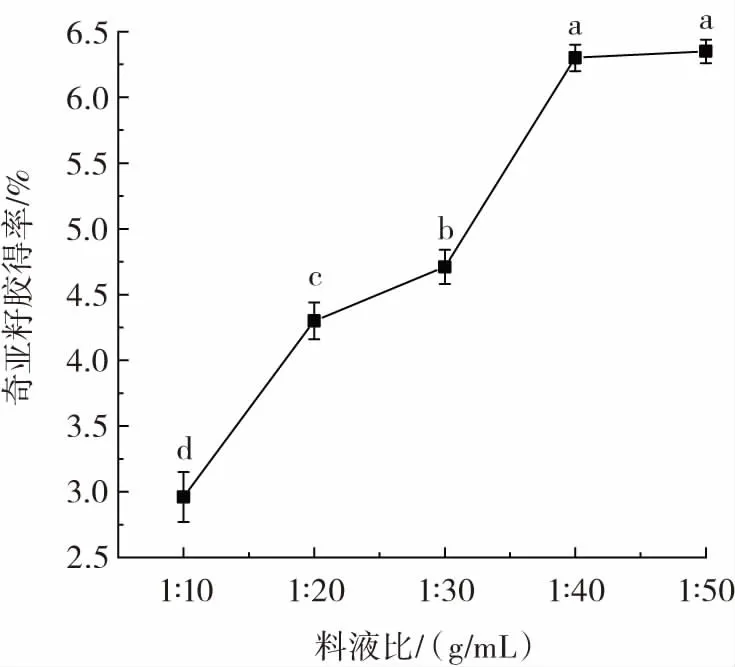
图1 料液比对奇亚籽胶得率的影响Fig.1 Effect of solid-liquid ratio on extraction rate of chia mucilage
从图1 中可以看出,料液比对奇亚籽胶得率的影响较大。在相同的工艺条件下,当水溶液较少时,奇亚籽未能充分与水交互从而导致奇亚籽胶无法析出[13],因此在料液比为1∶10(g/mL)时,奇亚籽胶得率最低,为2.95%。此后,随着溶剂体积的增加,奇亚籽胶得率也随之增长,当料液比达到1∶40(g/mL)后,奇亚籽胶得率增长趋于平缓,说明在该条件下奇亚籽胶的析出达到饱和,这是由于增大了料液比会对奇亚籽产生更大的细胞外渗透压[14],影响了其细胞破裂程度,从而使奇亚籽胶得率提升。当料液比为1∶50(g/mL)时,奇亚籽胶得率最高,为6.35%,但该条件下耗水量较多,干燥时间过长,提取效率低,且奇亚籽胶得率较料液比1∶40(g/mL)无显著差异(P>0.05),因此选择料液比1∶40(g/mL)为最佳提取参数。
2.1.2 浸提温度对奇亚籽胶得率的影响
图2 为浸提温度对奇亚籽胶得率的影响。
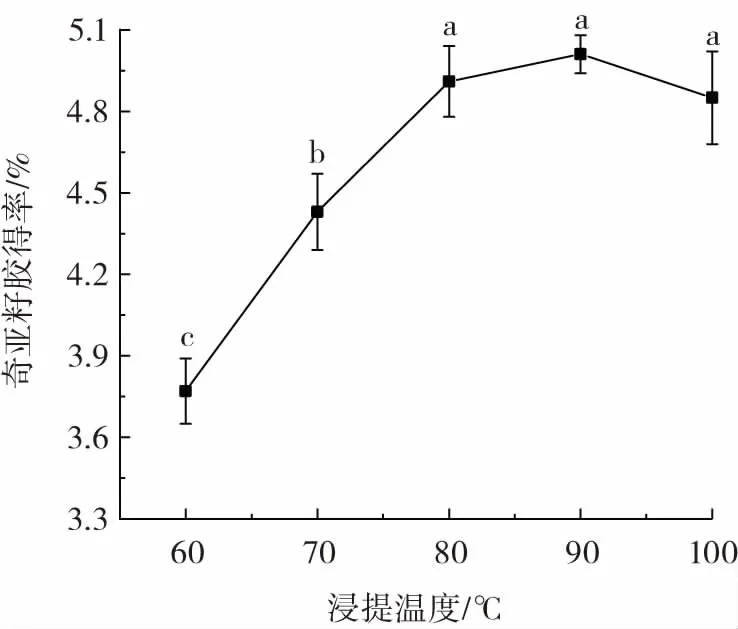
图2 浸提温度对奇亚籽胶得率的影响Fig.2 Effect of leaching temperature on extraction rate of chia mucilage
从图2 中可以看出,当浸提温度从60 ℃升高至90 ℃时,奇亚籽胶得率保持明显增加趋势,浸提温度90 ℃时,奇亚籽胶得率达到最高(5.01%)。说明在较高的温度下奇亚籽种子中充分释放奇亚籽胶,这是因为随着温度升高,与种子相连的黏液黏度降低,同时奇亚籽胶的溶解度和其中的水溶性多糖在细胞壁中的传质速率也随之增长[15],因此在较高的温度下奇亚籽胶可以有效地溢出。当浸提温度超过90 ℃时,奇亚籽胶得率降低,可能是温度过高加剧了奇亚籽胶分子中糖苷键的断裂[16],使后续处理过程中奇亚籽胶得率降低。因此选择最佳浸提温度为90 ℃。
2.1.3 搅拌时间对奇亚籽胶得率的影响
图3 为搅拌时间对奇亚籽胶得率的影响。
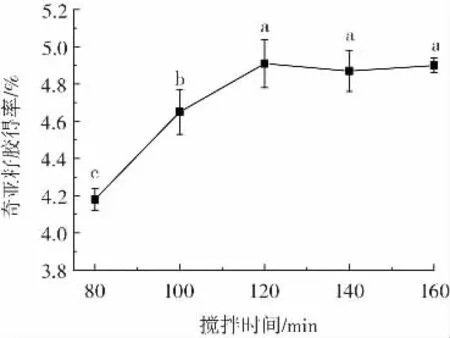
图3 搅拌时间对奇亚籽胶得率的影响Fig.3 Effect of stirring time on extraction rate of chia mucilage
从图3 中可以观察到,随着搅拌时间延长,奇亚籽胶得率整体呈增长趋势,当搅拌时间为80~120 min时,奇亚籽胶得率显著增加(P<0.05),当搅拌时间超过120 min 后,奇亚籽胶得率略有下降但趋于平稳,说明在该条件下,奇亚籽胶已被全部剥离。奇亚籽胶得率下降的原因可能是随着搅拌时间的延长,产生的杂质与奇亚籽胶相互吸附或者竞争溶剂。因此选择最佳搅拌时间为120 min。
2.1.4 pH 值对奇亚籽胶得率的影响
图4 为pH 值对奇亚籽胶得率的影响。
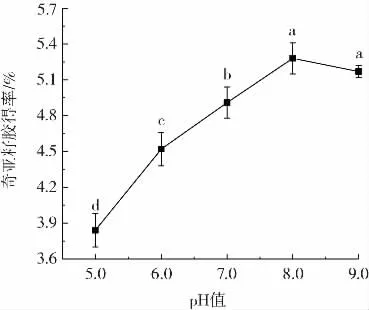
图4 pH 值对奇亚籽胶得率的影响Fig.4 The effect of pH value on extraction rate of chia mucilage
从图4 中可以观察到,随着溶液pH 值的增加,奇亚籽胶得率呈现先上升后下降的趋势,说明碱性环境较酸性环境更能促进奇亚籽胶的析出,对于这种现象尚未有直接的解释。但奇亚籽胶在碱性较高的条件下可能会发生降解[17],因此当pH 值大于8.0 时,奇亚籽胶得率降低。最终选择的最佳pH 值为8.0。
2.2 奇亚籽胶提取的响应面优化试验结果与分析
2.2.1 回归方程的建立
响应面试验设计及结果见表2。
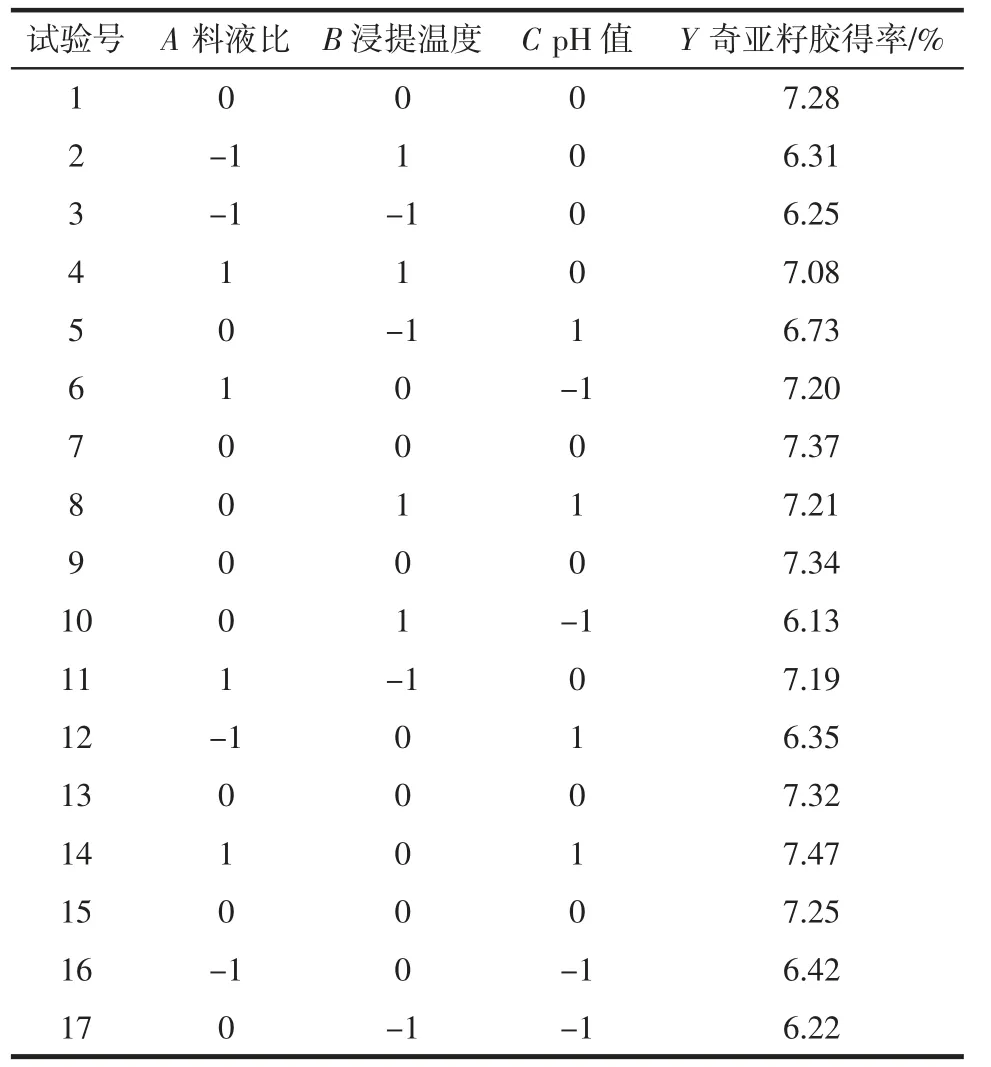
表2 响应面试验设计及结果Table 2 Response surface experimental design and results
如表2 所示,以料液比(A)、浸提温度(B)、pH 值(C)为自变量,奇亚籽胶得率为响应值(Y),进行响应面优化试验。利用Design-Expert 软件对表2 数据进行多元回归拟合,得到二次多项回归模型:Y=7.31+0.45A+0.22B+0.021C+0.092AB+0.14BC-0.16A2-0.34B2-0.4C2。
2.2.2 回归模型的方差分析
回归模型方差分析见表3。
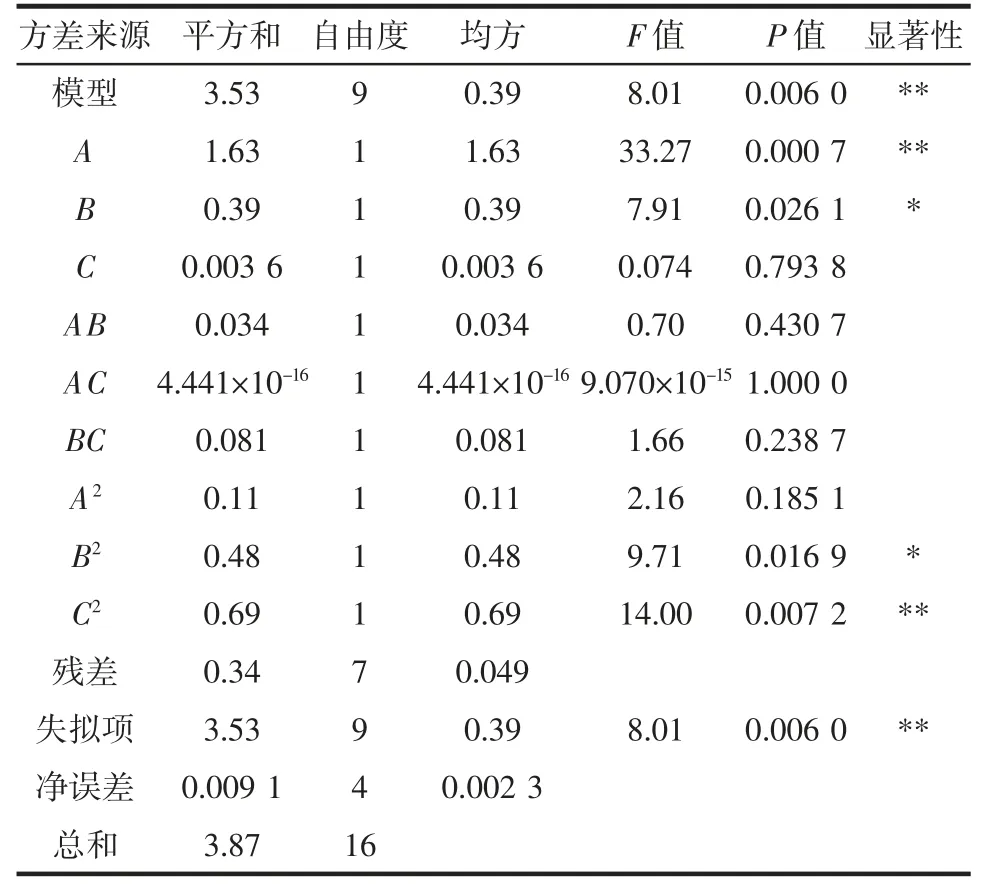
表3 回归模型方差分析Table 3 Analysis of variance of regression model
由表3 可知,整体模型达到极显著水平(P<0.01),失拟项P=0.006 0<0.01,极显著,R2=0.911 5,说明该方程的拟合较好,模型具有统计学意义。方差分析结果显示:B、B2为显著项(P<0.05),A、C2为极显著项(P<0.01)。由方差分析结果可知,各因素的影响顺序依次为料液比(A)>浸提温度(B)>pH 值(C)。
2.2.3 响应面交互作用分析
各因素交互作用见图5~图7。
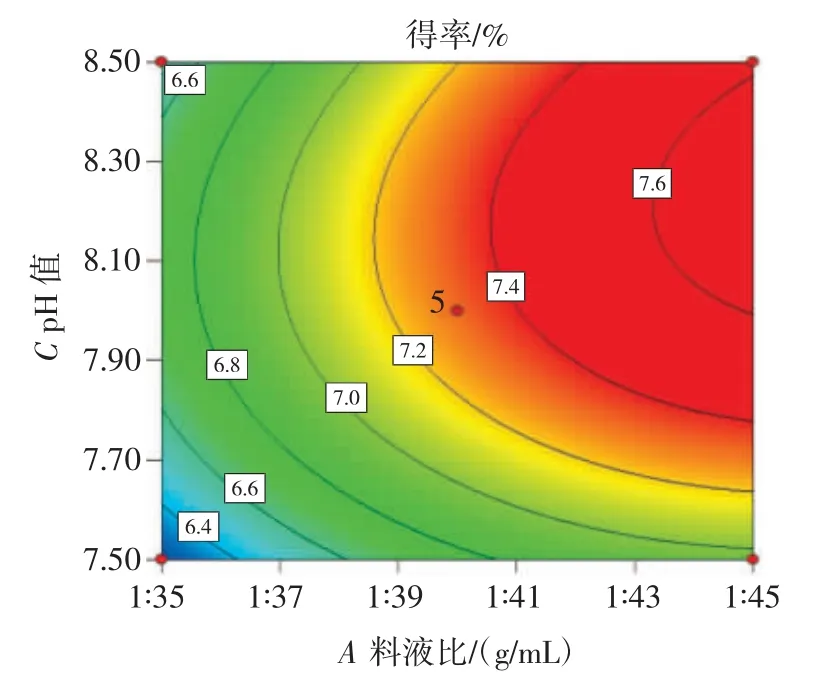
图5 料液比与pH 值交互作用对得率的影响Fig.5 Effect of solid-liquid ratio and pH interaction on extraction rate
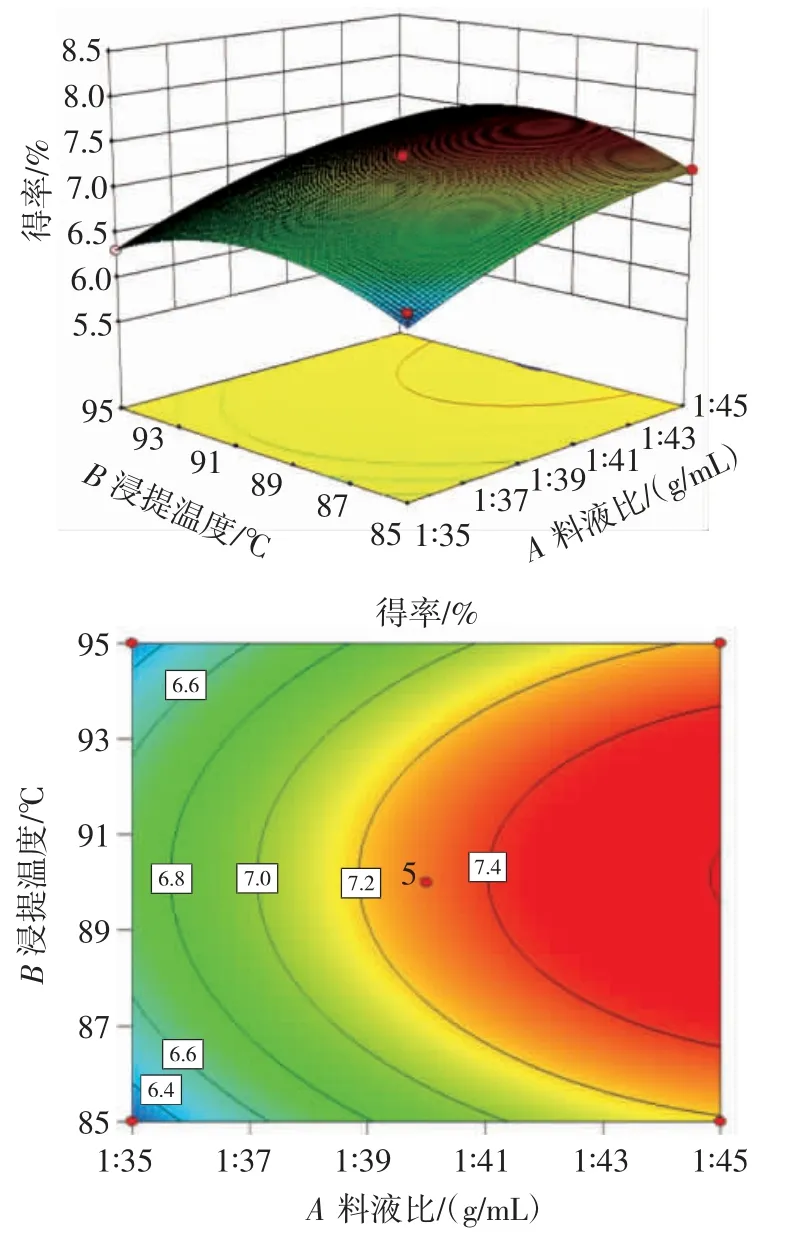
图6 料液比与浸提温度交互作用对得率的影响Fig.6 Effect of solid-liquid ratio and temperature interaction on extraction rate
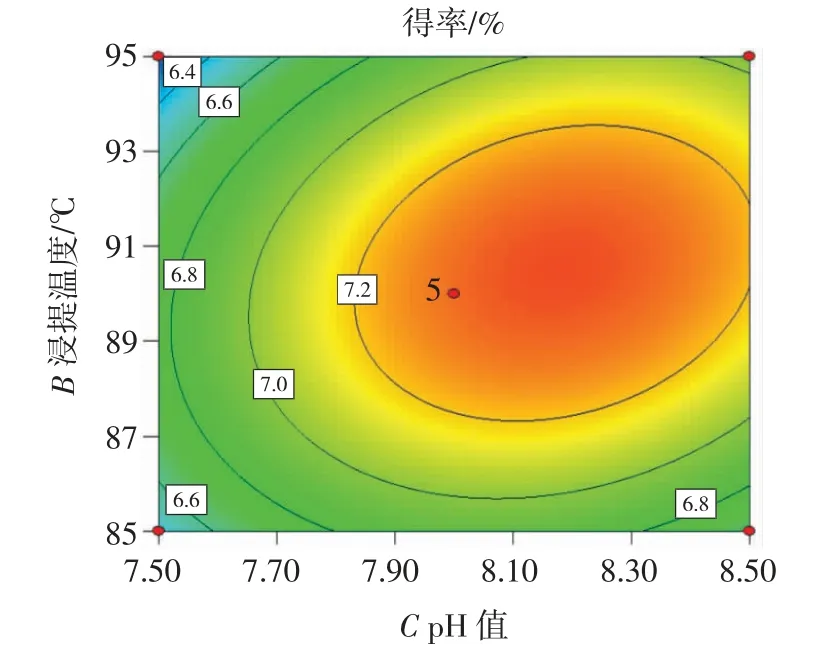
图7 浸提温度与pH 值交互作用对得率的影响Fig.7 Effect of temperature and pH interaction on extraction rate
由图5~图7 可知,AC(料液比与pH 值)、AB(料液比与浸提温度)、BC(浸提温度与pH 值)交互作用对奇亚籽胶得率的影响不显著,与回归模型方差分析结果一致。
2.3 试验结果验证
通过单因素结合响应面试验法优化奇亚籽胶提取工艺,通过软件得出最佳提取条件为料液比1∶45(g/mL)、浸提温度90.27 ℃、pH8.24,奇亚籽胶得率预测值为7.68%。根据实际条件调整得到的最佳提取条件为料液比1∶45(g/mL)、浸提温度90 ℃、pH8.2,验证试验结果显示,奇亚籽胶平均得率为(7.59±0.12)%,说明模型可靠,且该条件下,奇亚籽胶得率高于Muñoz 等[18](7%)和Ayerza 等[19](6%)的研究结果。
2.4 奇亚籽胶的基本组分
奇亚籽胶的基本组分结果见表4。

表4 奇亚籽胶的基本组分Table 4 The composition of chia mucilage %
由表4 可知,该方法提取的奇亚籽胶水分含量低于Avila-De 等[20]的结果(10.60±0.22)%,粗蛋白和脂肪含量较Câmara 等[21]报道的结果[(11.95±0.55)%、(26.46±1.30)%]低,这是因为利用筛子手工刮离奇亚籽冻干混合物的方法使种子在摩擦过程中破裂,随黏液通过筛网,进而降低杂质的比重,蛋白质和脂肪的含量得到提高。而利用搅拌器进行分离的方法可以减少种子破碎的几率,降低粗蛋白和脂肪的含量从而提高纯度。研究表明,奇亚籽胶的蛋白质含量越低,其本身的增厚和胶凝能力就越强[22]。由表4 可知,总糖含量占化学组分总量的比重最高,Bosquez-Molina 等[23]的研究表明碳水化合物可以延伸到大量的水相中,通过空间排斥力避免油滴在水溶液中的絮凝和聚结,从而稳定乳液,这是奇亚籽胶能够稳定液态或固态分散体的主要原因。而灰分含量明显高于Capitani 等[24]所报道的结果(4.8%)。
2.5 奇亚籽胶的物理性质
2.5.1 奇亚籽胶的乳化活性及乳化稳定性
乳化活性是指分子促进2 种不相溶液体的增溶或分散,乳化稳定性是维持乳状液稳定及抗破裂的能力[25],这两项指标是蛋白质和多糖在基于乳液的食品系统中重要的功能性质。奇亚籽胶的乳化活性及乳化稳定性结果如图8 所示。
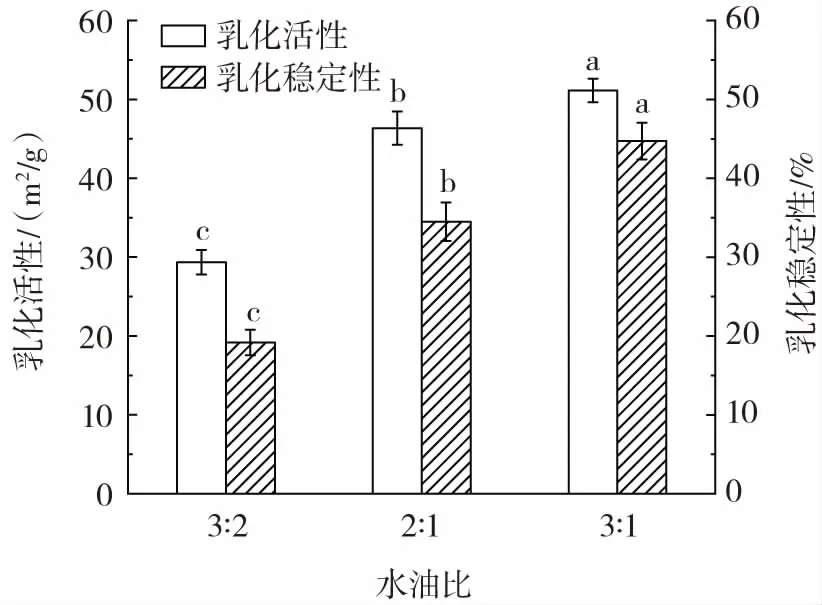
图8 奇亚籽胶的乳化活性及乳化稳定性Fig.8 Emulsifying activity and emulsifying stability of chia mucilage
由图8 可知,乳化活性为29.3~53.1 m2/g,乳化稳定性为19.2%~46.7%。乳化活性和乳化稳定性均随着水油比的增加而显著增加(P<0.05),即随着奇亚籽胶浓度的增大而增加,说明奇亚籽胶能在没有任何化学或酶改性的情况下稳定乳状液中的油滴。奇亚籽胶稳定乳液的主要机制是通过增加体相的黏度来降低油滴的动力学流动性,从而减少颗粒聚结,其中的亲水成分会延伸到水相中,通过空间排斥力稳定油滴[26]。
2.5.2 奇亚籽胶的持水力和持油力
持水力是在施加外力后被水化样品吸收和持有水分的能力,持油力则表现为通过蛋白质分子内的非极性侧向位点吸收油的能力[27]。试验结果表明,奇亚籽胶的持水力为(14.78±0.53)%,持油力为(21.80±1.31)%。研究表明,奇亚籽胶的持水力与其蛋白质和纤维有关,因为纤维由多个游离羟基组成,可以与水分子建立化学键,而蛋白质上的亲水位点会与水相互作用,与水充分结合从而锁住水分。奇亚籽胶的高持水力可以确保烘焙产品的新鲜度和柔软度,奇亚籽胶的持油力为(21.80±1.31)%,这与Punia 等[28]研究中的22.3%符合,表明奇亚籽胶有着较高的持油力。
2.5.3 奇亚籽胶的溶解度
溶解度表示在受控温度下在一段时间内已溶解的分子数量,是评估粉末在水溶液中性质的最可靠标准。图9 为奇亚籽胶的溶解度与温度的关系。
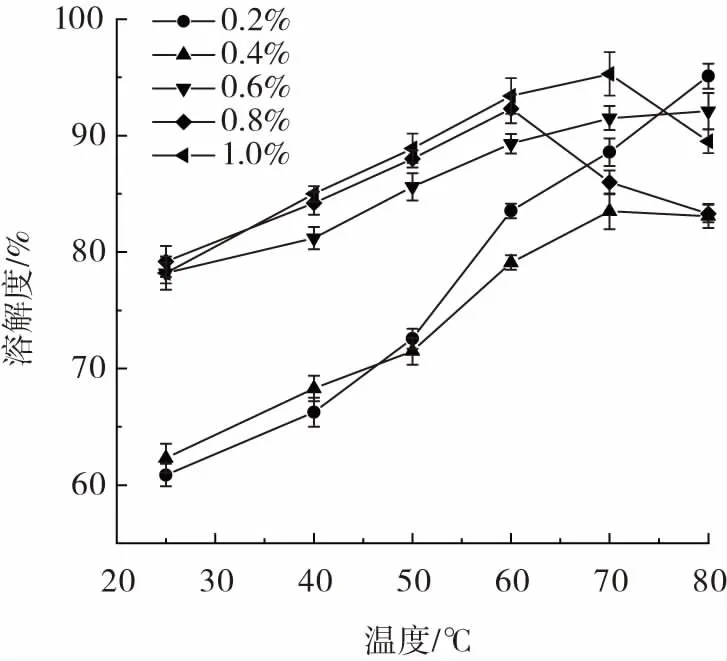
图9 奇亚籽胶的溶解度Fig.9 Solubility of chia mucilage
由图9 可知,当奇亚籽胶浓度小于等于0.6%时,溶解度随着温度升高而明显增加,80 ℃时,奇亚籽胶的溶解度最高,这是因为多糖链之间的氢键在高温下断裂,O—H 基团暴露于水中从而提高了溶解度。当奇亚籽胶浓度大于0.6%,温度高于60 ℃时,溶解度降低。这可能是因为在高温下,过量的奇亚籽胶发生了胶凝作用[29]。同时,随奇亚籽胶浓度的增加,各温度下的溶解度整体上呈增加趋势。这可能是因为奇亚籽胶浓度的增加提高了溶液的pH 值,从而提升了溶解度。
2.5.4 奇亚籽胶的起泡性与起泡稳定性
起泡性是食品工业中衡量食物蛋白质功能性质的一个重要因素,然而有些单一蛋白质无论是在起泡能力还是起泡稳定性方面均存在一定的局限性,不能满足食品行业日益严格的需求[30]。而蛋白质和多糖可以在不同的pH 值和混合比例下形成不同状态的复合物。这些包括单个可溶性聚合物、分子内可溶性复合物、分子间可溶性复合物和分子间不溶性复合物,它们可能会不同程度地影响蛋白质的发泡性能。奇亚籽胶的起泡性与起泡稳定性结果见表5。
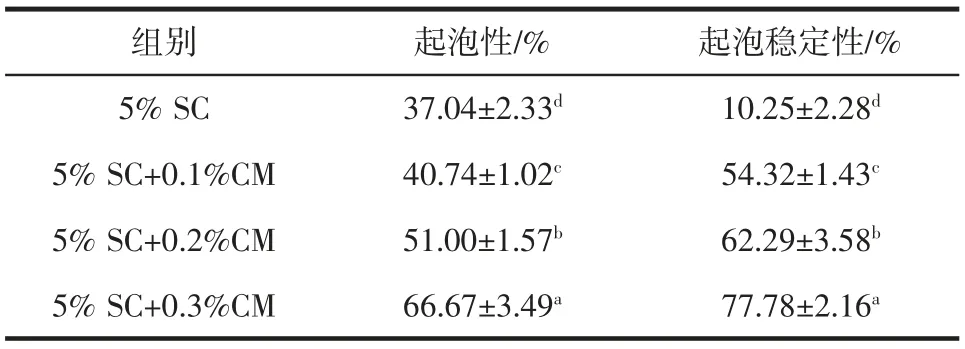
表5 奇亚籽胶的起泡性与起泡稳定性Table 5 Foaming properties of chia mucilage
由表5 可知,奇亚籽胶的添加显著提高了混合溶液的起泡性(P<0.05)及起泡稳定性(P<0.05)。这是因为多糖与蛋白质二者的相互作用,构成了蛋白质-多糖基质从而形成小气泡,赋予溶液稳定的充气结构[11]。奇亚籽胶良好的起泡性和起泡稳定性使其在冰淇淋及其他乳制品中有着广阔的应用前景。
2.5.5 傅里叶红外光谱分析
图10 为奇亚籽胶的傅里叶红外光谱结果。
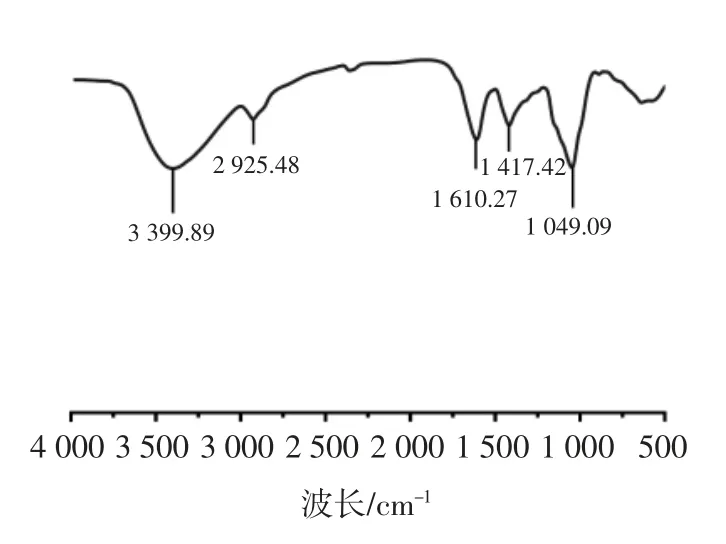
图10 傅里叶红外光谱分析Fig.10 FTIR analysis of chia mucilage
由图10 可知,在约3 399、2 925、1 049 cm-1处为多糖中常见的峰,分别代表羟基的延展(—OH)、甲烯基的延展(—CH 和—CH2)以及与糖类的芳香基团结合的C O。1 420 cm-1处的特征峰代表糖醛酸羧基的羧基(—COO—)的对称延展,1 610 cm-1处的特征峰表示的是甘露糖的环延展。以上特征峰在多糖类化合物中较为常见,并且与多个植物胶体所显示的特征峰相似[31]。
3 结论
本文采取单因素结合响应面的试验方法,在单因素试验的基础上利用响应面进一步优化奇亚籽胶的提取工艺。最佳提取参数为料液比1∶45(g/mL)、温度90 ℃、pH8.2,此条件下奇亚籽胶的得率为(7.59±0.12)%。对最佳工艺提取出的奇亚籽胶进行理化性质分析,结果表明,最优工艺提取的奇亚籽胶纯度较高,脂肪及蛋白质含量较低,同时具有良好的乳化性、乳化活性、持水力、持油力、溶解度、起泡性及起泡稳定性,在加工食品中具有较大潜力。
