亚砷酸钠抑制柑橘果实柠檬酸积累的机制
2023-11-18叶丽杨俊枫李民华李泽航马小川常媛媛尹韬盛玲卢晓鹏
叶丽,杨俊枫,李民华,李泽航,马小川,常媛媛,尹韬,盛玲,卢晓鹏*
亚砷酸钠抑制柑橘果实柠檬酸积累的机制
叶丽1,2,杨俊枫1,2,李民华3,李泽航1,2,马小川1,2,常媛媛1,2,尹韬1,2,盛玲1,2,卢晓鹏1,2*
(1.湖南农业大学园艺学院,湖南 长沙 410128;2.国家柑橘改良中心长沙分中心,湖南 长沙 410128;3.怀化市农业气象试验站,湖南 怀化 418000)
以亚砷酸钠(NaAsO2)溶液(含6.16 g/L MgSO4·7H2O、1 mL/L Triton X–100、0.17 g/L NaAsO2)喷施处理‘山下红’温州蜜柑、‘橘湘早’温州蜜柑、‘大红甜橙’树体,离体处理‘冰糖橙’汁胞(MS培养基含1.0 mg/L NaAsO2)及愈伤组织(MS培养基含0.5、1.0 mg/L NaAsO2),测定可溶性固形物(TSS)、苹果酸和柠檬酸的含量,分析和基因的表达及其启动子活性。结果表明:NaAsO2可有效降低果实、汁胞和愈伤组织的柠檬酸含量;NaAsO2处理后,‘山下红’‘橘湘早’和‘大红甜橙’果实柠檬酸含量分别较对照降低4.59%~61.57%、0.67%~14.92%、13.22%~54.35%;NaAsO2处理60 d的‘橘湘早’果实中和的表达量分别下降73%和32%,在NaAsO2处理21 d的‘冰糖橙’汁胞中的表达量分别降低55%和27%,在0.5 mg/L NaAsO2处理20 d的‘冰糖橙’愈伤组织中分别降低73%和84%;启动子区域缺失试验结果表明,干旱信号可能作用在和启动子的ABRE元件上,并调控它们的表达,NaAsO2处理后含有ABRE元件的启动子区段活性明显减弱,推测NaAsO2抑制了柑橘中和启动子活性进而降低其表达,从而减弱了柠檬酸在果实中的积累。
柑橘;亚砷酸钠;柠檬酸;基因表达;启动子活性;;
在产业规模不断扩大的背景下,人们对柑橘果实品质的要求越来越高[1]。酸是影响柑橘果实口感及品质的重要评价指标[2]。柠檬酸是柑橘中主要的有机酸,占总酸含量的85%~90%,是影响柑橘类水果风味的主要因素之一[3]。不同类型柑橘品种的酸含量差异较大,无酸与极高酸品种的柠檬酸含量差异达44倍[4]。有研究[5–6]表明干旱能够影响柑橘果实柠檬酸的积累,但可通过栽培技术手段起到增糖降酸的效果,如喷施亚砷酸盐[7–8]、砷酸铅[9]、磷酸盐[10]和亚砷酸钠等[11]。
柠檬酸代谢是一个复杂的生物过程。研究显示,液泡质子泵转运是控制柑橘果实酸度的关键步骤[12],bHLH转录因子()和P3A–ATPase质子泵()是调控柑橘果实柠檬酸积累的主效基因[13]。石彩云[14]研究发现,的低表达是柑橘‘红暗柳’果实柠檬酸含量显著降低的主要原因。LI等[15]发现同源基因()在酸柠檬、橙、柚和朗布尔酸橙中的表达水平显著高于无酸品种。SHI等[16]发现参与了柠檬酸盐的积累。杨文萱[17]认为,通过调控基因表达影响果实细胞液泡内柠檬酸的积累,从而调控温州蜜柑果实酸含量。也有研究[18]表明,与(MYB)、(WRKY)(WD)形成蛋白复合体来协同调控柑橘果实酸的积累。
本研究以柑橘果肉、愈伤组织和汁胞为材料,探究亚砷酸钠处理对酸积累的主效基因和表达的影响,分析和启动子活性,以明晰亚砷酸钠对柑橘有机酸积累的调控机制,为开发安全有效的果实品质调控剂提供理论依据。
1 材料与方法
1.1 供试材料
‘山下红’温州蜜柑、‘橘湘早’温州蜜柑和‘大红甜橙’栽种于湖南农业大学教学科研基地;分离汁胞所用‘冰糖橙’果实来自湖南省怀化市麻阳县果园;‘冰糖橙’愈伤组织为国家柑橘改良中心长沙分中心保存。
1.2 试验设计
1.2.1亚砷酸钠溶液喷施试验
树体喷施NaAsO2溶液(含6.16 g/L MgSO4·7H2O、1 mL/L Triton X–100、0.17 g/L NaAsO2,HCl调pH至3.5),对照(CK) 喷施清水。2017年6月1日用NaAsO2溶液喷施‘山下红’树体,每30 d喷施1次,共喷施4次;分别在喷施后第60、90、120、146 天进行采样。2019年7月23日用NaAsO2处理溶液喷施‘橘湘早’树体1次;于2019年8月12日开始进行采样,每隔20 d取样至果实成熟,共取样3次。于2018年6月28日起用NaAsO2溶液喷施‘大红甜橙’树体,每30 d喷施1次,于喷施后84、135、165 d分别取样。以上试验均选取树体健康、树势基本一致的植株,每个处理3株重复,采集树冠四周外围中上部大小和成熟度一致的果实5~10个。果实采摘后一部分用于可溶性固形物、柠檬酸和苹果酸含量的测定;一部分分离果肉,置于液氮速冻,于–80 ℃冰箱保存,备用。
1.2.2亚砷酸钠溶液处理‘冰糖橙’汁胞
2021年10月5日取样,采用75%乙醇消毒果实10 min,1%次氯酸钠溶液对果实消毒15~20 min,去果皮,剥开囊瓣,切成0.5 cm3左右的小块,每小块基部带一薄层中果皮(白色组织)。用镊子分别取4~5块接种于MS无菌培养基(CK)和含1.0 mg/L NaAsO2的MS培养基中,白色组织接触培养基表面。培养温度为(25±2) ℃,16 h光培养或8 h暗培养。于第1 天取样后每隔7 d取样至35 d结束,样品一部分用于测定可溶性固形物、柠檬酸和苹果酸的含量,一部分用液氮速冻,于–80 ℃冰箱储存,备用。
1.2.3亚砷酸钠处理‘冰糖橙’愈伤组织
将‘冰糖橙’愈伤组织分别置于含0.5、1.0 mg/L NaAsO2的MS培养基,于第20 天和第40 天取样,一部分取样置于液氮中速冻,于–80 ℃冰箱保存待用;一部分用于可溶性固形物、柠檬酸和苹果酸含量的测定。
1.3 果实品质的分析
采用手持糖酸一体机(爱拓,PAL–BX/ ACID1,日本)测定可溶性固形物和酸含量;参照LU等[19]方法,采用日本岛津LC–20AT高效液相色谱(HPLC)测定可溶性固形物、柠檬酸和苹果酸含量。
1.4 总RNA的提取和实时荧光定量PCR分析
采用SteadyPure通用型RNA提取试剂盒(艾科瑞生物工程有限公司)提取果肉、汁胞、愈伤组织的总RNA;采用紫外分光光度计(IMPLEN Nano-photometer P–330,德国)测定RNA的纯度和浓度;采用反转录试剂盒(Evo M–MLV,艾科瑞生物工程有限公司)合成 cDNA,于–20 ℃保存,备用。荧光定量PCR所用的引物–F(5–CACAC TGGAGTGATGGTTGG–3)、–R(5–ATTGGC CTTGGGGTTAAGAG–3)、–F(5–GCTGTT GATTGAAGTTACTG–3)、–R(5–CCTCTTA ACCTCCACAATG–3)、–F(5–ACCCTTCA TGGGCTTCAAC–3)、–R(5–GCTTCACC ACTGACTCGACA–3)均由Primer Premier 5设计,送北京擎科生物科技有限公司合成。使用荧光定量PCR仪(Bio–Rad,FX96,CA)进行RT–PCR扩增,PCR反应体系(10 µL):SYBR Green 5 μL、上下游引物各0.25 µL、模板cDNA 1 µL和ddH2O 3.5 µL。PCR反应程序:95 ℃预变性30 min;95 ℃变性5 s,58 ℃退火10 s ,72 ℃延伸15 s,40个循环。以为内参基因,计算相对表达量,3次生物学重复。
1.5 CsAN1与CsPH8启动子顺式作用元件的分析及载体的构建
选取与启动子,参考甜橙基因组[20]获得与基因启动子序列,运用在线软件Plant–CARE(http://bioinformatics.psb.uge nt.be/webtools/plantcare/html/)预测和启动子序列中的逆境相关顺式作用元件。
启动子从5端逐段缺失,分别命名为PAN1(–2.0K)、PAN1(–1.5K)、PAN1(–1.1K)和PAN1(–0.3K);启动子缺失后分别命名为PPH8(–1.6K)(启动子全长为1600 bp)、PPH8(–0.7K)、PPH8(–0.5K)。克隆与全长及缺失的启动子片段,连接至含35S驱动的pCAMBIA1301–GUS植物表达载体上。将上述构建成功的载体转化农杆菌,备用。片段扩增引物如表1所示。

表1 不同启动子片段扩增所用的引物序列
1.6 ‘冰糖橙’愈伤组织的遗传转化
参照石玮等[21]的方法,将构建成功的与全长及缺失的启动子利用农杆菌转化法转化‘冰糖橙’愈伤组织。对获得的转基因愈伤株系进行阳性鉴定,分别获得2个转基因愈伤阳性株系,用L1、L2表示,普通冰糖橙愈伤组织用WT表示。
1.7 转基因愈伤GUS染色
将获得的不同区段启动子阳性株系和WT采用 GUS 染色试剂盒(Coolaber)进行GUS染色。将普通冰糖橙愈伤(WT)和愈伤阳性株系(L1、L2)分别于MS、MS+PEG、MS+PEG+NaAsO2的培养基培养25 d后,各称取0.2 g于2 mL离心管,加入1 mL GUS 染色工作液,于37 ℃培养箱中温育过夜,观察愈伤组织化学反应,拍照记录试验结果。
1.8 数据处理与分析
采用Excel 2016进行数据统计;运用SPSS 23.0进行差异显著性分析;采用Sigmaplot 10.0绘图。
2 结果与分析
2.1 喷施亚砷酸钠对柑橘果实可溶性固形物及柠檬酸和苹果酸含量的影响
亚砷酸钠对不同品种柑橘可溶性固形物(TSS)含量的影响不同。NaAsO2处理90、120、146 d的‘山下红’的TSS含量显著低于CK的,在146 d 时TSS含量较CK显著降低8%(图1–A)。‘橘湘早’果实TSS含量在果实发育期间变化趋势平缓,经NaAsO2处理60 d后较CK显著降低12%(图1–B)。‘大红甜橙’果实TSS含量在果实发育前期有所积累,果实发育后期趋于平缓,NaAsO2处理84 d的果实的TSS含量显著高于CK的,处理135、165 d的则低于CK的(图1–C)。
NaAsO2能显著降低柑橘的柠檬酸含量。‘山下红’‘橘湘早’‘大红甜橙’果实柠檬酸含量随果实发育整体呈递减的趋势。‘山下红’经NaAsO2处理后,柠檬酸含量较对照降低4.59%~61.57%,120 d时柠檬酸含量较CK显著降低57%(图1–D)。‘橘湘早’’果实经NaAsO2处理后柠檬酸含量较对照降低0.67%~14.92%,60 d时柠檬酸含量较CK显著降低15%(图1–E)。‘大红甜橙’果实经NaAsO2处理后柠檬酸含量较对照降低13.22%~54.35%,84 d时柠檬酸含量较CK显著降低54%(图1–F)。
NaAsO2处理对不同品种果实苹果酸含量影响不同,随果实发育‘山下红’‘橘湘早’果实的苹果酸含量整体呈现下降的趋势,在‘大红甜橙’果实中苹果酸含量呈上升趋势。经NaAsO2处理后,随处理时间延长,NaAsO2能够抑制‘山下红’‘橘湘早’苹果酸含量的积累,分别在146、60 d显著低于CK的(图1–G、图1–H),而‘大红甜橙’果实经NaAsO2处理后随处理时间的延长,苹果酸含量则逐渐高于CK的(图1–I),这可能与品种特性有关。
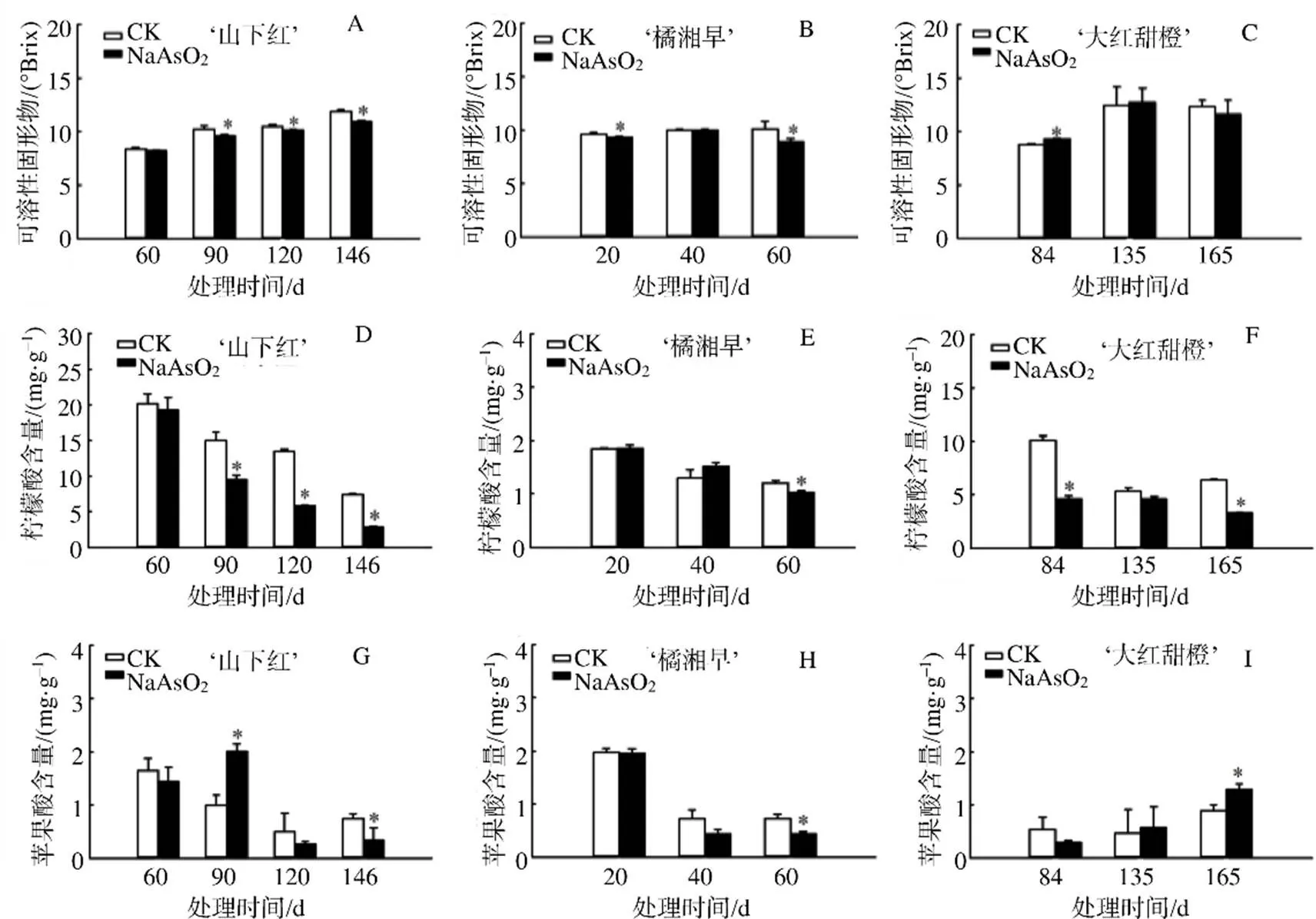
“*”表示同一时间NaAsO2处理与CK间的差异有统计学意义(P<0.05)。
2.2 亚砷酸钠处理对离体培养‘冰糖橙’汁胞可溶性固形物及柠檬酸和苹果酸含量的影响
离体培养‘冰糖橙’汁胞的TSS含量随培养时间的延长整体呈递减趋势,经NaAsO2处理后,离体‘冰糖橙’汁胞TSS含量于21 d开始显著低于CK的(图2–A)。在离体培养条件下,‘冰糖橙’汁胞中柠檬酸含量呈先上升后下降的趋势,于第7天开始,NaAsO2处理的柠檬酸含量显著低于CK的,至第35天柠檬酸含量较CK显著降低41%(图2–B)。离体培养条件下‘冰糖橙’汁胞中苹果酸含量整体呈下降的趋势,于第28天开始NaAsO2处理的苹果酸含量显著低于CK的,较CK显著降低64% (图2–C)。
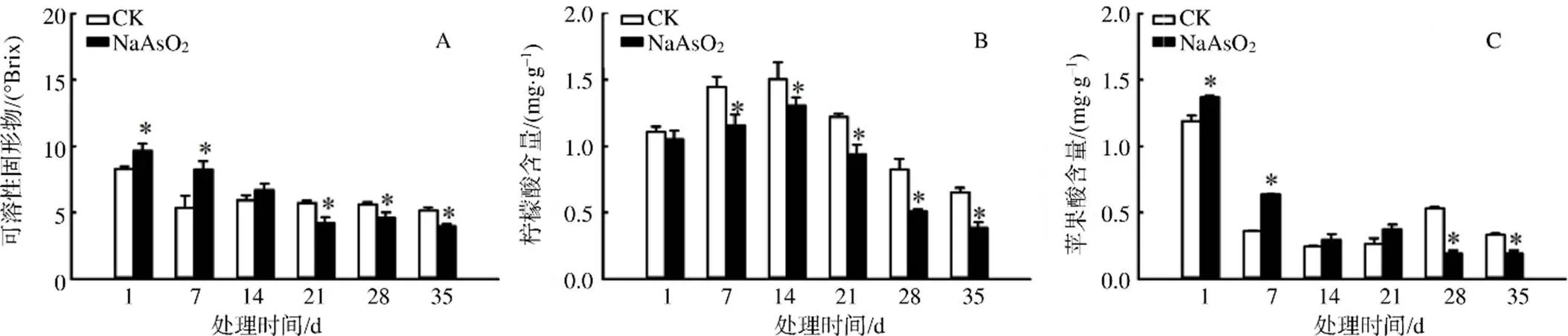
“*”表示同一时间NaAsO2处理与CK间的差异有统计学意义(P< 0.05)。
2.3 亚砷酸钠处理对‘冰糖橙’愈伤组织可溶性固形物及柠檬酸和苹果酸含量的影响
不同浓度NaAsO2对‘冰糖橙’愈伤组织TSS含量影响不同,NaAsO2处理20 d时,TSS含量均高于CK,且1.0 mg/L NaAsO2处理‘冰糖橙’愈伤组织的效果较0.5 mg/L NaAsO2明显;培养至40 d,0.5 mg/L NaAsO2处理的‘冰糖橙’的TSS含量较1.0 mg/L NaAsO2处理的下降明显,较CK显著降低29%(图3–A)。不同浓度NaAsO2均能显著降低柠檬酸含量,培养至40 d时,0.5 mg/L NaAsO2处理的‘冰糖橙’中柠檬酸含量下降明显,较CK显著下降56%(图3–B)。不同浓度NaAsO2也能抑制‘冰糖橙’愈伤组织苹果酸的积累,1.0 mg/L NaAsO2处理对苹果酸的抑制效果较好(图3–C)。

“*”表示同一时间亚砷酸钠处理与CK间的差异有统计学意义(P< 0.05)。
2.4 亚砷酸钠处理对柑橘柠檬酸积累关键基因CsAN1和CsPH8表达的影响
为探究亚砷酸钠处理对柑橘柠檬酸积累途径相关基因表达的影响,本研究对和基因表达进行了分析。‘橘湘早’发育过程中表达量随果实成熟持续上升;经NaAsO2处理,20、40 d 果实中的表达量显著提升,60 d果实中表达量显著降低,较CK低73%(图4–A)。基因表达量随果实成熟持续下降,经NaAsO2处理后,表达量均显著低于CK,20 d时较CK显著降低71%,60 d时较CK降低32%(图4–B)。离体培养‘冰糖橙’汁胞中表达量随培养时间延长呈先下降后上升的趋势,NaAsO2处理7、14、21 d时表达量均显著低于CK的,其中,第21天的表达量较CK显著降低55%(图4–C)。离体培养‘冰糖橙’汁胞中表达量呈先下降后上升再下降的趋势,经NaAsO2处理14 d时表达量较CK显著降低60%,21 d时较CK降低27%(图4–D)。0.5、1.0 mg/L的NaAsO2处理均能显著抑制和在‘冰糖橙’愈伤组织中的表达,其中0.5 mg/L的NaAsO2处理20 d和40 d后,表达量分别较CK降低73%和77%(图4–E),的表达量分别较CK降低84%和75%(图4–F)。综上,NaAsO2可抑制柑橘果实中、的表达,从而抑制柠檬酸的积累。

“*”和不同小写字母示同一时间NaAsO2处理与CK间的差异有统计学意义(P< 0.05)。
2.5 柠檬酸积累关键基因CsAN1和CsPH8启动子活性分析
对和启动子序列进行分析,发现了多个响应非生物胁迫的元件,如ABRE、MYB、MYC、MBS等。将的启动子短截成4个不同长度的片段:PAN1(–2.0K)为启动子全长片段;PAN1(–1.5K)片段缺失多个CGTCA–motif元件;PAN1(–1.1K)片段分别缺失掉1个ERE、MYB、MYC元件;而PAN1(–0.3K)片段缺失掉全部非生物元件(图5–A)。将全长PPH8(–1.6K)的5端短截为3个不同长度:PPH8(–1.6K)为启动子全长片段;PPH8(–0.7K)片段缺失2个MYB和1个ABRE等元件;PPH8(–0.5K)缺失掉全部非生物元件(图5–B)。
将不同缺失片段的和启动子区段遗传转化‘冰糖橙’愈伤组织,GUS组织化学染色结果(图5–C、图5–D)显示:WT愈伤组织无论有无PEG处理均未检测到GUS信号;PEG处理后,PAN1(–2.0K)及PAN1(–1.5K)愈伤组织的GUS信号较强,PAN1(–1.1K)愈伤组织的GUS信号较弱,PAN1(–0.3K)愈伤组织无信号,表明在启动子–300~ –1500 bp处存在响应干旱信号的核心元件;PPH8(–1.6K)愈伤组织的GUS信号较强,PPH8(–0.7K)愈伤组织的GUS信号明显变弱,PPH8(–0.5K)愈伤组织的GUS信号进一步变弱,表明启动子–500~ –700 bp及–700~ –1600 bp处存在响应干旱信号的核心元件。进一步分析和启动子对应区段,均含有响应干旱胁迫的ABRE元件,猜测其可能是和响应干旱的核心元件。

A CsAN1启动子缺失;B CsPH8启动子缺失;C CsAN1启动子超表达愈伤组织的GUS染色结果;D CsPH8启动子超表达愈伤组织的GUS染色结果。
2.6 亚砷酸钠对CsAN1和CsPH8基因启动子活性的影响
从图6–A、图6–B可以看出,NaAsO2处理后和启动子核心区域活性均受到抑制。PAN1(–2.0K)、PAN1(–1.5K)和PAN1(–1.1K)的‘冰糖橙’愈伤组织在经PEG+NaAsO2处理后,GUS信号较PEG组明显减弱,而以上3个转基因愈伤组织均包含ABRE元件;在不含ABRE元件上的PAN1(–0.3K)上进行PEG处理和PEG+NaAsO2处理后两者无显著差异,且活性较弱,几乎染不上色。PEG+NaAsO2处理后,包含ABRE元件的PPH8(–1.6K)和PPH8(–0.7K)愈伤组织较PEG处理GUS信号明显减弱;不含ABRE元件的PPH8(–0.5K)片段经PEG和PEG+NaAsO2处理均无显著差异,且活性较弱。以上结果表明,NaAsO2处理显著抑制了和启动子活性,推测NaAsO2主要作用在ABRE元件上,抑制和启动子活性,从而抑制果实中柠檬酸的积累。
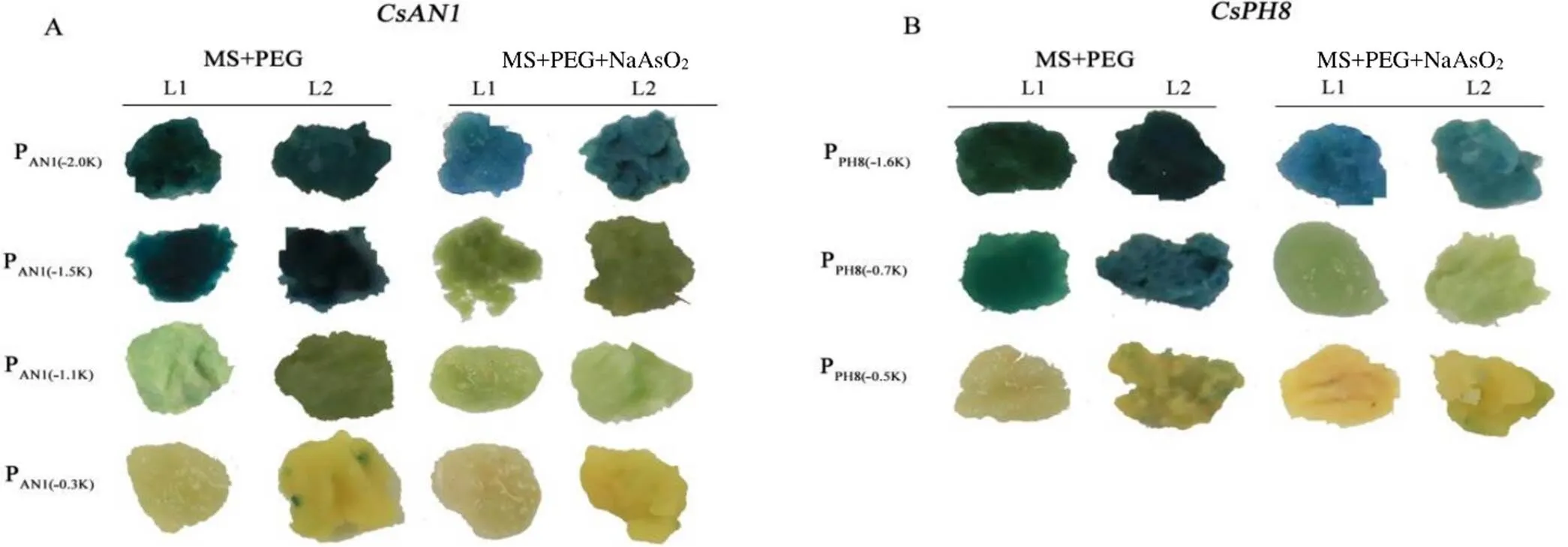
图6 不同处理CsAN1和CsPH8基因启动子的染色活性
3 结论与讨论
柠檬酸是柑橘果实中的主要有机酸,影响柑橘果实的口感和风味等[22]。生产中为了追求果实优良品质,常使用外源物质来提升果实品质。在柑橘果实膨大期对叶面喷施硒酸钠、亚硒酸钠、酵母硒都能促进TSS的积累,降低有机酸的含量,从而达到提升柑橘果实品质的目的[23]。喷施HC–3、磷酸盐[10]或Zn、B[24],使用核苷酸有机营养剂[25]以及注射硒肥[26]等均可降低柑橘果实酸含量。本研究中,对‘大红甜橙’‘橘湘早’和‘山下红’幼果喷施亚砷酸钠溶液,发现果实酸含量基本上都有所降低,表明喷施亚砷酸钠溶液可降低柑橘果实酸的含量。亚砷酸钠处理离体‘冰糖橙’汁胞和愈伤组织,其柠檬酸含量和苹果酸含量也显著降低。但不同柑橘品种对亚砷酸钠抑制作用的响应有所差异,对‘橘湘早’果实酸含量的影响较小,这可能与不同品种果实生长发育的特性有关。综上,亚砷酸钠对柑橘柠檬酸积累具有抑制作用,且在不同品种上抑制作用的效果存在差异。
调控柠檬酸转运的和是控制柑橘果实酸性状的主效基因[27]。SHI等[28]发现柑橘中基因在红暗柳果实中的低表达是造成其果实低酸的重要原因。杨文萱[17]研究发现在柑橘上喷施过量的矿质元素,如镁、氮、钙,可上调表达,增加有机酸的含量,而喷施磷肥与钾肥能够降低的表达和有机酸含量。杨文萱等[29]采用ABA注射温州蜜柑果实,发现果实中柠檬酸含量变化与和的表达水平的变化一致。本研究结果显示,亚砷酸钠处理显著抑制了‘橘湘早’果肉、‘冰糖橙’汁胞和‘冰糖橙’愈伤组织中的和基因表达,抑制了柠檬酸积累。这些结果表明,和介导了亚砷酸钠对柑橘果实柠檬酸积累的调控。
高永峰等[30]研究发现番茄基因启动子含ABRE核心元件,受非生物胁迫诱导后启动子活性与ABRE元件紧密相关。秦玉芝等[31]发现的调控区域存在脱落酸诱导相关元件 ABRE,的转录很可能受环境胁迫的诱导。BÖTTCHER等[32]发现葡萄启动子区域含有多个ABA响应元件(ABRE),ABA能响应生长素酰胺合成酶基因表达。宁源生等[33]对苹果NCL家族基因进行分析,发现的启动子上包含脱落酸(ABA)响应元件(ABRE),对转录水平有影响。本研究中,和启动子ABRE元件逐个缺失后GUS染色活性逐渐变弱,说明ABRE元件在介导和响应干旱和促进果实柠檬酸积累方面起着重要作用。进一步将转和启动子的愈伤组织用PEG+NaAsO2处理,结果显示在启动子不缺失ABER元件的情况下也抑制和启动子转录,最终降低果实柠檬酸含量。推测亚砷酸钠在干旱胁迫条件下可能是通过ABRE元件抑制和启动子的活性,降低柠檬酸的含量。
[1] 邓秀新.世界柑橘品种改良的进展[J].园艺学报,2005,32(6):1140–1146.
[2] 卢晓鹏,李菲菲,谢深喜.柑橘果实柠檬酸积累调控基因研究进展[J].果树学报,2018,35(1):118–127.
[3] 罗安才,杨晓红,邓英毅,等.柑橘果实发育过程中有机酸含量及相关代谢酶活性的变化[J].中国农业科学,2003,36(8):941–944.
[4] WANG L,HUANG Y,LIU Z A,et al.Somatic variations led to the selection of acidic and acidless orange cultivars[J].Nature Plants,2021,7(7):954–965.
[5] 周铁,马小川,唐超兰,等.果实膨大期干旱对冰糖橙果实品质的影响[J].南方农业学报,2020,51(10):2507–2514.
[6] 潘斌,李菲菲,文斌,等.不同果实发育期干旱胁迫对温州蜜柑果实品质形成的影响[J].果树学报,2019,36(6):729–737.
[7] YAMAKI Y T.Organic acids in the juice offruits[J]. Journal of the Japanese Society for Horticultural Science,1989,58(3):587–594.
[8] YAMAKI Y T.Seasonal changes in the organic acids in juice offruits[J].Journal of the Japanese Society for Horticultural Science,1990,58(4):895–898.
[9] YAMAKI Y T. Effect of lead arsenate on citrate synthase activity in fruit pulp of satsuma mandarin[J]. Journal of the Japanese Society for Horticultural Science, 1990, 58(4) : 899–905.
[10] 文涛,熊庆娥,曾伟光,等.脐橙果实有机酸代谢调控措施的初步研究[J].四川农业大学学报,2001,19(2):144–147.
[11] SADKA A,ARTZI B,COHEN L,et al.Arsenite reduces acid content infruit,inhibits activity of citrate synthase but induces its gene expression[J]. Journal of the American Society for Horticultural Science,2000,125(3):288–293.
[12] STRAZZER P,SPELT C E,LI S J,et al. Hyperacidification offruits by a vacuolar proton-pumping P-ATPase complex[J].Nature Communications,2019,10:744.
[13] MÜLLER M,IRKENS-KIESECKER U,RUBINSTEIN B,et al.On the mechanism of hyperacidification in lemon:comparison of the vacuolar H(+)-ATPase activities of fruits and epicotyls[J].The Journal of Biological Chemistry,1996,271(4):1916–1924.
[14] 石彩云.柑橘柠檬酸积累相关的质子泵基因挖掘与关键基因的功能分析[D].武汉:华中农业大学,2019.
[15] LI S J,LIU X J,XIE X L,et al.,a PH-like gene,contributes to citric acid accumulation in citrus fruit[J].Scientia Horticulturae,2015,197:212–217.
[16] SHI C Y,HUSSAIN S B,HAN H,et al.Reduced expression of,a P-type ATPase gene,is the major factor leading to the low citrate accumulation in citrus leaves[J].Plant Physiology and Biochemistry,2021,160:211–217.
[17] 杨文萱.柑橘AN1基因()在柠檬酸积累中的作用及不同因素对的表达影响[D].武汉:华中农业大学,2019.
[18] QUATTROCCHIO F,VERWEIJ W,KROON A,et al. PH4 of petunia is an R2R3 MYB protein that activates vacuolar acidification through interactions with basic-helix-loop-helix transcription factors of the anthocyanin pathway[J].The Plant Cell,2006,18(5):1274–1291.
[19] LU X P,CAO X J,LI F F,et al.Comparative transcriptome analysis reveals a global insight into molecular processes regulating citrate accumulation in sweet orange()[J].PhysiologiaPlanta-rum,2016,158(4):463–482.
[20] XU Q,CHEN L L,RUAN X A,et al.The draft genome of sweet orange()[J].Nature Genetics,2013,45(1):59–66.
[21] 石玮,李东栋,邓秀新,等.根癌农杆菌介导绿色荧光蛋白基因转化印度酸桔的研究[J].园艺学报,2002,29(2):109–112.
[22] 胡小梅.柑橘ATP–柠檬酸裂解酶基因的挖掘与其在柠檬酸代谢中的作用研究[D].武汉:华中农业大学,2015.
[23] 张德健,毛聪明.不同硒源对柑橘硒含量、果实品质、矿质养分和抗氧化酶活性的影响[J].长江大学学报(自然科学版),2022,19(5):114–119.
[24] 姚益云,张德远,刘经荣.硼、锌在温州蜜柑上的应用研究[J].江西农业大学学报,1996,18(3):282–286.
[25] 姜小文,张秋明,王灿辉,等.喷施核苷酸有机营养剂改进椪柑果实品质的效果[J].中国南方果树,2001,30(3):12–13.
[26] 吴其飞,黄达明,管国强.茎部注射硒肥对金桔的生长及果实品质的影响[J].水土保持学报,2002,16(6):92–95.
[27] SHIMADA T,NAKANO R,SHULAEV V,et al. Vacuolar citrate/H+symporter of citrus juice cells[J].Planta,2006,224(2):472–480.
[28] SHI C Y,HUSSAIN S B,YANG H,et al.,a P-type proton pump gene,plays a key role in the diversity of citric acid accumulation in citrus fruits[J].Plant Science,2019,289:110288.
[29] 杨文萱,罗丽娟,陈欢,等.柑橘基因()在柠檬酸积累中的作用及不同因素对其表达的影响[J].山东农业大学学报(自然科学版),2020,51(1):6–12.
[30] 高永峰,杨丰铭,李琴中,等.番茄31基因启动子的克隆与逆境应答模式分析[J].西北植物学报,2018,38(12):2155–2164.
[31] 秦玉芝,邢铮,潘妃,等.马铃薯光响应基因的克隆与表达分析[J].湖南农业大学学报(自然科学版),2015,41(4):378–384.
[32] BÖTTCHER C,KEYZERS R A,BOSS P K,et al. Sequestration of auxin by the indole-3-acetic acid-amido synthetase GH3-1 in grape berry(L.) and the proposed role of auxin conjugation during ripening[J]. Journal of Experimental Botany,2010,61(13):3615–3625.
[33] 宁源生,李欢,宋建飞,等.苹果NCL家族基因与根系细胞钙离子浓度变化的关系[J].园艺学报,2023,50(3):475–484.
Mechanism of sodium arsenite inhibiting citrate accumulation in citrus fruits
YE Li1,2,YANG Junfeng1,2,LI Minhua3,LI Zehang1,2,MA Xiaochuan1,2, CHANG Yuanyuan1,2,YIN Tao1,2,SHENG Ling1,2,LU Xiaopeng1,2*
(1.College of Horticulture, Hunan Agricultural University, Changsha, Hunan 410128, China; 2.National Center for Citrus Improvement(Changsha), Changsha, Hunan 410128, China; 3.Huaihua Agrometeorological Experimental Station, Huaihua, Hunan 418000, China )
In order to investigate the mechanism of sodium arsenite inhibiting citric acid accumulation in citrus fruits, sodium arsenite solution(containing 6.16 g/L MgSO4·7H2O, 1 mL/L Triton X-100, 0.17 g/L NaAsO2) was applied by spraying onto ‘Yamashitabeni wase’(Marc), ‘Juxiangzao’(Marc) and ‘Dahongtiancheng’(Osbeck), as well as to detached juice sacs(MS medium containing 1.0 mg/L NaAsO2) and callus of ‘Bingtangcheng’(Osbeck)(MS medium containing 0.5 and 1.0 mg/L NaAsO2). The total soluble solid(TSS), citrate and malate contents, expression levels ofandgenes, and their promoter activities were analyzed. The results showed that NaAsO2could reduce the citrate contents of fruit, juice sacs and callus tissues. After NaAsO2treatment, the citrate contents of ‘Yamashitabeni wase’, ‘Juxiangzao’ and ‘Dahongtiancheng’ decreased by 4.59 to 61.57%, 0.67% to 14.92% and 13.22% to 54.35%, respectively, compared with CK group.andexpression levels were significantly reduced under NaAsO2treatment, with a 73% and 32% respectively decrease in ‘Juxiangzao’ fruit after 60 days of treatment, a 55% and 27% respectively decrease in ‘Bingtangcheng’ juice sacs after 21 days,and 73% and 84% respectively in the ‘Bingtangcheng’calli callus treated with 0.5 mg/L NaAsO2for 20 days. The experiment under the absence of promoter subregions indicated that drought signals might act on the ABRE elements in theandpromoters to regulate their expression, while the activity of promoter segments containing ABRE elements was significantly reduced after NaAsO2treatment. It is speculated that NaAsO2inhibits the activity ofandpromoters in citrus, thereby reducing their expression and weakening the accumulation of citric acid in the fruit.
citrus; sodium arsenate; citrate; gene expression; promoter activities;;
S666.101
A
1007–1032(2023)05–0549–09
叶丽,杨俊枫,李民华,李泽航,马小川,常媛媛,尹韬,盛玲,卢晓鹏.亚砷酸钠抑制柑橘果实柠檬酸积累的机制 [J].湖南农业大学学报(自然科学版),2023,49(5):549–557.
YE L,YANG J F,LI M H,LI Z H,MA X C,CHANG Y Y,YIN T,SHENG L,LU X P.Mechanism of sodium arsenite inhibiting citrate accumulation in citrus fruits[J].Journal of Hunan Agricultural University (Natural Sciences),2023,49(5):549–557.
http://xb.hunau.edu.cn

2023–02–14
2023–09–22
国家自然科学基金项目(32172520);国家柑橘产业技术体系(CARS–26)
叶丽(1995—),女,贵州兴义人,硕士研究生,主要从事果实品质形成与调控研究,yl1113273496@163.com;*通信作者,卢晓鹏,博士,副教授,主要从事果实品质形成与调控研究,xl678@hunau.edu.cn
10.13331/j.cnki.jhau.2023.05.008
责任编辑:毛友纯
英文编辑:柳正
