辣椒绿茎突变体gh1转录组及候选基因表达分析
2023-11-18戴垚王瑾戴丽何长征刘峰
戴垚,王瑾,戴丽,何长征,刘峰*
辣椒绿茎突变体转录组及候选基因表达分析
戴垚1,2,3,王瑾1,2,3,戴丽1,2,3,何长征1,2,3,刘峰1,2,3*
(1.湖南农业大学园艺学院,湖南 长沙 410128;2.园艺作物种质创新与新品种选育教育部工程研究中心,湖南 长沙 410128;3.蔬菜生物学湖南省重点实验室,湖南 长沙 410128)
以EMS诱变的辣椒绿茎突变体和紫茎野生型樟树港辣椒(ST–8)为材料,测定茎中花青素含量;采用转录组测序技术(RNA–seq)和实时荧光定量PCR(qRT–PCR)分析与辣椒茎中花青素生物合成相关基因的表达水平。结果表明:突变体茎中的花青素含量极显著低于ST–8茎中的花青素含量;与ST–8相比,共获得1794个差异表达基因,包括1003个上调表达基因,791个下调表达基因;与花青素生物合成途径相关的基因包括9个结构基因()和3个转录因子();对与花青素合成相关的差异表达基因进行转录组表达量分析和qRT–PCR分析,筛选出4个结构基因()和1个转录因子(),推测这5个基因可能在辣椒茎中花青素生物合成途径中起重要作用。
辣椒;茎;转录组;差异表达基因;花青素;突变体
辣椒(L)原产于中南美洲,自16 世纪后期传入中国后成为了中国重要的蔬菜和调味品,对中国的饮食文化产生了深刻影响[1-2]。辣椒富含多种物质,具有抗氧化、降脂降糖、抗菌和抗癌等作用[3],属于食﹑药两用资源[4],在食品、医药和化妆品等方面都受到广泛关注。辣椒适应性强、经济效益高、种植范围广,已成为农民增收、农村发展的支柱产业[5]。
花青素是一类常见的植物水溶性色素,属于类黄酮次生代谢物,具有多种生物学功能,如植物着色、促进花粉和种子传播、抵御紫外线伤害、抗低温等[6]。此外,花青素还具有抗氧化、抗炎、保护视力、抗肿瘤等功能[7]。花青素是以苯丙氨酸为直接合成前体,通过类黄酮途径合成的,涉及多种结构基因和转录因子的表达与调控。在植物细胞中,花青素通常不能以单体形式存在,而是在类黄酮糖基转移酶(UFGT)的催化下与糖苷结合形成稳定的花青素苷[8],在谷胱甘肽–S–转移酶(GST)的作用下从细胞质运输到液泡中储存起来[9]。
转录因子可形成复合物,通过与结构基因的启动子结合或调控其他类型的转录因子,来抑制或促进花青素合成途径中结构基因的表达,影响花青素的积累。其中,由MYB、bHLH和WD40蛋白组成的MBW复合物受到广泛关注[10]。MYB转录因子是植物中最大的转录因子家族之一,也是植物花青素生物合成过程中最重要的调控因子[11]。在成熟的苹果果实中,MdMYB1的表达与果实红皮部分花青素的合成密切相关[12]。bHLH转录因子是调控花青素合成的第二大类转录因子家族。辣椒中CabHLH1可直接与DFR启动子结合,激活类黄酮的表达[13]。研究[14]发现,WD40转录因子也参与调控花青素的合成。
近年来,有关辣椒花青素的研究报道较多,但主要集中在辣椒果实中[15–17],对辣椒茎中花青素的相关报道较少。CHEN等[18]研究发现,CaHY5直接调控花青素的生物合成与运输,控制辣椒下胚轴花青素的积累,可作为苗期形态鉴定的关键基因。为探究影响辣椒茎中花青素生物合成的关键基因及调控机制,本研究中,以突变体和野生型辣椒ST–8的茎为材料进行转录组测序分析,以明确其关键基因及调控机制,旨在为辣椒茎中花青素合成相关基因的鉴定及功能分析提供参考。
1 材料与方法
1.1 材料
从樟树港辣椒(ST–8)的突变体库中筛选出1个稳定遗传的绿茎突变体,该突变体由EMS诱变获得,由湖南农业大学园艺学院提供。2021年2月,将野生型ST–8及突变体的种子播种于育苗穴盘中,在湖南农业大学的人工气候温室中培养,16 h光照(25 °C),8 h黑暗(20 °C),光照度为24 000 lx,相对湿度为65%。幼苗长至4叶1心后移至单个营养钵(直径17 cm)于温室中常规栽培。分别采集ST–8和开花期植株的茎,3次生物学重复,液氮速冻后置于–80 ℃冰箱保存,用于转录组测序和qRT–PCR分析。
1.2 花青素含量测定
分别采集及ST–8开花期植株的茎,采用植物花青素检测试剂盒(上海茁彩生物科技有限公司出品)测定茎中花青素的含量。
1.3 转录组差异基因分析
分别采集及ST–8开花期植株的茎,使用TransZol试剂盒(北京全式金生物技术股份有限公司出品)提取RNA。利用Illumina HiSeq™ X–Ten平台进行PE双末端测序(由百迈克生物科技有限公司完成),每个样本设置3个生物学重复。利用FastQC(v0.11.5)[19]和Trimmomatic(v0.36)[20]过滤低质量读段,运用Tophat2(v2.1.1)[21]将过滤后得到的读段比对到辣椒‘Zunla’参考基因组上,以获得高质量读段。采用DESeq2对高质量读段进行差异表达基因分析,筛选阈值设置为|log2|≥1(为差异倍数),错误发现率<0.05,基因表达量用值(每1000个碱基转录每百万映射读取的片段)表示[22]。采用R语言ggplot2程序包进行差异表达基因主成分分析。
1.4 差异表达基因功能注释
将和ST–8的差异表达基因蛋白序列提交到Plant Transcriptional Regulatory Map online(http:// plantregmap.cbi.pku.edu.cn/go.php)进行差异表达基因GO富集注释,利用AgriGO(v2.0)[23]和WEGO 2.0[24]软件进行分析。
将和ST–8的差异表达基因蛋白序列提交到KOBAS 3.0 (http://kobas.cbi.pku.edu.cn/anno_ iden.php)在线软件进行KEGG通路富集分析,利用R语言ggplot2程序包将分析结果可视化。
1.5 实时荧光定量PCR分析(qRT–PCR)
使用HiScript® IIQ RT SuperMix(+gDNAwiper) 试剂盒(Vazyme Biotech Co. Ltd,美国)将ST–8和茎的RNA反转录为cDNA,再将cDNA样品稀释至100 ng/μL,用于qRT–PCR分析,反应体系为:10 μL SYBR qPCR Master Mix,0.4 μL引物,7.2 μL ddH2O和2 μL稀释cDNA。利用Primer Premier 5.0设计特异性引物,以为内参基因,引物序列如表1所示。使用罗氏LightCycle® 96实时荧光定量PCR仪进行qRT–PCR分析,设置3个重复,采用公式2–ΔΔCt计算基因相对表达量。

表1 qRT–PCR引物序列
2 结果与分析
2.1 表型分析
观察突变体和野生型ST–8的表型特征,发现野生型ST–8的茎总体呈绿色,带有紫色,茎节间为明显的紫色,而突变体的茎为均匀的绿色。对花青素含量进行测定,ST–8的茎中花青素含量为188.04 μg/g,突变体花青素含量只有17.19 μg/g,二者差异极显著。
2.2 转录组测序数据质量控制
采用高通量测序技术对绿茎和ST–8紫茎共6个样本(3次重复)进行转录组测序。去除低质量读段后,各样本过滤后平均读段为21 277 448个,读段总碱基数为5.99~6.80 Gbp,平均为6.37 Gbp。过滤后数据的Q20指标均大于96%,Q30指标均大于91%,GC含量为42.64%~43.79%(表2)。
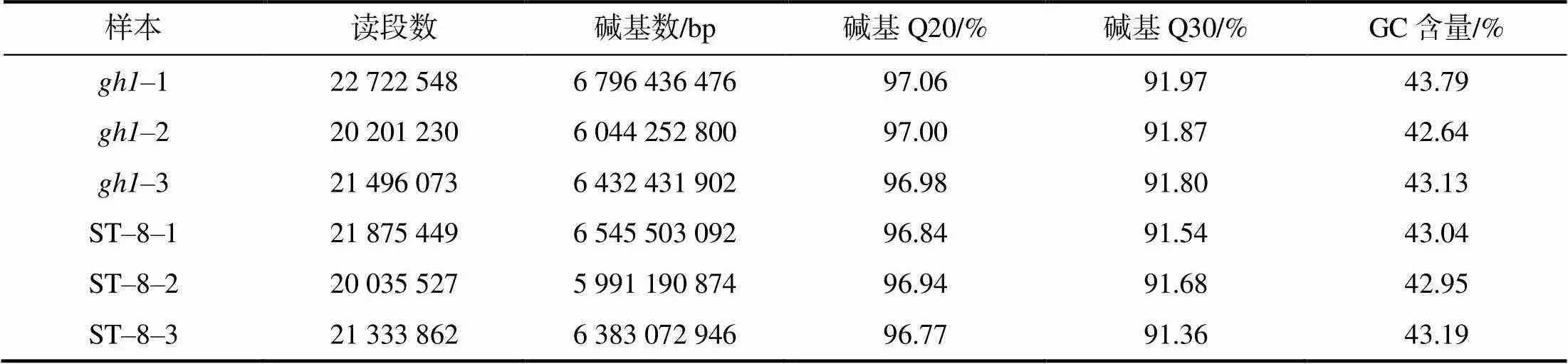
表2 RNA–seq样本数据质量评估
为了明确各样本之间的相关性,对差异表达基因进行主成分分析,结果如图1所示。PC1、PC2的方差百分比分别为44.7%和18.9%,和ST–8的组内聚集效果和组间分离趋势差异明显,说明该测序数据质量较高,可以满足转录组分析的要求。

图1 差异表达基因的主成分分析
2.3 差异表达基因的鉴定及功能富集分析
采用DESeq2软件,定义样本之间|log2|≥1,错误发现率<0.05的基因为差异表达基因,其中将log2≥1的基因定义为上调表达基因,log2≤–1的基因为下调表达基因。结果显示,突变体与野生型相比,共获得1794个差异表达基因(DEGs),其中1003个(56%)上调表达,791个(44%)下调表达。
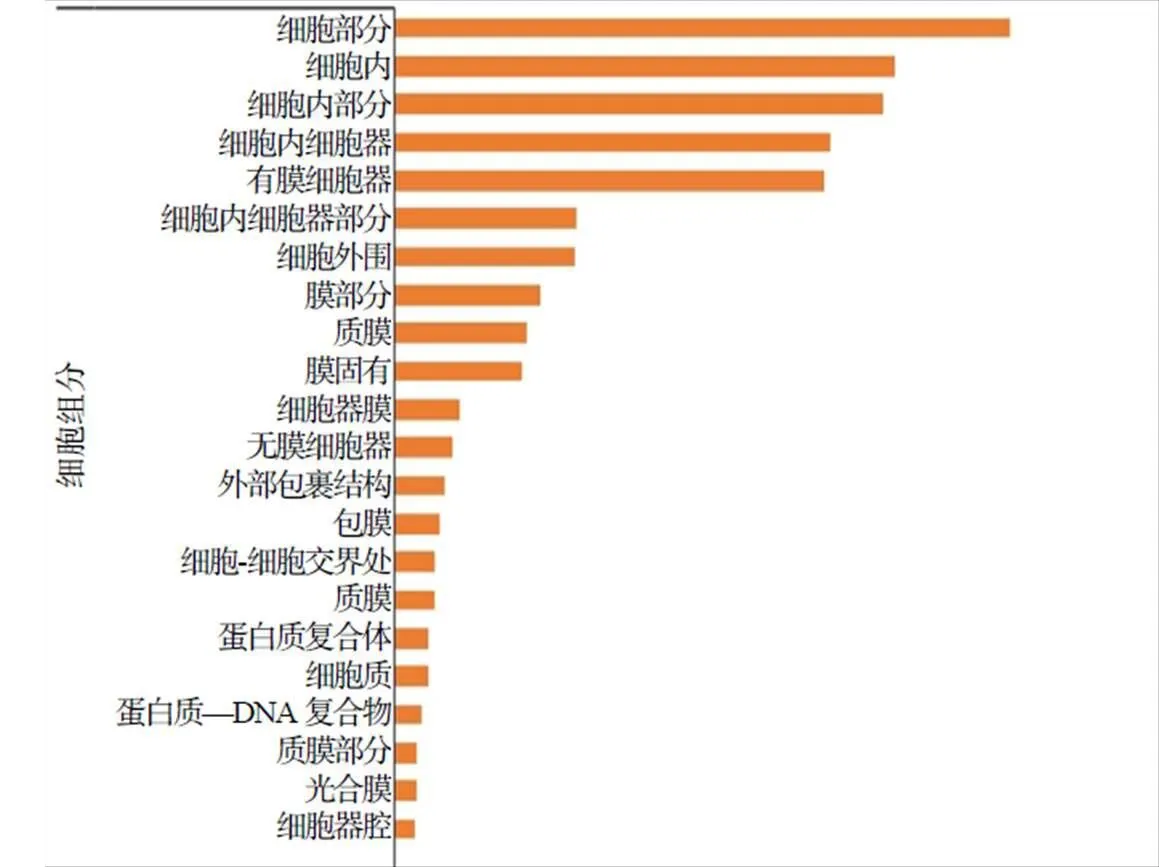
将转录组测序获得的差异表达基因(DEGs)进行GO富集分析。由图2可知,DEGs广泛富集在细胞组分、生物过程和分子功能3大类。在细胞组分类别中,有269个基因富集在细胞内,占总基因数量的23.2%;263个(22.7%)基因存在于细胞内部分;235个(20.3%)基因存在于细胞内细胞器。在分子功能类别中,杂环化合物结合和有机环化合物结合均有395个(34.1%)基因富集,有353个基因(30.5%)富集于离子结合。在生物过程类别中,有314个基因(27.1%)富集在有机物代谢过程,287个(24.8%)基因存在于初级代谢过程,259个(22.4%)基因富集在细胞代谢过程。以上结果表明,和ST–8的差异表达基因在代谢过程中发挥着重要作用,推测其可能是造成与ST–8茎颜色差异的原因之一。
为了明确差异表达基因的代谢通路,将差异表达基因进行KEGG通路富集分析。如表3所示,共有780个差异表达基因注释到103条代谢通路中。有166个差异表达基因富集在代谢途径中,占总基因数的21.28%;107个(13.72%)差异表达基因富集于次生代谢物生物合成;少部分差异表达基因富集在MAPK信号途径–植物、植物–病原体互作、植物激素信号转导、苯丙素生物合成、玉米素生物合成和类黄酮生物合成等途径中。此外,有5条特异性富集通路(富集度>0.2),分别为单萜生物合成、油菜素甾醇生物合成、类黄酮生物合成、不饱和脂肪酸的生物合成、倍半萜生物合成和三萜生物合成途径。推测和ST–8茎中的差异表达基因可能与次生代谢物的生物合成过程相关。
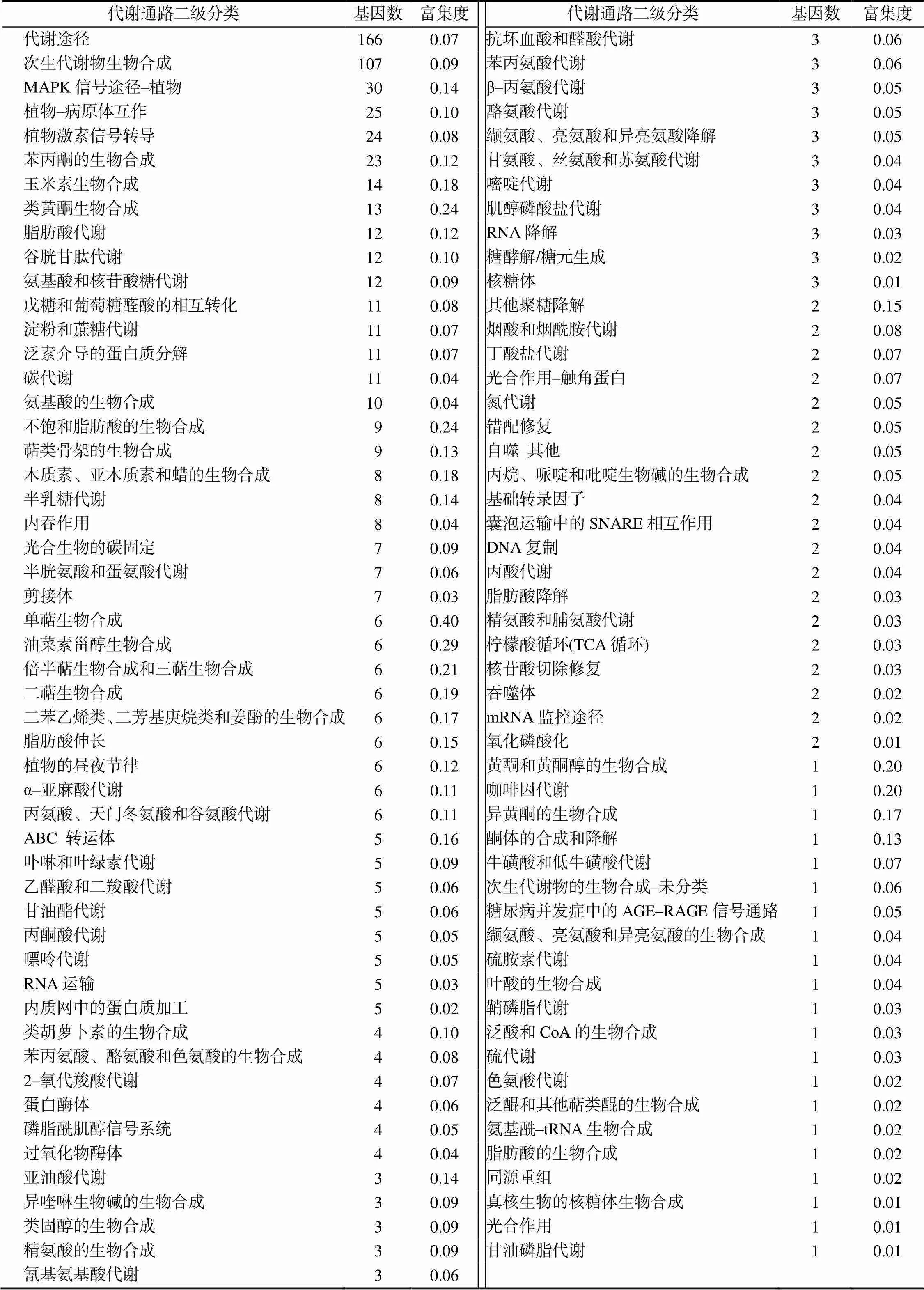
表3 差异表达基因KEGG通路富集分析结果
2.4 花青素合成相关基因的表达量分析
根据转录组分析结果,筛选出与花青素生物合成途径有关的结构基因和转录因子(图3),分别为。其中,在ST–8紫茎中,的表达量均明显高于绿茎中的表达量,而的表达量均低于的,的表达量无明显差异。

图3 参与花青素合成途径候选基因的表达量热图
2.5 qRT–PCR验证与关键基因的筛选
为了验证测序结果的可靠性,采用qRT–PCR分析ST–8和茎中与花青素合成相关的基因的相对表达量。如图4所示,花青素合成通路的上游基因(、)在ST–8茎中的表达量显著高于的,花青素合成通路中间基因()的表达量无显著差异,下游基因()在ST–8茎中的表达水平显著高于的。此外,在ST–8茎中转录因子()的表达水平也显著高于突变体。对比qRT–PCR的分析结果和转录组测序结果,二者趋势基本一致,说明测序结果可靠。推测至少有4个结构基因()和1个转录因子()是影响辣椒茎中花青素生物合成的关键基因。

A 植物花青素生物合成途径;B ST–8与gh1茎中花青素通路基因的qRT–PCR分析结果。“*”“**”“***”分别表示材料间的差异在0.05、0.01、0.001水平具有统计学意义。
3 结论与讨论
基于基因测序技术的发展及公布的辣椒基因组序列,辣椒分子育种技术得到快速发展[25]。使用EMS作为诱变剂,具有易操作、成本低、专一性强、产生点突变频率高、染色体畸变频率低等优势[26]。YANG等[27]通过EMS诱变构建了辣椒突变体库,筛选出辣椒矮秆突变体。李月[28]通过EMS诱变获得辣椒突变群体,筛选并培育了稳定的抗炭疽病辣椒品种。在辣椒分子育种中,利用EMS诱变创制新种质是提高育种效率的有效方法[29]。
颜色是辣椒的一个重要表型特征,是辨识辣椒物种类别、成熟度和进化特征的重要指标[9]。目前关于辣椒果实颜色的研究报道[30–33]较多,而对茎颜色的研究较少。本研究中,从EMS诱变的ST–8突变体库中筛选出了1个稳定遗传的绿茎辣椒突变体材料,对突变体的绿茎和野生型的紫茎进行花青素含量测定后发现,二者的花青素含量具有极显著差异,突变体的茎中几乎不含花青素,说明野生型的茎所呈现的紫色与花青素的合成与积累有关。为了探究影响辣椒茎中花青素生物合成的关键基因,采用转录组测序技术和qRT–PCR技术对突变体和野生型的茎进行差异表达基因分析。转录组测序结果显示,在野生型紫茎中的表达水平均显著高于突变体的,的表达水平均低于突变体的,而的表达水平二者之间无明显差异。为验证转录组测序结果的可靠性,进一步对ST–8和茎中与花青素合成相关的基因进行qRT–PCR分析,结果表明,在野生型茎中和的表达量均显著高于突变体,分析结果与转录组测序结果基本一致。推测至少有4个结构基因()和1个转录因子()参与调控辣椒茎中花青素的生物合成。植物花青素的代谢调控机制复杂,其结构基因与转录因子形成了一个庞大的调控网络,且花青素的合成与积累易受环境因素的影响,本研究筛选出的影响辣椒茎中花青素合成的关键基因,还需进一步研究,以验证其功能。
[1] 邹学校,马艳青,戴雄泽,等.辣椒在中国的传播与产业发展[J].园艺学报,2020,47(9):1715–1726.
[2] 邹学校,朱凡.辣椒传入中国的途径与传播路径[J].湖南农业大学学报(自然科学版),2020,46(6):629–640.
[3] SALEH B K,OMER A,TEWELDEMEDHIN B. Medicinal uses and health benefits of chili pepper(spp.):a review[J].MOJ Food Processing & Technology,2018,6(4):325–328.
[4] 王维亮.辣椒精深加工项目的探讨和介绍[J].辣椒杂志,2009,7(2):34–37.
[5] 刘莉.辣椒干制及干燥过程模型的建立[D].乌鲁木齐:新疆农业大学,2018.
[6] 王国栋.蓝莓叶片响应低温转色的代谢和分子基础及关键转录因子的调控功能研究[D].泰安:山东农业大学,2022.
[7] 乔廷廷,郭玲.花青素来源、结构特性和生理功能的研究进展[J].中成药,2019,41(2):388–392.
[8] 刘淑华,臧丹丹,孙燕,等.花青素生物合成途径及关键酶研究进展[J].土壤与作物,2022,11(3):336–346.
[9] LIU Y H,LV J H,LIU Z B,et al.Integrative analysis of metabolome and transcriptome reveals the mechanism of color formation in pepper fruit(L.)[J].Food Chemistry,2020,306:125629.
[10] WANG J,LIU Y,TANG B Q,et al.Genome-wide identification and capsaicinoid biosynthesis-related expression analysis of thegene family inL.[J].Frontiers in Genetics,2020,11:598183.
[11] 梁玉镯,陈新娜,陈东亮,等.MYB转录因子调控植物花青素生物合成研究进展[J].江苏农业科学,2022,50(22):55–64.
[12] TAKOS A M,JAFFÉ F W,JACOB S R,et al. Light-induced expression of agene regulates anthocyanin biosynthesis in red apples[J].Plant Physiology,2006,142(3):1216–1232.
[13] ZHANG Z S,LIU Y,YUAN Q L,et al.The bHLH1-DTX35/DFR module regulates pollen fertility by promoting flavonoid biosynthesis inL.[J].Horticulture Research,2022,9:uhac172.
[14] 王刚.红花基因家族分析及基因克隆与功能初步研究[D].长春:吉林农业大学,2020.
[15] TANG B Y,LI L,HU Z L,et al.Anthocyanin accumulation and transcriptional regulation of anthocyanin biosynthesis in purple pepper[J].Journal of Agricultural and Food Chemistry,2020,68(43):12152–12163.
[16] FILYUSHIN M A,DZHOS E A,SHCHENNIKOVA A V,et al.Dependence of pepper fruit colour on basic pigments ratio and expression pattern of carotenoid and anthocyanin biosynthesis genes[J].Russian Journal of Plant Physiology,2020,67(6):1054–1062.
[17] ZHOU Y,MUMTAZ M A,ZHANG Y H,et al. Response of anthocyanin accumulation in pepper () fruit to light days[J].International Journal of Molecular Sciences,2022,23(15):8357.
[18] CHEN R,YANG C,GAO H,et al.Induced mutation inabolishes anthocyanin accumulation in the hypocotyl of pepper[J]. Theoretical and Applied Genetics,2022,135(10):3455–3468.
[19] BROWN J,PIRRUNG M,MCCUE L A.FQC Dashboard:integrates FastQC results into a web-based,interactive,and extensible FASTQ quality control tool[J].Bioinformatics,2017,33(19):3137–3139.
[20] BOLGER A M,LOHSE M,USADEL B. Trimmomatic:a flexible trimmer for Illumina sequence data[J]. Bioinformatics,2014,30(15):2114–2120.
[21] KIM D,PERTEA G,TRAPNELL C,et al. TopHat2:accurate alignment of transcriptomes in the presence of insertions,deletions and gene fusions[J]. Genome Biology,2013,14(4):R36.
[22] LOVE M I,HUBER W,ANDERS S.Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2[J].Genome Biology,2014,15(12):550.
[23] TIAN T,LIU Y,YAN H Y,et al.agriGO v2.0:a GO analysis toolkit for the agricultural community,2017 update[J].Nucleic Acids Research,2017,45(W1):W122–W129.
[24] YE J,ZHANG Y,CUI H H,et al.WEGO 2.0:a web tool for analyzing and plotting GO annotations,2018 update[J].Nucleic Acids Research,2018,46(W1):W71–W75.
[25] 王立浩,张宝玺,张正海,等.“十三五”我国辣椒育种研究进展、产业现状及展望[J].中国蔬菜,2021(2):21–29.
[26] 谢玲玲,周火强,弭宝彬,等.EMS诱变技术研究概况及应用进展[J].湖南农业科学,2020(6):92–95.
[27] YANG B Z,ZHOU S D,OU L J,et al.Construction of mutant population and analysis of dwarf mutants in “6421”(L.)through EMS mutagene- sis[J].Agricultural Science & Technology,2016,17(6):1322–1325.
[28] 李月.辣椒炭疽病病原菌分离及辣椒突变体炭疽病抗性筛选[D].武汉:华中农业大学,2021.
[29] ARISHA M H.利用EMS诱变创制辣椒新种质的研究[D].杨凌:西北农林科技大学,2015.
[30] 刘宇华.基于转录组学与靶向代谢组学解析辣椒果实颜色的形成[D].长沙:湖南大学,2020.
[31] 霍瑞春.不同辣椒品质检测及辣椒红素合成相关基因、表达分析[D].包头:内蒙古科技大学,2022.
[32] 冯鹏龙.辣椒不同果色类胡萝卜素相关基因的克隆及调控机理研究[D].西宁:青海大学,2022.
[33] 周燕.辣椒果实紫色性状的光响应及遗传研究[D].海口:海南大学,2021.
Transcriptome and differential expression analysis of green stem mutantin
DAI Yao1,2,3,WANG Jin1,2,3,DAI Li1,2,3,HE Changzheng1,2,3,LIU Feng1,2,3*
(1.College of Horticulture, Hunan Agricultural University, Changsha, Hunan 410128, China; 2.ERC for Germplasm Innovation and New Variety Breeding of Horticultural Crops, Changsha, Hunan 410128, China; 3.Key Laboratory for Vegetable Biology of Hunan Province, Changsha, Hunan 410128, China)
EMS-induced pepper green stem mutantand wild-type purple stem ‘Zhangshugang’ (ST-8) were used as materials in this study, and the anthocyanin content was determined. Transcriptome sequencing (RNA-seq) and real-time fluorescence quantitative PCR (qRT-PCR) were used to analyze the gene expression levels related to anthocyanin biosynthesis in pepper stems. The results showed that the anthocyanin content in the stem of mutantwas significantly lower than that in the stem of ST-8. Compared with ST-8,obtained 1794 differentially expressed genes, including 1003 up-regulated genes and 791 down-regulated genes. Among them, genes related to anthocyanin biosynthesis pathway include 9 structural genes (,,,,,,,,and 3 transcription factors (,,). Transcriptome expression analysis and qRT-PCR analysis were performed on differentially expressed genes related to anthocyanin synthesis. The results of the two analyses were basically the same. Four structural genes (,,,) and one transcription factor (were screened. It is speculated that these five genes might play an important role in the anthocyanin biosynthesis pathway in pepper stems.
pepper; stem; transcriptome; differentially expressed genes; anthocyanins; mutant
S641.3;Q786
A
1007–1032(2023)05–0567–08
戴垚,王瑾,戴丽,何长征,刘峰.辣椒绿茎突变体转录组及候选基因表达分析[J].湖南农业大学学报(自然科学版),2023,49(5):567–574.
DAI Y,WANG J,DAI L,HE C Z,LIU F.Transcriptome and differential expression analysis of green stem mutantin[J].Journal of Hunan Agricultural University (Natural Sciences), 2023, 49(5):567–574.
http://xb.hunau.edu.cn

2023–02–23
2023–10–09
岳麓山种业创新项目(2021NK1006);特色蔬菜产业技术体系(CARS–24–A–15)
戴垚(1999—),女,湖南邵阳人,硕士研究生,主要从事辣椒分子遗传育种研究,3501510879@qq.com;*通信作者,刘峰,博士,研究员,主要从事辣椒种质资源重要性状功能基因挖掘及新种质创制研究,liufengrich@126.com
10.13331/j.cnki.jhau.2023.05.010
责任编辑:毛友纯
英文编辑:柳正
