经颈静脉入路行经导管肺动脉瓣置换术治疗重度肺动脉瓣反流一例
2023-11-18丁建东徐荣丰张晓黎丁秀霞陆新健陆启同赵振章晓国马根山
丁建东,徐荣丰,张晓黎,丁秀霞,陆新健,陆启同,赵振,章晓国,马根山
(东南大学附属中大医院 1.心内科,2.麻醉科,3.心胸外科,4.放射科,江苏 南京 210009)
右室流出道(right ventricular outflow tract,RVOT) 功能障碍见于多种先天性心脏病(congenital heart disease,CHD),主要包括法洛四联症、肺动脉闭锁合并室间隔缺损、右心室双出口和其他锥管畸形等[1]。尽管近几十年来CHD的外科治疗有了巨大的发展,但涉及RVOT的手术仍可能导致肺动脉瓣反流,因此需要再次手术或行经导管肺动脉瓣置换术(transcatheter pulmonary valve replacement,TPVR)[2]。最近,TPVR已通过使用Melody瓣膜(Medtronic, Minneapolis, MN)或SAPIEN瓣膜(Edward Lifescience, Irvine, CA, USA)的几项大规模研究进行了验证[3-4]。然而,由于RVOT扩张,大多数患者不建议使用这两种瓣膜[3,5],特别是在我国超过85%的ROVT功能障碍患者接受了跨瓣补片的RVOT扩大术,其 ROVT直径一般大于24 mm,Melody瓣膜和SAPIEN瓣膜均不适用于我国患者[6]。出于这些原因,设计适合我国患者的瓣膜支架迫在眉睫。Venus P-Valve(Venus MedTech Inc., Hangzhou, China)是一种自膨胀经皮瓣膜,旨在解决这个问题,它的自膨胀设计可以适应RVOT直径高达32~33 mm的瓣膜[5,7-8]。
TPVR操作常规通过股静脉途径完成,不能通过该途径一般被视为禁忌证。通过颈静脉途径进行TPVR增加了手术的难度和风险。我们报告国内首例因下腔静脉发育变异,下腔静脉直接延续奇静脉汇到上腔静脉,经右颈内静脉途径应用Venus P-Valve瓣膜施行TPVR的成功病例。
1 临床资料
1.1 一般资料
患者,女,47岁。2005年在我院因右心室流出道狭窄及肺动脉瓣狭窄,行右心室流出道疏通及跨肺动脉瓣环补片加宽术。近5年来无明显诱因下突发心悸,自觉心跳节律不规整,持续时间1~2 h,伴有活动后胸闷、气喘、恶心、呕吐,有时夜间不能平卧睡眠。多次在我院住院,应用利尿剂治疗后症状稍好转,仍有上述症状反复发作。入院查体:胸廓无畸形,前胸部可见陈旧性手术瘢痕长约20 cm,两肺呼吸音粗,双下肺呼吸音低,心尖搏动位于第5肋间左锁骨中线外侧1 cm处,心率90 次·min-1,律不齐,第一心音强弱不等,胸骨左缘第2肋间可闻及中度舒张期杂音。双下肢轻度凹陷性水肿。N末端B型利钠肽原(NT-proBNP)水平476 pg·ml-1。经胸超声心动图(transthoracic echocardiography, TTE)显示右心房、右心室明显扩大,肺动脉瓣舒张期重度反流,肺动脉增宽。CTA检查示:右心房、右心室明显扩大,RVOT结构扩张,肺动脉整体结构呈瘤样扩张,肺动脉瓣环平均直径达31.6 mm,下腔静脉发育变异,下腔静脉直接延续至奇静脉汇到上腔静脉(图1)。

下腔静脉发育变异,下腔静脉直接延续至奇静脉汇到上腔静脉
1.2 治疗经过
该患者经心脏团队评估认为传统外科手术风险极高,申请通过本院伦理委员会及新技术批准,与患者及其家属反复沟通并签署知情同意书,于2023年2月19日行TPVR,并选择杭州启明医疗器械有限公司Venus P-Valve。术前半小时常规预防性使用抗生素,患者平卧于手术台,全身静脉复合麻醉,气管插管,穿刺左桡动脉监测主动脉压力,常规消毒铺巾,超声引导下穿刺右侧颈内静脉,右侧股动、静脉,静脉注射肝素(100 U·kg-1,监测ACT并使ACT>250 s),经右侧股静脉置入猪尾导管至主肺动脉,测压并双体位造影(右前斜20°+头位20°;左侧位90°)示肺动脉瓣重度反流(图2A);经右侧股动脉置入猪尾导管至主动脉根部造影显示左右冠状动脉通畅(图2B)。穿刺右侧颈内静脉,交换Lunderquist超硬导丝(Cook Medical, Bloomington, IN, USA),经上腔静脉建立通路(图2C),沿其送入34 mm AGA顺应性测量球囊,球囊完全充盈(造影剂1∶4稀释),并轻微滑动,测量RVOT、肺动脉及肺动脉瓣环的内径,及RVOT、肺动脉的长度,并确定肺动脉瓣环的位置(图2D)。根据测量结果选择P36-25型号的VenusP-Valve,沿Lunderquist超硬导丝送入输送器,送至肺动脉分叉处开始缓慢释放瓣膜,直到至瓣膜释放完成,位置形态良好(图3)。肺动脉造影无瓣周漏(图4A),主动脉根部造影显示血流通畅无压迫(图4B),选择性冠状动脉造影显示血流通畅,无压迫(图4C),TTE显示无瓣周漏,Venus P-Valve支架形态良好,肺动脉瓣反流得到显著改善(图4D)。确认无并发症后,8字缝合右侧颈内静脉入口并纱布包扎,麻醉复苏,安返病房。术后继续抗凝治疗,并静脉应用抗生素3 d,患者胸闷、气喘症状减轻,3 d后复查TEE及胸部CT示Venus P-Valve位置正常,功能良好,5 d后出院。

A.造影示肺动脉瓣重度反流;B.主动脉根部造影显示血流通畅无压迫;C.穿刺右侧颈内静脉,建立轨道;D.球囊测量
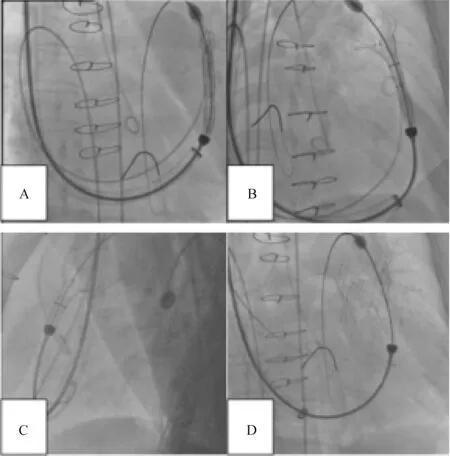
A.Venus P-Valve起始部位的展开;B、C.Venus P-Valve中心部分的展开;D.Venus P-Valve在适当位置完全释放

A.造影无瓣周漏;B.主动脉根部造影显示左右冠状动脉通畅;C.选择性冠状动脉造影显示血流通畅,无压迫;D.TTE显示Venus P-Valve支架形态良好
2 讨 论
CHD患者中约20%伴有RVOT功能障碍,这些患者行外科矫治过程中普遍行RVOT跨环补片,以解除RVOT及肺动脉狭窄,但常常导致肺动脉瓣环扩大,导致明显的肺动脉瓣反流[9]。肺动脉瓣反流患者早期常无明显症状,长期肺动脉瓣反流可导致右心负荷增加、右心扩大,继而引起右心功能障碍、心律失常,甚至猝死[10],可能需要额外的手术干预来恢复肺动脉瓣的功能。但再次体外循环直视下开胸不仅手术难度大,且术中耗时久、术后恢复时间长,患者接受度差[6, 9-11]。
TPVR是一种创伤较小的恢复肺动脉瓣膜功能的技术,这种方法的一个关键好处是避免额外的心脏直视手术[11]。2000 年,Bonhoeffer等[12]将第一个经导管瓣膜植入人体,随后的研究批准Melody瓣膜和Sapien XT瓣膜的临床应用[3-4],但这两种瓣膜均属于球囊扩张瓣膜,受限于RVOT直径的大小,适用于RVOT直径小于29 mm患者[3-4,6,9]。本例患者2005年行右心室流出道疏通及跨肺动脉瓣环补片加宽术,术后出现肺动脉瓣反流,导致RVOT结构扩张,肺动脉整体结构呈瘤样扩张,术前CTA示肺动脉瓣环平均直径达31.6 mm,术中球囊测量RVOT直径(32.81 mm)大于29 mm,Melody 瓣膜和Sapien XT瓣膜均不适用该患者,我们选择了P36-25型号的Venus P-Valve瓣膜。Venus P-Valve是由猪心包制成的三叶瓣膜,并手工缝合到自膨胀框架上,支架的近端和远端扩张至RVOT和肺动脉分叉处的瓣膜。近端扩张部被心包组织覆盖,而远端扩张部是一个开放的金属丝框架,以避免肺动脉分支阻塞。中间部分也被心包和瓣膜完全覆盖。近端火炬处有3个不透射线的铂标记,用于识别瓣膜位置。它的自膨胀设计可以适应 RVOT直径高达32~33 mm的瓣膜[5-6,8],无需扩张球囊,相比于前两种支架,Venus P-Valve适应证更广、价格更便宜、操作更简单、并发症更少,更适合于国人应用[6]。
本例患者下腔静脉发育变异,来自身体下部的血液通过奇静脉排出,奇静脉不直接连接到右心房,而是在返回右心房之前与上腔静脉形成锐角。股静脉入路是TPVR的经典途径,但对于下腔静脉中断伴奇静脉延续的患者,由于奇静脉的轨迹更长且更曲折,使得经导管介入治疗更加复杂,通过颈静脉途径术中需要将Venus P-Valve等器械放置在患者头部(患者右侧),并需要额外的工作台,同时需适当将荧光屏及超声心动图屏幕放置在医生面前,以便充分可视化。超声心动图仪位于患者左侧,麻醉师位于床脚。目前国外仅有1例患者通过颈静脉途径使用Venus P-Valve完成TPVR[2]。本例为国内首次应用Venus P-Valve经颈静脉途径完成TPVR术的病例。
总之,经颈静脉入路对下腔静脉发育变异伴奇静脉延续的患者进行TPVR是可行和安全的。准确的术前诊断、详细的计划和创新的技术对于安全和成功干预至关重要。
