HSPA1A受HOTAIR/miR-590-3p轴调控促进I/R诱导的心肌梗死大鼠体内NF-κB介导的炎症反应
2023-11-18刘超群,梁丽艳,刘顺民等
急性心肌梗死(AMI)是严重的心血管疾病,是全球心血管疾病相关死亡的主要原因[1-2]。治疗AMI的主要方法是溶栓和经皮冠状动脉介入治疗(PCI),但PCI可能会导致心肌缺血再灌注(I/R)损伤,进而引起诸多不良反应[3]。因此仍需深入研究AMI更确切的发展机制。核因子-κB(NF-κB)信号通路是I/R诱导的AMI心肌细胞炎症损伤中的关键角色[4]。最新研究表明,热休克70 kDa蛋白1A(HSPA1A)在AMI小鼠心肌组织中表达明显上调[5],然而HSPA1A的激活是否积极参与调控AMI的炎症反应还不清楚。
长链非编码RNA(lncRNA)是一种超过200个核苷酸的非编码RNA,对基因表达调节具有重要作用[6]。在I/R过程中,许多lncRNA高温转录物反义RNA(HOTAIR)出现异常表达,并调控心肌炎症损伤[7]。微小RNA(miRNA)在心血管疾病和心肌I/R损伤中也发挥着重要作用,如miR-590-3p可以抑制心肌组织中的炎症反应[8]。本研究旨在研究HSPA1A在AMI大鼠炎症反应中的作用,并探讨是否被HOTAIR和miR-590-3p密切调控从而介导心肌I/R损伤和炎症反应。
1 材料与方法
1.1 材料
苏木素-伊红(HE)染色试剂盒、酶联免疫吸附测定(ELISA)试剂盒、四甲基偶氮唑蓝(MTT)试剂盒均购于上海碧云天生物科技有限公司。TRIzol®试剂购于日本TaKaRa Biotechnology公司。Quant One Step 实时定量PCR(RT-qPCR)试剂盒购于北京天根生物科技公司。Lipofectamine 3000购于美国Invitrogen公司。H9C2细胞购于武汉普诺赛生物公司。miR-590-3p拟似物(mimic)、mimic的阴性对照(mimic-NC)、过表达重组质粒(pcDNA3.0)-HSPA1A(pc-HSPA1A)、小干扰RNA重组质粒(siRNA)-HSPA1A(si-HSPA1A)、si-HSPA1A阴性对照(si-NC)、小干扰RNA重组质粒(siRNA)-HOTAIR(si-HOTAIR)、si-HOTAIR阴性对照(si-NC2)均购于上海吉凯基因医学科技公司。兔抗-磷酸甘油醛脱氢酶(GAPDH)、HSPA1A、NF-κB P65、磷酸化的NF-κB P65(p-NF-κB P65)、白细胞介素(IL)-1β、IL-6、肿瘤坏死因子-α(TNF-α)的一抗和辣根过氧化物酶(HRP)山羊抗兔免疫球蛋白 G(IgG)的二抗均购于美国Abcam公司。pGL3双荧光素酶miRNA-基因表达载体购于美国Promega公司。
1.2 I/R大鼠模型建立和分组
36只新生斯普拉格-杜勒(SD)大鼠(1~2日龄)由新疆医科大学实验动物中心提供。I/R损伤模型的建立参照既往研究。大鼠术前禁食12 h,用水合氯醛(400 mg·kg-1)麻醉。大鼠以仰卧位固定,四肢连接12导联心电图。气管与颈部分离,使用呼吸机保持大鼠呼吸顺畅[呼吸频率60次·min-1,气流速率2 ml·(100 g)-1],胸骨左侧第3肋间隙沿纵隔切开心包。用2~3 mm缝合针插入左心耳,结扎下放置直径1.5 mm的乳胶管。结扎收紧,造成心肌缺血,阻断冠状动脉血流。30 min后松开结扎,血流灌注2 h,形成I/R损伤模型。所有实验均经我院伦理委员会批准。
为研究HOTAIR和HSPA1A对I/R大鼠心肌损伤和炎症因子的影响将新生大鼠分为6组:假手术组,仅开胸骨左侧第3肋间隙后直接缝合;I/R组,按照上述造模方法行I/R造模,造模2 h开始静脉注射2 ml生理盐水,1次·d-1,持续1周;I/R+si-NC组,I/R造模后2 h开始静脉注射5 mg·kg-1si-NC,1次·d-1,持续1周;I/R+si-HSPA1A组,I/R造模后2 h开始静脉注射5 mg·kg-1si-HSPA1A,1次·d-1,持续1周;I/R+si-HOTAIR组,I/R造模后2 h开始静脉注射5 mg·kg-1si-HOTAIR,1次·d-1,持续1周;I/R+si-NC2组,I/R造模后2 h开始静脉注射5 mg·kg-1si-NC2,1次·d-1,持续1周。各组处理完成后让大鼠安乐死,分离心肌组织和血清,保存于-80 ℃。
1.3 体外缺氧/复氧(H/R)心肌细胞模型建立和分组
大鼠心肌来源的H9C2细胞系来源于中国科学院细胞库(中国,上海)。H9C2细胞在含有10%胎牛血清(95%空气,5% CO2, 37 ℃)的杜氏改良培养基(DMEM)中培养。培养48 h后,将H9C2细胞暴露在含1% O2、94% N2和5% CO2的气体中24 h,然后将细胞置于常规培养箱(95%空气、5% CO2、37 ℃)中维持12 h,建成H/R H9C2细胞模型。
为研究HOTAIR和HSPA1A对H/R细胞炎症反应的影响,将H9C2细胞分为4组:Ctrl组,95%空气,5% CO2, 37 ℃持续培养;H/R组,将细胞暴露在含1% O2、94% N2和5% CO2的气体中24 h,然后在95%空气、5% CO2、37 ℃培养12 h;H/R+si-HSPA1A组,同H/R组的培养条件,且H/R模型诱导的培养基中含2 μg·ml-1si-HSPA1A和1% Lipofectamine 3000;H/R+si-HSPA1A+pc-HSPA1A组,同H/R组的培养条件,且H/R模型诱导的培养基中含2 μg·ml-1si-HSPA1A、2 μg ·ml-1pc-HSPA1A、1% Lipofectamine 3000。收集各组细胞保存于-80 ℃。
为研究H9C2细胞中miR-590-3p对HSPA1A表达的调控以及HOTAIR对miR-590-3p表达的调控作用,将H9C2细胞分为4组:mimic-NC组,常规培养,且培养基中含0.5 mg·ml-1mimic-NC和1% Lipofectamine 3000;mimic组,常规培养,且培养基中含0.5 mg·ml-1mimic和1% Lipofectamine 3000;si-NC2组,常规培养,且培养基中含0.5 mg·ml-1si-NC2和1% Lipofectamine 3000;si-HOTAIR组,常规培养,且培养基中含0.5 mg·ml-1si-HOTAIR和1% Lipofectamine 3000。各组培养36 h后收集细胞保存于-80 ℃。
1.4 Western blot
将1.2中保存的心肌组织和1.3中保存的H9C2细胞置于裂解缓冲液中裂解30 min(4 ℃)。1.0 mg总蛋白通过10% SDS聚丙烯酰胺凝胶电泳分离,然后转移到硝化纤维膜。用5%脱脂牛奶封闭膜。心肌组织使用兔抗-HSPA1A(1∶600)、NF-κB P65(1∶1 000)、p-NF-κB P65(1∶1 000)的一抗进行孵育;心肌细胞使用兔抗-HSPA1A(1∶600)、IL-1β(1∶1 000)、IL-6(1∶1 000)、TNF-α(1∶1 000)的一抗进行孵育;内参蛋白均为GAPDH。然后,将膜与HRP山羊抗兔IgG(1∶20 000)进行孵育。蛋白通过薄膜扫描仪检测。用Image-pro Plus 6.0凝胶图像处理系统分析条带的灰度值。
1.5 HE染色
将保存的心肌组织用10%甲醛固定,石蜡包埋保存。切4 μm厚切片,放于载玻片上。脱蜡后经过逐渐降低酒精浓度的脱水过程(100%、95%、70%、50%乙醇),最后放入蒸馏水中洗涤10 min。将载玻片放入苏木素染液中染色10 min,使用1%酸性酒精进行脱色,直至颜色清晰;经过漂洗之后,将载玻片放入伊红溶液中染色3 min。最后经过脱水、清洗及封片,在显微镜下观察获取图片。
1.6 ELISA
按照ELISA试剂盒供应商提供的方案,检测心肌组织CK-MB、CTNI的表达以及血清IL-1β、IL-6、TNF-α的浓度。
1.7 实时荧光定量PCR(RT-qPCR)
心肌组织和H9C2细胞中的RNA样品采用TRIzol®试剂进行分离,应用Bio-Rad CFX96 PCR系统和Quant One Step RT-qPCR试剂盒进行RT-qPCR反应。循环条件为:95 ℃保持30 s,随后95 ℃保持5 s,60 ℃保持30 s,执行40个循环。所有引物设计如下:HOTAIR:正向5′-ATGGGGTGGAACTCATGATGG-3′,反向5′-AAGAATGGACATCATTTATTTCA-3′; miR-590-3p:正向5′-GCCGGCCTAATTTTATGTATAA-3′,反向5′-CAGTGCGTGTCGTGGA-3′;U6: 正向5′-GTCGTATCCAGTGCAGGGTCCGAGGTATT-3′,反向5′-CGCACTGGATACGACAAAATATGGAAC-3′;GAPDH: 正向5′-TGCACCACCAACTGCTTAGC-3′,反向5′-GGCATGGACTGTGGTCATGAG-3′。HOTAIR的CT值归一化为GAPDH, miR-590-3p的CT值归一化为U6,用2-ΔΔCt计算相对表达量。
1.8 双荧光素酶报告基因实验
利用双荧光素酶报告基因实验检测HOTAIR与miR-590-3p以及miR-590-3p与HSPA1A的3′UTR结合作用。通过PCR扩增HOTAIR中包含预测miR-590-3p结合位点的cDNA片段。然后将结合位点的假定序列克隆到pGL3双荧光素酶miRNA-基因表达载体中,构建报告载体野生型(WT)-HOTAIR。另外使HOTAIR基因中miR-590-3p的结合位点发生突变,命名为突变型(MUT)-HOTAIR。随后根据制造商的方案,使用Lipofectamine 3000将100 ng WT-HOTAIR或100 ng MUT-HOTAIR分别与mimic转染的H9C2细胞(5×104个细胞·孔-1)共转染,或使用Lipofectamine 3000将100 ng WT-HOTAIR或100 ng MUT-HOTAIR分别与mimic-NC转染的H9C2细胞(5×104个细胞·孔-1)共转染。
另外,与上述方案一致,构建报告载体pGL3-HSPA1A-3′UTR-wild-type(WT-HSPA1A)。使HSPA1A-3′UTR中miR-590-3p的结合位点发生突变,命名为pGL3-HSPA1A-3′UTR-mut(MUT-HSPA1A)。随后根据制造商的方案,使用Lipofectamine 3000将100 ng WT-HSPA1A或100 ng MUT-HSPA1A分别与mimic转染的H9C2细胞(5×104个细胞·孔-1)共转染,或使用Lipofectamine 3000将质粒100 ng WT-HSPA1A或100 ng MUT-HSPA1A分别与mimic-NC转染的H9C2细胞(5×104个细胞·孔-1)共转染。用双荧光素酶报告系统检测荧光素酶活性。
1.9 MTT实验检测H9C2细胞增殖
按照制造商说明使用MTT试剂盒检测H9C2细胞的增殖。用酶标仪(Bio-Rad)在490 nm处测量OD值。细胞增殖率=OD实验组/OD阴性对照组×100%。
1.10 统计学处理
使用GraphPad PRISM 5.01进行数据录入和统计学分析,正态分布的数据表示为均数±标准差,两组间比较采用Studentt检验,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 HSPA1A对大鼠心肌I/R损伤和炎症反应的影响
与假手术组相比,I/R组HSPA1A的蛋白表达水平显著上调(P<0.05)(图1A、表1);与I/R+si-NC组相比,I/R+si-HSPA1A组HSPA1A的蛋白表达水平显著下调(P<0.05)(图1A、表1)。HE染色结果显示,假手术组大鼠心肌细胞结构良好,细胞排列整齐,细胞核完整,细胞质均匀;而I/R组大鼠心肌细胞排列紊乱,出现细胞坏死,炎症细胞浸润;I/R+si-NC组与I/R组的组织病理学状况几乎相同;与I/R+si-NC组相比,I/R+si-HSPA1A组心肌细胞损伤明显改善(图1B),并下调了心肌组织中CK-MB和cTnI的表达(均P<0.05,表1)。

A. Western blot法检测HSPA1A的蛋白表达;B.HE染色检测心肌组织病理变化(×200);C.Western blot检测NF-κB P65和p-NF-κB P65的蛋白表达
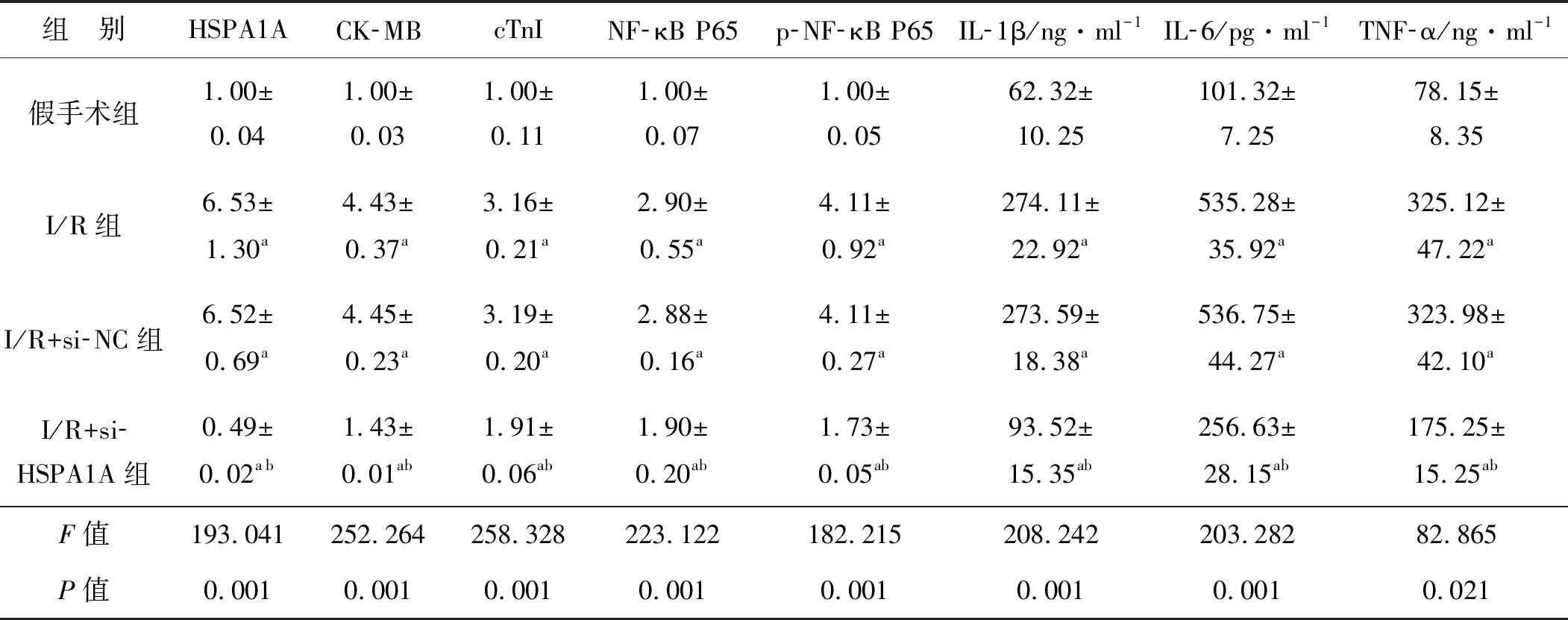
表1 I/R大鼠沉默HSPA1A后体内HSPA1A、CK-MB、cTnI、NF-κB P65、p-NF-κB P65相对表达水平和炎症因子水平的变化(n=6)
与假手术组相比,I/R组NF-κB P65和p-NF-κB P65的表达均显著上调(均P<0.05),而与I/R+si-NC组相比,I/R+si-HSPA1A组的NF-κB P65、p-NF-κB P65的表达均显著下调(均P<0.05)(图1C、表1),血清IL-6、IL-1β、TNF-α的水平均下调(均P<0.05,表1)。
2.2 HOTAIR对miR-590-3p、HSPA1A和I/R大鼠炎症反应的影响
与I/R+si-NC2组相比,I/R+si-HOTAIR组HOTAIR的表达水平显著下调(P<0.05),而miR-590-3p的表达水平上调(P<0.05),见表2。HE染色结果显示,与I/R+si-NC2组相比,I/R+si-HOTAIR组心肌细胞损伤明显改善(图2A),I/R+si-HOTAIR组心肌组织中CK-MB和cTnI的表达下调(均P<0.05,表2)。
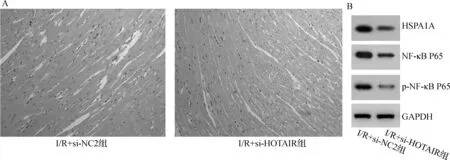
A.HE染色检测心肌组织病理变化(×100);B.Western blot检测HSPA1A、NF-κB P65和p-NF-κB P65的蛋白表达

表2 I/R大鼠沉默HOTAIR后体内HOTAIR、miR-590-3p、CK-MB、cTnI、HSPA1A、NF-κB P65、p-NF-κB P65相对表达水平和炎症因子水平的变化(n=6)
与I/R+si-NC2组相比,I/R+si-HOTAIR组的HSPA1A、NF-κB P65、p-NF-κB P65的表达均显著下调(均P<0.05,图2B、表2),血清IL-6、IL-1β、TNF-α的水平均下调(均P<0.05,表2)。
2.3 HSPA1A与miR-590-3p的靶向关系
双荧光素酶报告基因实验检测发现HSPA1A的3′-UTR可直接结合miR-590-3p(P<0.05,图3A)。在心肌细胞中,与mimic-NC组相比,mimic组中的HSPA1A蛋白表达明显下调(P<0.05,图3B)。

a P<0.05;每组n=3
2.4 HOTAIR作为“分子海绵”吸附miR-590-3p
双荧光素酶报告基因实验检测发现HOTAIR可直接结合miR-590-3p(P<0.05,图4)。在心肌细胞中,与si-NC2组miR-590-3p表达水平(1.00±0.03)相比,si-HOTAIR组的miR-590-3p表达水平(6.22±1.03)上调,差异有统计学意义(t=263.153,P=0.001)。

a P<0.05;每组n=3
2.5 HSPA1A受HOTAIR/miR-590-3p轴的调控促进I/R大鼠心肌炎症
为鉴定HSPA1A是否受HOTAIR/miR-590-3p轴的调节而干预心肌细胞炎症,将si-HOTAIR和HSPA1A过表达质粒(pc-HSPA1A)共转染到H/R诱导的H9C2细胞中。si-HOTAIR和pc-HSPA1A均表现出优异的转染效率。MTT实验显示,与H/R组相比,H/R+si-HOTAIR组上调了H/R诱导下的H9C2细胞的增殖率(P<0.05,图5A)。H/R+si-HOTAIR+pc-HSPA1A组的细胞增殖率明显低于H/R+si-HOTAIR组(P<0.05,图5A)。与H/R组相比,H/R+si-HOTAIR组显著降低了H/R诱导的H9C2细胞中HOTAIR、HSPA1A、IL-1β、IL-6和TNF-α的表达(均P<0.05,图5B~G),而H/R+si-HOTAIR+pc-HSPA1A组则显著增加了IL-1β、IL-6和TNF-α的表达(均P<0.05,图5E~G)。
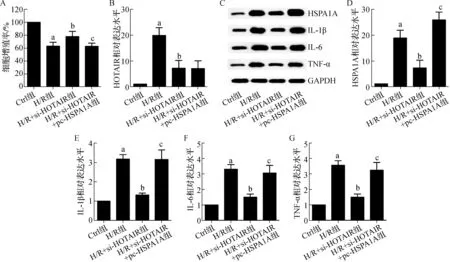
a 与Ctrl组比较,P<0.05;b 与H/R组比较,P<0.05;c 与H/R+siHORAIR组比较,P<0.05
3 讨 论
由于AMI的病理特点,应用PCI治疗血运重建会伴随I/R损伤,对损伤的心肌组织造成“二次损伤”,这可进一步导致心律失常、冠状动脉微循环障碍、心肌组织坏死、心室收缩功能下降等症状。目前,I/R损伤的机制包括活性氧(ROS)的过度产生、钙过载、心肌细胞过度凋亡和炎症反应[9-10]。因此,减少心肌梗死后心肌细胞炎症损伤,对改善心肌梗死患者的临床预后具有重要意义。
根据以往的研究,lncRNA在心血管疾病的进展中起着关键作用[11]。lncRNA通常以“分子海绵”的方式调节miRNA靶基因的表达。本研究重点是研究HOTAIR和miR-590-3p在调节心肌I/R炎症损伤和H/R诱导的心肌细胞增殖活性和炎症反应中的作用和机制。人类的HOTAIR位于染色体12q13上。基因调控研究发现,HOTAIR通过吸附miRNA从而调控下游癌基因和肿瘤抑制基因的表达[12]。此外,HOTAIR可作为肿瘤发展的致癌基因[13]。研究表明,HOTAIR还是AMI的重要中介物质[14]。在本研究中,我们发现HOTAIR在I/R模型大鼠中高表达,并且人为下调HOTAIR后,I/R的损伤和炎症反应均明显被抑制。我们还发现,miR-590-3p表达伴随着炎症因子的上调反而在I/R模型中下调。此外,当下调HOTAIR后,miR-590-3p的表达明显上调。进一步通过双荧光素酶报告基因实验,我们证明了HOTAIR可以作为“分子海绵”直接吸附miR-590-3p。此前已有大量研究探讨了miR-590-3p与NF-κB信号通路之间的关系。如Zhao等[15]通过在体内靶向NF-κB,发现miR-590-3p是一种新型的心肌炎症相关的miRNA。此外,Bao等[16]研究还表明,miR-590-3p通过p53/NF-κB通路保护氧化低密度脂蛋白诱导的血管内皮细胞凋亡。而在本研究中我们证明了HOTAIR直接抑制miR-590-3p,并促进I/R心肌组织NF-κB和血清炎症因子的表达,体外实验也得到了类似的结果。说明了HOTAIR可以作为“分子海绵”直接吸附miR-590-3p,从而激活NF-κB相关的炎症反应。
热休克蛋白(HSPs)是一类受氧化应激、病毒感染、紫外线辐射、乙醇和其他化学物质的作用被诱导表达增高的蛋白,它们主要按分子量命名,如该家族的HSPA1A又名HSP72[17]。HSPA1A能被氧化应激诱导而表达增高,并向细胞外释放[17]。研究表明AMI患者冠状动脉血栓的增加与HSPA1A的表达水平呈正相关,而且添加HSPA1A后二磷酸腺苷刺激的血小板聚集显著增加,也可以被抗HSPA1A的抗体所减少[17]。本研究发现,HSPA1A蛋白在I/R诱导的AMI大鼠心肌组织和H/R诱导的心肌细胞中都显著上调,因此HSPA1A很可能与调控AMI有关。本研究发生沉默HSPA1A可以负向调节I/R模型大鼠的炎症反应,抑制NF-κB和磷酸化NF-κB的表达水平,证实了HSPA1A是一种AMI的关键调控蛋白,它通过激活NF-κB促进AMI大鼠的心肌损伤和炎症反应,另外,研究还表明HSPA1A的过表达可以通过促进p-NF-κB P65的表达激活NF-κB信号通路[18],这支持了本研究中沉默HSPA1A对NF-κB P65具有抑制效果的结论。本研究还通过Western blot实验和双荧光素酶报告基因实验,证明了在心肌细胞中存在一种新的靶向关系,即HSPA1A受到miR-590-3p的靶向调控。经验证,miR-590-3p的mimic可明显抑制H9C2细胞中HSPA1A的表达。另外,下调HOTAIR后,I/R大鼠心肌组织和H/R心肌细胞中的HSPA1A以及IL-1β、IL-6、TNF-α的蛋白水平均明显下调。在下调HOTAIR的基础上继续上调HSPA1A后,H/R心肌细胞中的IL-1β、IL-6、TNF-α蛋白表达反而都显著上调。以上研究均表明,HSPA1A受HOTAIR/miR-590-3p的靶向调控从而激活NF-κB促进了AMI大鼠的炎症反应。
综上所述,本研究证明HOTAIR通过“分子海绵”吸附miR-590-3p从而促进了HSPA1A的表达,而且HSPA1A被HOTAIR/miR-590-3p轴调控从而激活了NF-κB相关的心肌炎症反应。我们的研究结果表明,靶向HOTAIR/miR-590-3p/HSPA1A轴可能是一种治疗AMI的方法。
