饲喂四环素和氨苄西林对德国小蠊雄成虫营养效应和3种解毒酶活性的影响*
2023-11-18沈惠芳张婷王国红田宝玉
沈惠芳,张婷,王国红,田宝玉*
(细胞逆境响应与代谢调控福建省高校重点实验室 福建师范大学生命科学学院,福建 福州 350108)
德国小蠊属蜚蠊目蜚蠊科小蠊属昆虫,是全球最严重的城市害虫之一[1],对公共卫生安全危害极为严重,常在人类居住地中生活,藏匿于浴室、厕所和厨房,德国小蠊的粪便和脱落的身体部位是过敏原的来源,会引发敏感人群的哮喘症状、儿童哮喘和过敏反应等[2]。目前,蟑螂种群的管控广泛依赖于杀虫剂的使用,但自20世纪50年代以来,杀虫剂耐药性一直是控制蟑螂的障碍。
研究表明饲喂抗生素会影响昆虫的生长和健康。Chloe等[3]通过给黑腹果蝇喂食链霉素,结果表明与正常黑腹果蝇相比,喂食链霉素的个体需要更长的时间来发育并且体重更轻。Zhu等[4]通过研究土壤中存在的抗生素污染对土壤食物链的影响发现抗生素处理使土壤跳虫体重的降低。Elena等[5]研究了抗生素甲氧苄啶对大型水蚤的寄主摄食的变化,结果表明受抗生素影响后水蚤的摄食和消化能力均下降。Raymann等[6]使用四环素喂食蜜蜂,研究发现喂食四环素影响了昆虫的健康。长时间使用四环素等广谱抗生素会对昆虫肠道微生物群落造成强大的选择压力,杀灭肠道内的敏感菌群,导致肠道微生物菌群多样性的丧失[7]。Lisa等[8]研究表明四环素类药物对特定微生物的选择性杀伤将导致这些微生物从肠道微生物群中丢失。Lee等[9]用氨苄西林处理德国小蠊,结果显示氨苄西林处理改变了德国小蠊肠道微生物群中的细菌组成。
肠道微生物可以帮助宿主降解有毒或有害物质[10],参与宿主对杀虫剂的抗性[11-13],对农药和农药抗性的进化产生变化,做出反应[12],增加解毒酶的产生使有毒的物质被分解等[14-15]。昆虫体内解毒酶包括谷胱甘肽S-转移酶(glutathione S-transferase,GST)和磷酸酶(phosphatase)等。谷胱甘肽S-转移酶是一种对杀虫剂产生代谢抗性的重要酶系,参与许多分子的解毒机制,高水平的GST活性与昆虫对杀虫剂的高抗性有关[16]。昆虫体内的磷酸酶对有机磷农药也具有极强的水解作用[17],昆虫体内的磷酸酶又分为酸性磷酸酶(Acid phosphatase,ACP)和碱性磷酸酶(Alkaline phosphatase,ALP或AKP),它们在昆虫机体的抗病性、解毒代谢和免疫防御过程发挥着重要功能[18-21]。
目前对于抗生素导致的昆虫肠道微生物紊乱对宿主的影响主要集中在对宿主肠道微生物群本身的变化趋势等方面,而对宿主生长和解毒酶活性方面的研究较少。不同的抗生素具有不同的杀菌谱,本研究选用广谱类的四环素并结合临床常用的氨苄西林为实验材料,通过饲喂德国小蠊盐酸四环素溶液以及氨苄西林钠和四环素混合溶液扰乱德国小蠊肠道微生物生态,以探究抗生素胁迫下的肠道微生物群的改变对于德国小蠊体内营养效应和三种解毒酶活性的影响,为解析肠道微生物在昆虫的营养利用和解毒机制中的作用奠定基础。
1 材料与方法
1.1 供试材料
德国小蠊:由福建省疾病预防控制中心赠送。
1.2 仪器与试剂
总蛋白测定试剂盒、酸性磷酸酶测定试剂盒、碱性磷酸酶测定试剂盒和谷胱甘肽S-转移酶测定试剂盒均购自南京建成生物工程研究所;盐酸四环素(Tetracyclin HCl)购于北京索莱宝(Solarbio)公司,氨苄西林钠(Ampicillin Na)购于上海蓝季科技发展有限公司。
1.3 试虫饲养
德国小蠊饲养在 260 mm×180 mm×140 mm 塑料盒中,塑料盒口内壁沿边缘涂抹一层宽约30 mm的凡士林和液体石蜡(1∶2,体积比)混合物以防止德国小蠊逃跑。盒中放置鼠粮和水作为德国小蠊的食物,两个纸板卷。使用人工智能气候箱饲养,饲养温度为(27±1)℃,相对湿度(RH)40%~50%,光周期12L∶12D。
1.4 试验设计
试验设3个处理,试验组饮用水为相对应的抗生素溶液。
⑴ 四环素处理组(T):0.5 mg/mL盐酸四环素溶液;⑵ 抗生素混合处理组(AT):0.5 mg/mL盐酸四环素和氨苄西林钠混合溶液(每mL溶液含0.25 mg盐酸四环素+0.25 mg氨苄西林钠);⑶ 对照组(C)。每个处理组重复3次,共9个小组。
试验前将德国小蠊进行随机分组,每个小组300只德国小蠊(不区分雌雄)。试验组连续7 d使用抗生素溶液作为德国小蠊的饮用水;第8 d换成无菌水,无菌水喂养7 d后再将无菌水换成相对应的抗生素溶液,以此类推进行抗生素连续规律间隔处理6个月;对照组始终使用无菌水作为饮用水。
抗生素溶液的制备:分别制备10 mg/mL的盐酸四环素溶液和氨苄西林溶液,过滤除菌后作为贮备液存于-20 ℃冰箱中备用,使用时将贮备液用无菌水稀释至饲喂浓度。
1.5 德国小蠊雄成虫营养指标测定
营养指标测定试虫准备:抗生素连续间隔处理6个月后在每个小组中随机取出5只羽化后一周的德国小蠊雄成虫,分别将其单独饲养于50 mm×36 mm×62 mm 的塑料盒中,饲喂鼠粮和无菌水,连续饲喂21 d后饥饿24 h。称量饲喂前饲料重量,饲喂前和饲喂后雄成虫鲜重。将雄虫、雄虫粪便和剩余饵料放入烘箱,60 ℃烘干至恒重。每个小组重复5次,每个处理组取样数为3×5=15(只)。
不同抗生素处理组间雄成虫干重参照Montandon[22]等的方法测定,依照下列公式计算各营养指标[23]:
相对生长率(RGR)=G/(B×T);
相对取食量(RCR)=I/(B×T);
食物利用率(ECI)=G/I×100%;
食物转化率(ECD)=G/(I-F)×100%;
近似消化率(AD)=(I-F)/I×100%;
增重率(WG)=(饲喂后鲜重-饲喂前鲜重)/饲喂前鲜重×100% 。
公式中:
G 为虫体增重,G=饲喂后干重-饲喂前干重;
B 为试验期间的平均体重,B=(饲喂前干重+饲喂后干重)/2;
I 为取食量,I=饲喂前食物干重-饲喂后食物干重;
F 为粪便干重;
T 为实验天数。
1.6 酶源制备
将抗生素处理6个月后的德国小蠊雄成虫饥饿24 h 后,取雄成虫除去翅、足和头部后一起称重,按质量(g)与提取液(mL)为1∶9的比例加入9倍体积预冷的PBS冰浴匀浆,4 ℃温度下 8000 r/min离心10 min,取上清液作为酶源,测定时再稀释。每个抗生素处理重复3次,每个小组取3只德国小蠊冰浴匀浆混为一个样品。酶活测定按照试剂盒说明书进行,总蛋白测定使用考马斯亮蓝法,试验按照说明书进行。
2 结果与分析
2.1 抗生素处理对德国小蠊雄成虫营养效应的影响
2.1.1 不同抗生素处理对德国小蠊雄成虫取食量和体重影响
由表1可知,四环素处理组的德国小蠊经四环素处理后体重较对照组低,且差异显著(p<0.05),但与抗生素混合处理组(AT)无显著差异(p>0.05)。两试验组(T、AT)增重率与对照组(C)相比无显著差异(p>0.05)。对照组德国小蠊取食量为31.05 mg显著高于四环素处理组(T)和抗生素混合处理组(AT)(p<0.05)。
2.1.2不同抗生素处理对德国小蠊雄虫的营养效应
由表2可知,抗生素处理对德国小蠊雄成虫的营养效应与对照组相比差异显著(p>0.05),对照组雄成虫的相对取食量显著高于两试验组(T、AT)(p>0.05),两实验组(T、AT)间相对取食量无显著差异(p>0.05)。对照组(C)的食物利用率达12.97% ,显著高于四环素处理组(T)和抗生素混合处理组(AT)(p>0.05),四环素处理组(T)和抗生素混合处理组(AT)的食物利用率分别为8.34%和6.90% ,两组间无显著差异(p>0.05)。四环素组(T)的近似消化率达73.25% ,显著高于对照组(C)(p>0.05),与抗生素混合处理组(AT)无显著差异。两试验组(T、AT)的相对生长量和食物转化率与对照组(C)相比无显著差异(p>0.05)。

组别T AT C取食量(mg)22.64±3.89b 20.72±4.02b 31.05±5.20a初始湿重(mg)41.33±2.24a 43.47±4.17a 43.73±5.42a 21 d后湿重(mg)45.67±2.68b 47.47±3.99ab 49.53±5.72a湿重增重率(10.60±5.66)%a(9.43±4.94)%a(13.47±4.39)%a
2.2 抗生素处理对德国小蠊雄成虫解毒酶活性的影响
2.2.1 处理后各组间德国小蠊雄成虫体内 ACP的活力比较
由图1可以看出四环素组(T)ACP活性最高,抗生素混合处理组(AT)ACP 活力最低。其中四环素组(T)的ACP活力为0.0066 金氏单位/gprot , 抗生素混合处理组(AT)ACP活力为0.0035金氏单位/gprot,对照组(C)ACP活力为0.0042金氏单位/gprot,但是三组间无显著差异(p>0.05)。
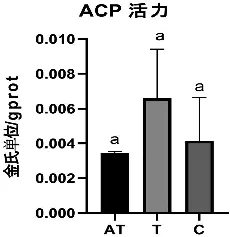
图1 处理后各组ACP活力比较
2.2.2 处理后各组间德国小蠊雄成虫体内 AKP的活力比较
由图2可以看出四环素组(T)AKP活性最高,抗生素混合处理组(AT)AKP 活力最低。其中四环素组(T)的AKP活力为0.00047 金氏单位/gprot ,抗生素混合处理组(AT)AKP活力为0.000324金氏单位/gprot,对照组(C)AKP活力为0.00041金氏单位/gprot,但是三组间无显著差异(p>0.05)。
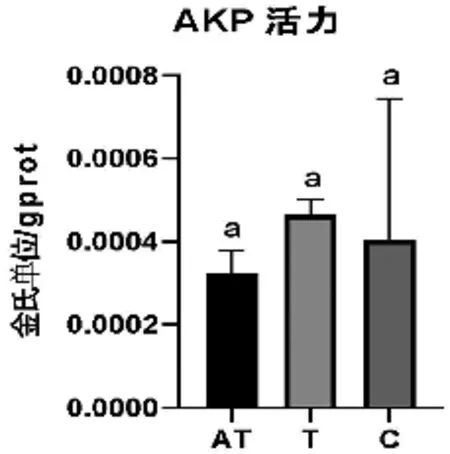
图2 处理后各组AKP活力比较
2.2.3 处理后各组间德国小蠊体内 GST的活力比较
由图3可以看出四环素组(T)GST活性最高,对照组GST 活力最低。其中四环素组(T)的GST活力为3.63金氏单位/gprot , 抗生素混合处理组(AT)GST活力为3.60金氏单位/gprot,对照组(C)GST活力为3.27金氏单位/gprot,三组间无显著差异(p>0.05)。
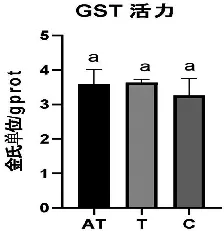
图3 处理后各组GST活力比较
3 讨论
肠道菌群在德国小蠊的营养代谢中发挥着至关重要的作用,抗生素的使用会对肠道微生物群产生多种负面影响,包括物种多样性降低、代谢活动改变和抗生素耐药微生物的选择,这反过来又将影响宿主的生长和营养代谢[24]。本研究试验结果显示抗生素的处理对德国小蠊雄成虫的营养利用有显著影响,其中四环素处理和抗生素混合处理显著降低了德国小蠊雄成虫的相对取食量(p<0.05)和食物利用率(p<0.05),显著提高了四环素组的近似消化率(p<0.05),显著降低了四环素处理组的德国小蠊的体重(p<0.05)。研究表明肠道微生物群会影响宿主饮食中的能量收集和能量储存[25],是宿主能量摄取和储存的重要调节剂[26]。肠道微生物群可以通过调节宿主的多种内分泌、神经和免疫途径来影响宿主的基本功能,包括消化、能量代谢等[27]。
先前研究表明肠道菌群在德国小蠊的代谢解毒机制中发挥着重要作用,抗生素的处理将导致德国小蠊肠道微生物群的结构和组成发生变化,这种变化可能会对宿主的杀虫剂耐药性产生影响[28]。然而,关于肠道微生物如何影响德国小蠊解毒机制尚不清晰。本文通过实验显示抗生素处理后的德国小蠊体内酸性磷酸酶、碱性磷酸酶以及谷胱甘肽-S-转移酶的活性与对照组相比没有显著性差异,结果表明德国小蠊肠道微生物的改变不会显著影响宿主本身的解毒酶活性。当然,抗生素处理后的宿主本身代谢活性的稳定也很可能与抗生素间隔处理的方式和处理时间有关。有研究表明因抗生素处理导致的肠道微生物群落结构及微生物种类、组成、丰度等的变化会在一定的时间内在一定程度上有所恢复[29,30]。抗生素处理不显著影响德国小蠊体内解毒酶活性也可能是因为肠道微生物对宿主解毒机制的影响不是通过诱导体内解毒酶活性,而是通过肠道微生物本身对杀虫剂的解毒作用,降低了杀虫剂的浓度和毒性[31-34]。
对于长期接触抗生素对肠道微生物群所造成的生态后果,包括抗生素耐药性等的了解仍然是有限的。在这里,我们研究了长期接触单一种抗生素和多种抗生素混合对德国小蠊雄成虫营养效应指标和解毒酶活性所造成的变化,发现肠道菌群生态紊乱降低了德国小蠊的体重和取食量,对德国小蠊的营养利用有显著影响;而对德国小蠊解毒酶活性没有显著影响,且在长期的抗生素选择压力中,肠道微生物受单种抗生素和多种抗生素共同胁迫的后果对其解毒酶活性没有显著差异。本试验为抗生素的使用和肠道微生物的功能提供科学思路。
